Đề cương ôn tập học kỳ 2 môn Hóa học 10
Bạn đang xem tài liệu "Đề cương ôn tập học kỳ 2 môn Hóa học 10", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
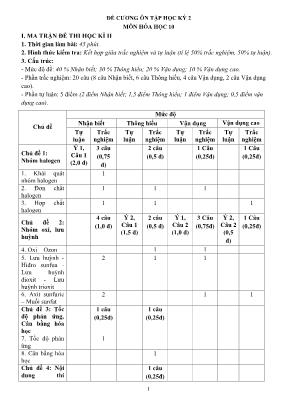
1 ĐỀ CƯƠNG ÔN TẬP HỌC KỲ 2 MÔN HÓA HỌC 10 I. MA TRẬN ĐỀ THI HỌC KÌ II 1. Thời gian làm bài: 45 phút. 2. Hình thức kiểm tra: Kết hợp giữa trắc nghiệm và tự luận (tỉ lệ 50% trắc nghiệm, 50% tự luận). 3. Cấu trúc: - Mức độ đề: 40 % Nhận biết; 30 % Thông hiểu; 20 % Vận dụng; 10 % Vận dụng cao. - Phần trắc nghiệm: 20 câu (8 câu Nhận biết, 6 câu Thông hiểu, 4 câu Vận dụng, 2 câu Vận dụng cao). - Phần tự luận: 5 điểm (2 điểm Nhận biết; 1,5 điểm Thông hiểu; 1 điểm Vận dụng; 0,5 điểm vận dụng cao). Chủ đề Mức độ Nhận biết Thông hiểu Vận dụng Vận dụng cao Tự luận Trắc nghiệm Tự luận Trắc nghiệm Tự luận Trắc nghiệm Tự luận Trắc nghiệm Chủ đề 1: Nhóm halogen Ý 1, Câu 1 (2,0 đ) 3 câu (0,75 đ) 2 câu (0,5 đ) 1 Câu (0,25đ) 1 Câu (0,25đ) 1. Khái quát nhóm halogen 1 2. Đơn chất halogen 1 1 1 3. Hợp chất halogen 1 1 1 Chủ đề 2: Nhóm oxi, lưu huỳnh 4 câu (1,0 đ) Ý 2, Câu 1 (1,5 đ) 2 câu (0,5 đ) Ý 1, Câu 2 (1,0 đ) 3 Câu (0,75đ) Ý 2, Câu 2 (0,5 đ) 1 Câu (0,25đ) 4. Oxi – Ozon 1 1 5. Lưu huỳnh - Hiđro sunfua - Lưu huỳnh đioxit - Lưu huỳnh trioxit 2 1 1 6. Axit sunfuric – Muối sunfat 2 1 1 Chủ đề 3: Tốc độ phản ứng, Cân bằng hóa học 1 câu (0,25đ) 1 câu (0,25đ) 7. Tốc độ phản ứng 1 8. Cân bằng hóa học 1 Chủ đề 4: Nội dung thí 1 câu (0,25đ) 2 nghiệm thực hành Tổng số điểm 2,0 2,0 1,5 1,5 1,0 1,0 0,5 0,5 4,0 điểm 3,0 điểm 2,0 điểm 1,0 điểm II. TRẮC NGHIỆM Câu 1: Khí HCl khi tan trong nước tạo thành dung dịch axit clohiđric. Axit clohiđric khi tiếp xúc với quỳ tím làm quỳ tím A. Chuyển sang màu đỏ. B. Chuyển sang màu xanh. C. Không chuyển màu. D. Chuyển sang không màu. Câu 2: Sục khí clo vào lượng dung dịch NaOH ở nhiệt độ thường, sản phẩm là A. NaCl, NaClO. B. NaCl, NaClO2. C. NaCl, NaClO3. D. Chỉ có NaCl. Câu 3: Trong phòng thí nghiệm, clo thường được điều chế bằng cách oxi hóa hợp chất nào sau đây? A. KCl. B. KMnO4. C. NaCl. D. HCl. Câu 4: Cấu hình electron lớp ngoài cùng của các nguyên tố nhóm halogen là A. ns2np4. B. ns2np3. C. ns2np5. D. ns2np6. Câu 5: Khí Cl2 không tác dụng với A. khí O2. B. dung dịch NaOH. C. H2O. D. dung dịch Ca(OH)2. Câu 6: Chất nào sau đây không tác dụng với dung dịch HCl? A. Al. B. KMnO4. C. Cu(OH)2. D. Ag. Câu 7: Kim loại nào sau đây tác dụng với khí Cl2 và dung dịch HCl tạo ra cùng một muối là A. Cu. B. Mg. C. Fe. D. Ag. Câu 8: Trong các phản ứng sau, phản ứng nào sai? A. Zn + 2HCl → ZnCl2 + H2. B. Cu + 2HCl → CuCl2 + H2. C. CuO + 2HCl → CuCl2 + H2O. D. AgNO3 + HCl → AgCl + HNO3. Câu 9: Trong phòng thí nghiệm, clo được điều chế bằng cách cho HCl đặc phản ứng với A. NaCl. B. Fe. C. F2. D. KMnO4. Câu 10: Ứng dụng không phải của Clo là A. Sản xuất chất tẩy trắng, sát trùng và hóa chất vô cơ. B. Diệt trùng và tẩy trắng. C. Sản xuất các hóa chất hữu cơ. D. Sản xuất chất dẻo Teflon làm chất chống dính ở xoong, chảo. Câu 11: Khí HCl có thể được điều chế bằng cách cho tinh thể muối ăn tác dụng với chất nào sau đây? A. H2SO4 loãng. B. HNO3. C. H2SO4 đậm đặc. D. NaOH. Câu 12: Vị trí của nguyên tố Oxi trong bảng tuần hoàn hóa học là A. Ô thứ 8, chu kì 3, nhóm VIA. B. Ô thứ 8, chu kì 2, nhóm VIA. C. Ô thứ 16, chu kì 3, nhóm VIA. D. Ô thứ 16, chu kì 2, nhóm VIA. Câu 13: Hiđro sunfua (H2S) là chất có A. Tính axit mạnh. B. Tính oxi hóa mạnh. C. Vừa có tính axit, vừa có tính bazơ. D. Tính khử mạnh. Câu 14: Ion X2- có cấu hình electron lớp ngoài cùng là 2s22p6. X là nguyên tố nào sau đây? A. Oxi. B. Lưu huỳnh. C. Clo. D. Flo. 3 Câu 15: Nguyên tử nguyên tố X có tổng số electron ở các phân lớp p là 10. Nguyên tố X là A. Na. B. Cl. C. O. D. S. Câu 16: Cho FeS tác dụng với dung dịch HCl, khí bay ra là A. H2S. B. Cl2. C. SO2. D. H2. Câu 17: Chất được dùng để tráng lên phim ảnh là: A. AgBr. B. Mg. C. Na2S2O3. D. AgCl. Câu 18: Chất nào sau đây không tác dụng với dung dịch HCl? A. Al. B. KMnO4. C. Cu(OH)2. D. Ag. Câu 19: Trong nước clo có chứa các chất: A. HCl, HClO. B. HCl, HClO, Cl2. C. HCl, Cl2. D. Cl2. Câu 20: Trong phòng thí nghiệm, người ta thường điều chế clo bằng cách A. cho dung dịch HCl đặc tác dụng với MnO2, đun nóng. B. điện phân dung dịch NaCl có màng ngăn. C. điện phân nóng chảy NaCl. D. cho F2 đẩy Cl2 ra khỏi dung dịch NaCl. Câu 21: Để phân biệt oxi và ozon có thể dùng chất nào sau đây? A. Cu. B. Hồ tinh bột. C. H2. D. Dung dịch KI và hồ tinh bột. Câu 22: Cho phản ứng: SO2 + Cl2 + 2H2O → 2HCl + H2SO4. Vai trò của lưu huỳnh đioxit là A. oxi hóa. B. vừa oxi hóa, vừa khử. C. khử. D. Không oxi hóa khử. Câu 23: Phản ứng không xảy ra là A. 2Mg + O2 2MgO. B. C2H5OH + 3O2 2CO2 + 3H2O. C. 2Cl2 + 7O2 2Cl2O7. D. 4P + 5O2 2P2O5. Câu 24: Các khí có thể cùng tồn tại trong một hỗn hợp là A. NH3 và HCl. B. H2S và Cl2. C. Cl2 và O2. D. H2S và O2. Câu 25: Chất nào sau đây không phản ứng với O2 là A. SO3. B. P. C. Ca. D. C2H5OH. Câu 26: Axit H2SO4 loãng tác dụng với Fe tạo thành sản phẩm: A. Fe2(SO4)3 và H2. B. FeSO4 và H2. C. FeSO4 và SO2. D. Fe2(SO4)3 và SO2. Câu 27: Kim loại nào sau đây tác dụng với dung dịch H2SO4 loãng và dung dịch H2SO4 đặc nóng cho 2 loại muối khác nhau? A. Fe. B. Mg. C. Cu. D. Ag. Câu 28: Kim loại nào sau đây tác dụng với khí Cl2 và dung dịch HCl tạo ra cùng một muối là A. Cu. B. Mg. C. Fe. D. Ag. Câu 29: Trong các phản ứng sau, phản ứng nào sai? A. Zn + 2HCl → ZnCl2 + H2. B. Cu + 2HCl → CuCl2 + H2. C. CuO + 2HCl → CuCl2 + H2O. D. AgNO3 + HCl → AgCl + HNO3. Câu 30: Dãy gồm các kim loại đều tác dụng được với dung dịch HCl là: A. Cu, Fe, Al. B. Fe, Mg, Al. C. Cu, Pb, Ag. D. Fe, Au, Cr. Câu 31: Đặc điểm nào dưới đây là đặc điểm chung của các đơn chất halogen? A. Ở điều kịên thường là chất khí. B. Tác dụng mạnh với nước. C. Vừa có tính oxi hoá, vừa có tính khử. D. Có tính oxi hoá mạnh. ot⎯⎯→ ot⎯⎯→ ot⎯⎯→ ot⎯⎯→ 4 Câu 32: Cho FeS tác dụng với dung dịch HCl, khí bay ra là A. H2S. B. Cl2. C. SO2. D. H2. Câu 33: Trong điều kiện thường, dung dịch H2S tiếp xúc với oxi của không khí, dung dịch dần chuyển sang màu gì? A. Tím. B. Nâu. C. Xanh nhạt. D. Vàng. Câu 34: Lưu huỳnh trong chất nào sau đây chỉ có tính khử? A. H2S. B. SO2. C. Na2S2O3. D. H2SO4. Câu 35: Trong các halogen sau đây, halogen có tính oxi hóa mạnh nhất là A. Brom. B. Clo. C. Iot. D. Flo. Câu 36: Hóa chất nào sau đây không được đựng bằng lọ thủy tinh ? A. HNO3. B. HF. C. HCl. D. NaOH. Câu 37: Trong phản ứng : Cl2 + H2O ⎯⎯→⎯⎯ HCl + HClO, Clo đóng vai trò A. Chất tan. B. Chất khử. C. Vừa là chất oxi hóa, vừa là chất khử. D. Chất oxi hóa. Câu 38: Dung dịch H2SO4 loãng phản ứng được với tất cả các kim loại thuộc dãy nào sau đây? A. Cu, Na. B. Ag, Zn. C. Mg, Al. D. Au, Pt. Câu 39: Axit H2SO4 loãng tác dụng với Fe tạo thành sản phẩm: A. Fe2(SO4)3 và H2. B. FeSO4 và H2. C. FeSO4 và SO2. D. Fe2(SO4)3 và SO2. Câu 40: Dung dịch axit sunfuric loãng tác dụng được với 2 chất trong dãy nào sau đây? A. S và H2S. B. Fe và Fe(OH)3. C. Cu và Cu(OH)2. D. C và CO2. Câu 41: Dung dịch nào sau đây không phản ứng với dung dịch AgNO3? A. NaCl. B. NaF. C. CaCl2. D. NaBr. Câu 42: Phản ứng nào sau đây chứng tỏ HCl có tính khử? A. 4HCl + MnO2 → MnCl2 + Cl2 + 2H2O. B. HCl + Mg → MgCl2 + H2. C. HCl + NaOH → NaCl + H2O. D. 2HCl + CuO → CuCl2 + H2O. Câu 43: Các dung dịch: NaF, NaI, NaCl, NaBr. Chỉ dùng một thuốc thử nào sau đây để nhận biết các dung dịch trên? A. AgNO3. B. Dung dịch NaOH. C. Hồ tinh bột. D. Cl2. Câu 44: Dãy các chất nào sau đây đều tác dụng với axit clohiđric? A. Fe2O3, KMnO4, Cu, Fe, AgNO3. B. Fe, CuO, H2SO4, Ag, Mg(OH)2. C. KMnO4, Cu, Fe, H2SO4, Mg(OH)2. D. Fe2O3, KMnO4¸Fe, CuO, AgNO3. Câu 45: Phản ứng nào sau đây xảy ra không tạo muối FeCl2? A. Fe + HCl. B. Fe3O4 + HCl. C. Fe + Cl2. D. Fe + FeCl3. Câu 46: Liên kết hóa học giữa các nguyên tố trong phân tử HCl thuộc loại liên kết: A. Cộng hóa trị không cực. B. Ion. C. Cộng hóa trị có cực. D. Hiđro. Câu 47: Chất nào sau đây không phản ứng với O2 là A. SO3. B. P. C. Ca. D. C2H5OH. Câu 48: Lưu huỳnh trong chất nào sau đây chỉ có tính khử? A. H2S. B. SO2. C. Na2S2O3. D. H2SO4. Câu 49: Muốn pha loãng dung dịch axit H2SO4 đặc cần làm như sau: A. Rót từ từ dung dịch axit đặc vào nước. B. Rót từ từ nước vào dung dịch axit đặc. 5 C. Rót nhanh dung dịch axit đặc vào nước. D. Rót thật nhanh nước vào dung dịch axit đặc. Câu 50: Dãy chất nào sau đây gồm những chất đều tác dụng được với dung dịch H2SO4 loãng? A. Cu, ZnO, NaOH, CaOCl2. B. CuO, Fe(OH)2, Al, NaCl. C. Mg, ZnO, Ba(OH)2, CaCO3. D. Na, CaCO3, Mg(OH)2, BaSO4. Câu 51: H2SO4 đặc nóng không tác dụng với chất nào sau đây? A. Fe. B. NaCl rắn. C. Ag. D. Au. Câu 52: Ở điều kiện thường, để so sánh tính oxi hóa của ozon mạnh hơn oxi ta có thể dùng A. Ag. B. Hg. C. S. D. Mg Câu 53: Phản ứng nào sau đây lưu huỳnh đóng vai trò là chất oxi hóa? A. S + O2 ⎯→⎯ 0t SO2. B. S + 2Na ⎯→⎯ 0t Na2S. C. S + 2H2SO4 (đ) ⎯→⎯ 0t 3SO2 + 2H2O. D. S + 6HNO3 (đ) ⎯→⎯ 0t H2SO4 + 6NO2 + 2H2O. Câu 54: Cho các phản ứng hóa học sau: (a) S + O2 ot⎯⎯→ SO2 (b) S + 3F2 ot⎯⎯→ SF6 (c) S + 6HNO3 ot⎯⎯→ H2SO4 + 6NO2 + 2H2O (d) S + Hg →HgS Số phản ứng trong đó S thể hiện tính khử là A. 2. B. 3. C. 1. D. 4. Câu 55: Đưa mảnh giấy lọc tẩm dung dịch KI và hồ tinh bột vào bình đựng khí ozon, hiện tượng gì xuất hiện trên giấy lọc? A. màu xanh đậm. B. màu đỏ. C. màu vàng. D. Không hiện tượng. Câu 56: Ở phản ứng nào sau đây, SO2 đóng vai trò chất oxi hoá? A. SO2 + Br2 + 2H2O → 2HBr + H2SO4. B. 2SO2 + O2 → 2SO3. C. SO2 + 2H2S → 3S + 2H2O. D. 5SO2 + 2KMnO4 + 2H2O → K2SO4 + 2H2SO4 + 2MnSO4. Câu 57: Phản ứng nào sau đây chứng tỏ HCl có tính khử? A. 4HCl + MnO2 → MnCl2 + Cl2 + 2H2O. B. HCl + Mg → MgCl2 + H2. C. HCl + NaOH → NaCl + H2O. D. 2HCl + CuO → CuCl2 + H2O. Câu 58: Cho phản ứng: KMnO4 + HCl (đặc) 0 t⎯⎯→ KCl + MnCl2 + Cl2 + H2O Hệ số cân bằng phản ứng là các số tối giản. Số phân tử HCl đóng vai trò chất khử là: A. 16. B. 5. C. 10. D. 8. Câu 59: Dung dịch axit sunfuric loãng tác dụng được với 2 chất trong dãy nào sau đây? A. S và H2S. B. Fe và Fe(OH)3. C. Cu và Cu(OH)2. D. C và CO2. Câu 60: Cho FeCO3 tác dụng với H2SO4 đặc nóng dư. Sản phẩm khí thu được là A. CO2. B. H2 và CO2. C. SO2 và CO2. B. SO2. Câu 61: Sục một dòng khí H2S vào dung dịch CuSO4 thấy xuất hiện kết tủa đen. Khẳng định nào sau đây đúng? A. CuS không bền trong dung dịch axit phân hủy thành CuO có màu đen. B. CuS không tan trong dung dịch H2SO4. C. Axit H2SO4 yếu hơn axit H2S. . D. Xảy ra phản ứng oxi hóa – khử. Câu 62: Cho các chất khí sau đây: Cl2, SO2, CO2, SO3. Chất làm mất màu dung dịch brom là 6 A. CO2. B. SO3. C. Cl2. D. SO2. Câu 63: Cho các phản ứng sau: 4HCl + MnO2 o t⎯⎯→ MnCl2 + Cl2 + 2H2O 14HCl + K2Cr2O7 o t⎯⎯→ 2KCl + 2CrCl3 + 3Cl2 + 7H2O 16HCl + 2KMnO4 o t⎯⎯→ 2KCl + 2MnCl2 + 5Cl2 + 8H2O 2HCl + Fe ⎯⎯→FeCl2 + H2 6HCl + 2Al ⎯⎯→ 2AlCl3 + 3H2 Số phản ứng trong đó HCl thể hiện tính khử là A. 3. B. 4. C. 2. D. 1. Câu 64: Axit sunfuric đặc không được dùng để làm khô khí nào sau đây? A. O3. B. Cl2. C. H2S. D. O2. Câu 65: Phản ứng sản xuất SO2 trong công nghiệp là: A. Cu + 2H2SO4 đặc ⎯→⎯ ot SO2 + CuSO4 + 2H2O. B. 4FeS2 + 11O2 ⎯→⎯ ot 8SO2 + 2Fe2O3. C. C + 2H2SO4 đặc ⎯→⎯ ot 2SO2 + CO2 + 2H2O. D. K2SO3 + H2SO4 ⎯→⎯ ot K2SO4 + SO2 + H2O. Câu 66: Trong công nghiệp người ta thường sản xuất SO2 từ: A. FeS, S. B. FeS2, H2S. C. S, FeS2. D. H2S, SO2 Câu 67: yếu tố nào không ảnh hưởng đến tốc độ phản ứng hóa học A. Nhiệt độ B. Thể tích C. Nồng độ D. Chất xúc tác Câu 68: Cho hệ cân bằng :2SO2 (k) + O2 (k) 2 SO3 (k) ∆H< 0 Cân bằng chuyển dịch theo chiều thuận khi A. Tăng nhiệt độ hệ B. tăng áp suất của hệ C. Thêm xúc tác D. Thêm oxi vào hệ Câu 69: Cho Hình vẽ mô tả sự điều chế Clo trong phòng Thí nghiệm như sau: Phát biểu nào sau đây không đúng: A.Dung dịch H2SO4 đặc có vai trò hút nước, có thể thay H2SO4 bằng CaO. B.Khí Clo thu được trong bình eclen là khí Clo khô. C.Có thể thay MnO2 bằng KMnO4 hoặc KClO3 D.Không thể thay dung dịch HCl bằng dung dịch NaCl. Câu 70: Cho hình vẽ mô tả quá trình điều chế dung dịch HCl trong phòng thí nghiệm dd NaCl dd H2SO4 đặc Dd HCl đặc Eclen sạch để thu khí Clo MnO2 7 Phát biểu nào sau đây là không đúng: A.NaCl dùng ở trạng thái rắn B.H2SO4 phải là dung dịch đặc C. Phản ứng xảy ra ở nhiệt độ phòng. D. Khí HCl thoát ra hòa tan vào nước cất tạo thành dung dịch axit Clohidric II. TỰ LUẬN 1. HOÀN THÀNH PTPƯ VÀ NHẬN BIẾT Bài 1: Hoàn thành các phương trình phản ứng háo học theo sơ đồ chuyển hóa sau: 1) MnO2 → Cl2 → HCl → NaCl → Cl2 → H2SO4 → HCl 2) (1) (2) (3) (4) (5) (6) 2 2 3 2 4 2 4 3FeS SO SO H SO Na SO NaCl NaNO⎯⎯→ ⎯⎯→ ⎯⎯→ ⎯⎯→ ⎯⎯→ ⎯⎯→ Bài 2: Hoàn thành các phương trình hóa học theo sơ đồ sau (ghi rõ điều kiện phản ứng nếu có). a. Fe + Cl2 ⎯⎯→ b. BaCl2 + CuSO4 ⎯⎯→ c. HCl + Fe(OH)3 ⎯⎯→ d. SO2 + dung dịch Br2 ⎯⎯→ e. Al + H2SO4 đặc, nóng ⎯⎯→ Bài 3: Nhận biết các lọ mất nhãn sau. 1. NaOH, HCl, HNO3, NaCl. Viết các phương trình đã xảy ra 2. KOH, KNO3, K2SO4, H2SO4. Bài 4: Cho 31,4 (g) hỗn hợp X gồm Al và Zn tác dụng vừa đủ với dung dịch HCl 2 (M) thu được 15,68 (l) H2 (đkc). a) Tính % khối lượng từng chất trong X. b) Tính thể tích HCl đã dùng. Bài 5: Cho 11,28 (g) hỗn hợp X gồm Fe và Mg tác dụng 400 (ml) dung dịch H2SO4 2M thu được dung dịch Y và 6,048 khí (đkc). a) Tính khối lượng từng chất trong X. b) Cho dung dịch Y tác dụng với dung dịch NaOH dư. Tính khối lượng kết tủa thu được? c) Tính khối lượng hỗn hợp muối Y. Bài 6: Cho 12 gam hỗn hợp X gồm Fe và Cu tác dụng với dung dịch H2SO4 đặc, nóng (dư) thu được 5,6 lít khí SO2 (sản phẩm khử duy nhất, ở đktc) và dung dịch Y. a) Tính phần trăm khối lượng mỗi kim loại trong hỗn hợp X? b) Cho dung dịch Y tác dụng với dung dịch NaOH (dư) thu được kết tủa. Lọc, tách kết tủa đem nung trong không khí đến khối lượng không đổi thu được a gam chất rắn. Tính a. Bài 7: Viết các phương trình phản ứng chứng minh rằng a. Tính oxi hóa giảm dần từ F2 đến I2 b. Axit HF là axit yếu nhưng hòa tan được thủy tinh c. SO2 vừa thể hiện tính oxi hóa, vừa thể hiện tính khử NaCl (r) + H2SO4(đ) 8 d. H2S phản ứng với dung dịch kiềm tạo muối axit và muối trung hòa e. O3 thể hiện tính oxi hóa mạnh hơn oxi f. H2SO4 đặc có tính oxi hóa mạnh và tính háo nước g. Axit HCl thể hiện tính khử và tính oxi hóa h. Dung dịch H2SO4 loãng là một axit mạnh
Tài liệu đính kèm:
 de_cuong_on_tap_hoc_ky_2_mon_hoa_hoc_10.pdf
de_cuong_on_tap_hoc_ky_2_mon_hoa_hoc_10.pdf





