Tự học Hóa học 9 - Chương 3: Phi kim – Sơ lược về bảng tuần hoàn các nguyên tố hóa học
Bạn đang xem tài liệu "Tự học Hóa học 9 - Chương 3: Phi kim – Sơ lược về bảng tuần hoàn các nguyên tố hóa học", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
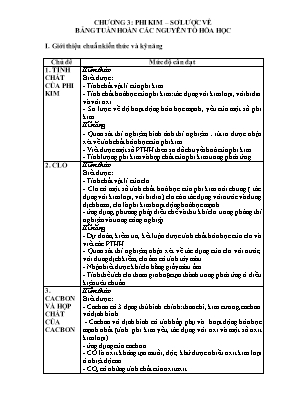
CHƯƠNG 3: PHI KIM – SƠ LƯỢC VỀ BẢNG TUẦN HOÀN CÁC NGUYấN TỐ HểA HỌC I. Giới thiệu chuẩn kiến thức và kỹ năng Chủ đề Mức độ cần đạt 1. TÍNH CHẤT CỦA PHI KIM Kiến thức Biết được: - Tớnh chất vật lớ của phi kim. - Tớnh chất hoỏ học của phi kim: tỏc dụng với kim loại, với hiđro và với oxi. - Sơ lược về độ hoạt động húa học mạnh, yếu của một số phi kim. Kĩ năng - Quan sỏt thớ nghiệm, hỡnh ảnh thớ nghiệmrỳt ra được nhận xột về tớnh chất húa học của phi kim. - Viết được một số PTHH theo sơ đồ chuyển hoỏ của phi kim . - Tớnh lượng phi kim và hợp chất của phi kim trong phản ứng. 2. CLO Kiến thức Biết được: - Tớnh chất vật lớ của clo. - Clo cú một số tớnh chất hoỏ học của phi kim núi chung ( tỏc dụng với kim loại, với hiđro), clo cũn tỏc dụng với nước và dung dịch bazơ, clo là phi kim hoạt động hoỏ học mạnh. - ứng dụng, phương phỏp điều chế và thu khớ clo trong phũng thớ nghiệm và trong cụng nghiệp. Kĩ năng - Dự đoỏn, kiểm tra, kết luận được tớnh chất húa học của clo và viết cỏc PTHH. - Quan sỏt thớ nghiệm, nhận xột về tỏc dụng của clo với nước, với dung dịch kiềm, clo ẩm cú tớnh tảy màu. - Nhận biết được khớ clo bằng giấy màu ẩm. - Tớnh thể tớch clo tham gia hoặc tạo thành trong phản ứng ở điều kiện tiờu chuẩn. 3. CACBON VÀ HỢP CHẤT CỦA CACBON Kiến thức Biết được: - Cacbon cú 3 dạng thự hỡnh chớnh: than chỡ, kim cương, cacbon vụ định hỡnh. - Cacbon vụ định hỡnh cú tớnh hấp phụ và hoạt động húa học mạnh nhất (tớnh phi kim yếu, tỏc dụng với oxi và một số oxit kim loại). - ứng dụng của cacbon. - CO là oxit khụng tạo muối, độc, khử được nhiều oxit kim loại ở nhiệt độ cao. - CO2 cú những tớnh chất của oxit axit. - H2CO3 là axit yếu, khụng bền. - Tớnh chất hoỏ học của muối cacbonat (tỏc dụng với dung dịch axit, dung dịch bazơ, dung dịch muối khỏc, bị nhiệt phõn huỷ). - Chu trỡnh của cacbon trong tự nhiờn và vấn đề bảo vệ mụi trường sống. Kĩ năng - Quan sỏt thớ nghiệm, hỡnh ảnh thớ nghiệm rỳt ra được nhận xột về tớnh chất của cacbon. - Viết được cỏc PTHH của cacbon với oxi, với một số oxit kim loại. - Tớnh lượng cacbon và hợp chất của cacbon trong phản ứng. - Quan sỏt được thớ nghiệm, hỡnh ảnh thớ nghiệm... rỳt ra tớnh chất húa học của CO, CO2, muối cacbonat. - Xỏc định phản ứng thực hiện được hay khụng và viết cỏc PTHH. - Nhận biết được khớ CO2, một số muối cacbonat cụ thể. - Tớnh % thể tớch CO và CO2 trong hỗn hợp. 4. SILIC – CễNG NGHIỆP SILICAT Kiến thức Biết được: - Silic là phi kim hoạt động yếu( tỏc dụng được với oxi, khụng phản ứng trực tiếp với hiđro) , SiO2 là một oxit axit (tỏc dụng với kiềm, muối cacbonat kim loại kiềm ở nhiệt độ cao). - Một số ứng dụng quan trọng của silic, silic đioxit và muối silicat. - Sơ lựơc về thành phần và cỏc cụng đoạn chớnh sản xuất thuỷ tinh, đồ gốm, xi măng. Kĩ năng - Đọc và túm tắt được thụng tin về Si, SiO2, muối silicat, sản xuất thuỷ tinh, đồ gốm, xi măng. - Viết được cỏc PTHH minh hoạ cho tớnh chất của Si, SiO2, muối silicat. 5. SƠ LƯỢC BẢNG TUẦN HOÀN CÁC NGUYấN TỐ HểA HỌC Kiến thức Biết được: - Cỏc nguyờn tố trong bảng tuần hoàn được sắp xếp theo chiều tăng dần của điện tớch hạt nhõn nguyờn tử . Lấy thớ dụ minh hpạ. - Cấu tạo bảng tuần hoàn gồm : ụ, nhúm, chu kỡ. Lấy thớ dụ minh hoạ. - Quy luật biến đổi tớnh kim loại, phi kim trong chu kỡ, nhúm. Lấy thớ dụ minh hpạ. - ý nghĩa của bảng tuần hoàn: Sơ lược về mối liờn hệ giữa cấu tạo nguyờn tử, vị trớ nguyờn tố trong bảng tuần hoàn và tớnh chất cơ bản của nú. Kĩ năng - Quan sỏt bảng tuần hoàn, ụ nguyờn tố cụ thể, nhúm I, VII, chu kỡ 2,3 rỳt ra nhận xột về ụ nguyờn tố, về chu kỡ, nhúm.- Từ cấu tạo nguyờn tử của một số nguyờn tố điển hỡnh (thuộc 20 nguyờn tố đầu tiờn) suy ra vị trớ và tớnh chất cơ bản của chỳng và ngược lại. - So sỏnh tớnh kim loại hoặc phi kim của một nguyờn tố cụ thể với cỏc nguyờn tố lõn cận (trong số 20 nguyờn tố đầu tiờn) II. Cõu hỏi và bài tập theo chuẩn kiến thức, kỹ năng 3.1. Cho sơ đồ chuyển hoá sau: Phi kim đ oxitaxit (1) đ oxitaxit (2) đ axit đ muối sunfat tan đ muối sunfat không tan a) Tìm công thức các chất thích hợp để thay cho tên chất trong sơ đồ b) Viết các phương trình hoá học biểu diễn chuyển hoá trên 3.2. Viết 3 phương trình hoá học trong mỗi phương trình đều có phi kim tác dụng với các hợp chất sinh ra khí hiđro. 3.3. Khi điều chế khí H2 người ta cho Zn tác dụng với dung dịch axit HCl. Trong khí H2 thu được bằng phương pháp đó có lẫn tạp chất là khí HCl và hơi nước. Trình bày cách loại bỏ tạp chất để thu được khí hiđro tinh khiết. Viết các PTHH (nếu có). 3.4. Hãy viết một số PTHH trong đó các loại hợp chất khác nhau hoặc đơn chất khác nhau tác dụng với nước sinh ra khí hiđro. Ghi rõ các điều kiện của phản ứng (nếu có). 3.5. Những chất nào thường được dùng để hút nước, chống ẩm, chất làm khô, giải thích bằng cách viết PTHH, nếu cần. 3.6. Viết các phương trình hóa học biểu diễn các phản ứng sau: a) Clo phản ứng với P tạo thành PCl3, PCl5. b) Clo phản ứng với H2 tạo thành hiđroclorua. c) Clo tác dụng với dung dịch NaOH (khi lạnh) tạo thành nước gia-ven d) Clo tác dụng với dung dịch canxi hiđroxit Ca(OH)2 tạo thành canxi clorua và Ca(OCl)2. 3.7. Cho sơ đồ chuyển hóa sau: Cl2 đ A đ B đ C đ A đ Cl2 Trong đó A, B, C là chất rắn và đều chứa nguyên tố Na. Xác định các chất A, B, C ? 3.8. Có những chất: Na2O, Na, NaOH, NaHCO3 , Na2SO4 , Na2CO3 , NaCl, NaClO. a) Dựa vào mối quan hệ giữa các chất, hãy sắp xếp các chất trên thành một sơ đồ chuyển hoá không nhánh. b) Viết các phương trình hoá học theo sơ đồ trên. 3.9. Có các chất : Cu, CuO, Mg, CaCO3, Fe(OH)3. Chất nào tác dụng với dung dịch HCl để tạo thành : a) Chất khí nhẹ hơn không khí, cháy được trong không khí. b) Chất khí nặng hơn không khí, không duy trì sự cháy. c) Dung dịch có màu xanh lam. d) Dung dịch có màu nâu nhạt. Hãy viết phương trình hoá học của phản ứng xảy ra. 3.10. a) Axit sunfuric đặc được dùng làm khô những khí ẩm, hãy lấy một thí dụ. Có một số khí ẩm không được làm khô bằng axit sunfuric đặc, hãy lấy một thí dụ. Vì sao? b) Axit sunfuric đặc có thể biến nhiều hợp chất hữu cơ thành than, được gọi là sự hoá than. Lấy thí dụ về sự hoá than của glucozơ, saccarozơ. Viết sơ đồ phản ứng. c) Sự làm khô và sự hoá than nói trên khác nhau như thế nào? 3.11. Trình bày nguyên tắc phương pháp điều chế Ca(OCl)2 đi từ đá vôi, muối ăn, nước và các dụng cụ cần thiết. Viết các PTHH minh hoạ. 3.12. Khí H2 thu được bằng phương pháp điện phân dung dịch NaCl, đôi khi bị lẫn tạp chất là khí Cl2. Để kiểm tra xem khí H2 có lẫn Cl2 hay không, người ta thổi khí đó qua một dung dịch có chứa kali iotua và tinh bột. Hãy giải thích vì sao phải làm như vậy? 3.13. Sau khi làm thí nghiệm có những khí thải độc hại sau: HCl, H2S, CO2, SO2, có thể dùng chất nào sau đây để loại bỏ chúng là tốt nhất ? a) Nước vôi trong ; b) dd HCl ; c) dd NaCl ; d) nước Giải thích và viết các phương trình hoá học (nếu có) 3.14. Hãy viết PTHH biểu diễn các quá trình hoá học sau : a) Dẫn khí SO2 đi từ từ qua nước brom làm nước brom nhạt màu và mất màu. Thêm BaCl2 vào dung dịch đó thấy kết tủa trắng được tạo thành. b) Cho khí SO2 đi từ từ qua dung dịch Ba(OH)2 để dư SO2. c) Cho 2 dung dịch cùng số mol của Ba(HSO3)2 và Ba(OH)2 tác dụng với nhau. 3.15. Cho lượng dư bột Fe tác dụng với một dung dịch axit sunfuric đặc, đun nóng và khuấy đều, lúc đầu thấy giải phóng ra khí SO2 sau đó giải phóng ra khí H2. Khi phản ứng kết thúc lọc bỏ Fe dư, lấy dung dịch màu xanh nhạt cho tác dụng với lượng dư dung dịch NH3, tạo thành kết tủa màu trắng hơi xanh, kết tủa này chuyển dần thành màu vàng và màu nâu đỏ khi tiếp xúc với không khí. Hãy viết các phương trình hóa học biểu diễn các phản ứng xảy ra 3.16. Viết các PTHH biểu diễn các quá trình hóa học sau : a) Nitơ tác dụng với hiđro ở nhiệt độ cao, áp suất cao, có chất xúc tác tạo thành khí amoniac (NH3). b) NH3 khử được oxi của CuO đun nóng tạo thành đồng kim loại, hơi nước và nitơ. c) Đốt cháy khí NH3 trong không khí tạo thành hơi nước và khí nitơ. d) Đốt cháy khí amoniac bằng oxi có chất xúc tác là Pt, thu được khí NO và hơi nước. 3.17. Điều chế axit nitric theo các giai đoạn sau : a) Đốt cháy amoniac có xúc tác Pt tạo thành NO. b) Cho NO tác dụng với oxi thành khí NO2 có màu nâu. c) Cho khí NO2 hợp nước thu được axit nitrit và khí NO 3.18. Cho hỗn hợp bột Cu và Fe tác dụng với dung dịch axit nitric đun nóng thu được dung dịch muối đồng (II) nitrat, muối Fe(NO3)3 , đầu tiên giải phóng ra khí NO2 sau đó giải phóng ra khí NO. Nung nóng hỗn hợp muối Cu(NO3)2 và Fe(NO3)3 thu được CuO, Fe2O3 và hỗn hợp 2 khí NO2 và O2. Viết các phương trình hóa học biểu diễn các phản ứng xảy ra 3.19. Viết các PTHH biểu diễn các quá trình hoá học sau : a) Điều chế axit photphoric trong phòng thí nghiệm đi từ nguyên liệu đầu là photpho đỏ. b) Từ các nguyên liệu ban đầu là quặng apatit (thành phần chính là Ca3(PO4)2), axit photphoric và các hoá chất phụ khác điều chế : - Supe photphat đơn ; - Supe photphat kép. c) Hoà tan oxit P2O5 vào lượng dư nước, được dung dịch A. Thêm từ từ dung dịch NaOH vào A đồng thời khuấy đều hỗn hợp cho đến khi dư NaOH. 3.20. Viết các PTHH biểu diễn các quá trình hoá học sau : a) Đốt cacbon trong lò dư cacbon. b) ở nhiệt độ cao cacbon khử sắt (III) oxit thành sắt và tạo thành khí CO. c) Cho hơi nước đi qua cacbon nung đỏ, thu được khí than và hỗn hợp của H2 và CO. Đốt hỗn hợp khí than đó có phản ứng toả ra lượng lớn nhiệt. d) Cho khí CO đi từ từ qua ống sứ nung nóng chứa Fe2O3 dạng bột, để khí đó lần lượt khử Fe3O4, FeO và cuối cùng thành Fe. 3.21. Hãy viết 5 đến 6 PTHH trong mỗi phản ứng đều có các chất khác nhau tác dụng với nhau tạo thành khí CO2. 3.22. Hãy viết các PTHH biểu diễn dãy biến hoá sau : a) SO2 đ Na2SO3 đ NaHSO3 đ Na2SO3 đ Na2SO4 b) CO2 đ Na2CO3 đ NaHCO3 đ Na2CO3 đ NaOH 3.23. Trong phòng thí nghiệm, người ta làm khô các khí ẩm bằng cách dẫn khí này đi qua các bình có đựng các chất háo nước nhưng không phản ứng với khí cần làm khô. Có các chất làm khô sau: H2SO4 đặc, CaO. Dùng hoá chất nào nói trên để làm khô mỗi khí ẩm sau đây: khí SO2, O2, CO2. Hãy giải thích sự lựa chọn đó. 3.24. Có các bình khí riêng biệt là: CO2 , Cl2 , CO, H2 . Hãy nhận biết các khí trên bằng phương pháp hoá học. Viết các phương trình hoá học. 3.25. Trong phòng thí nghiệm, người ta có thể điều chế khí clo bằng những phản ứng sau: Cho MnO2 tác dụng với dung dịch HCl đặc. Cho KMnO4 tác dụng với dung dịch HCl đặc. Dùng H2SO4 đặc tác dụng với hỗn hợp NaCl và MnO2. Hãy viết các phương trình phản ứng hoá học xảy ra. 3.26. Cho các hoá chất NaCl(r), NaOH(dd), KOH(dd), H2SO4(đặc), Ca(OH)2(r). Từ các hoá chất đó, có thể điều chế được các chất sau đây hay không? Nước Gia-ven Kali clorat Clorua vôi Oxi Lưu huỳnh đioxit Viết phương trình phản ứng xảy ra. 3.27. Có 3 chất khí đựng trong 3 lọ riêng biệt : CO, CO2, Cl2. Hãy chứng minh sự có mặt của mỗi chất khí. Nêu cách làm và viết các phương trình hóa học đã dùng. 3.28. Có 3 lọ đựng 3 chất rắn : NaNO3 , Na2CO3 ; CaCO3 bị mất nhãn. Bằng phương pháp hoá học, hãy nhận ra từng lọ và viết các phương trình hoá học để minh hoạ. 3.29. Sau khi làm thí nghiệm, có những khí thải độc hại sau : H2S, CO2, SO2. Có thể dùng nước vôi trong dư để khử khí thải trên được không ? Hãy giải thích và viết các phương trình hoá học. 3.30. Viết các phương trình hoá học của phản ứng xảy ra trong quá trình luyện gang - Tạo chất khử CO. - CO khử oxit sắt từ trong quặng manhetit Fe3O4. - Đá vôi bị nhiệt phân huỷ thành CaO và phản ứng với SiO2 tạo xỉ. 3.31. Có các chất sau : C, CO2, Na2CO3, NaHCO3, CaCO3. Hãy lập sơ đồ chuyển hoá thể hiện mối quan hệ các chất trên và viết các phương trình hoá học xảy ra. 3.32. Tính khối lượng gang chứa 3%C thu được, nếu có 2,8 tấn khí CO đã tham gia phản ứng hết với quặng hematit. Hiệu suất của quá trình là 80%. 3.33. Đốt cháy 6 g cacbon trong bình kín dư oxi. Sau phản ứng cho 750 ml dung dịch NaOH 1M vào bình. a) Hãy viết phương trình hoá học. b) Tính nồng độ mol của dung dịch thu được sau phản ứng. Coi thể tích dung dịch thay đổi không đáng kể. 3.34. Cho 1,12 g vôi sống (CaO) tác dụng hết với lượng dư nước, thu được dung dịch A. Cho 1 dòng khí CO2 đi chậm qua A, phản ứng xảy ra hoàn toàn, thu được 1 g kết tủa trắng CaCO3. Viết các PTHH của các phản ứng xảy ra và tính thể tích khí CO2 ( ĐKTC) đã phản ứng với dung dịch A đó. 3.35. Hỗn hợp A gồm NaCl và KCl. Lấy 12,34 g A hoà tan vào nước được dung dịch. Thêm vào dung dịch đó lượng dư dung dịch AgNO3. Lọc, rửa kết tủa mới được tạo thành, sấy khô, cân được 28,7 g. Viết các PTHH xảy ra và tính % theo khối lượng của mỗi muối trong hỗn hợp A đó. 3.36. Cho hỗn hợp X gồm NaCl và muối clorua của kim loại kiềm M. Cho 4,73 g hỗn hợp X đó tác dụng với lượng dư dung dịch AgNO3 thì thu được 14,35 g kết tủa. Hỏi trong hỗn hợp X chứa muối clorua của kim loại kiềm nào cùng với NaCl. 3.37. Cho hỗn hợp M gồm NaCl và NaBr. Lấy 12,59 g hỗn hợp đó hoà tan hết vào nước, thu được dung dịch A. Cho lượng dư khí clo đi chậm qua A. Sau khi cô cạn cẩn thận dung dịch thì thu được 11,7 g muối khan. Tính hàm lượng % theo khối lượng của mỗi muối trong hỗn hợp M. 3.38. Khi đun nóng muối kali clorat (KClO3) mà không có chất xúc tác thì nó đồng thời bị phân huỷ theo 2 hướng : a) Tạo thành khí oxi và kali clorua. b) Tạo thành kali peclorat (KClO4) và kali clorua. Khi đun nóng 73,5 g KClO3 không có chất xúc tác thì đã thu được 33,5 gam muối KCl. Hãy viết các PTHH và tính bao nhiêu % lượng muối kali clorat phân huỷ theo các hướng a, b. 3.39. Cho 2 bình có thể tích bằng nhau A và B. Bình A chứa 1 mol khí clo, bình B chứa 1 mol khí oxi. Thêm vào mỗi bình 2,4 g bột cùng một kim loại M có hoá trị không đổi là n. Đun nóng 2 bình để các phản ứng trong chúng xảy ra hoàn toàn rồi làm nguội cả 2 bình về nhiệt độ ban đầu. Nhận thấy, khi đó tỉ số áp suất của khí trong hai bình là PA / PB = 1,8/1,9. Biết rằng trong điều kiện nhiệt độ và thể tích không thay đổi thì áp suất của các khí tỉ lệ thuận với số mol khí trong bình. Hãy xác định kim loại M đem làm thí nghiệm là kim loại nào ? 3.40. Cho hỗn hợp A gồm FeS2 và FeCO3 với số mol bằng nhau trong hỗn hợp vào một bình kính chịu nhiệt chứa lượng dư oxi. Nung bình đến nhiệt độ đủ cao để xảy ra hoàn toàn các phản ứng oxi hoá hai muối đã cho rồi làm nguội về nhiệt độ ban đầu. Hỏi áp suất trong bình trước và sau phản ứng thay đổi thế nào ? 3.41. Đốt cháy hoàn toàn 2,709 g một đơn chất phi kim R trong oxi rồi cho toàn bộ sản phẩm tạo thành hấp thụ hết vào bình đựng 100 ml dung dịch NaOH 25% (có d=1,28 g/ml), được dung dịch A trong đó nồng độ NaOH giảm đi 4% và có khả năng hấp thụ tối đa 17,92 lit khí CO2 (ĐKTC). Hãy xác định đơn chất R đã được đốt cháy. 3.42. Cho hỗn hợp A khối lượng m g ở dạng bột gồm Mg và Al. Đốt nóng A trong không khí để oxi hoá hết các kim loại bởi oxi, thu được chất rắn B khối lượng 18,5 g. Để hoà tan hết B cần dùng ít nhất 265 ml dung dịch HCl 4M, thu được dung dịch C thể tích 270 ml. Tính m và nồng độ mol của các chất tan trong C. 3.43. Để đốt cháy hoàn toàn 1 g đơn chất X (phân tử gồm 1 nguyên tử) cần dùng vừa đủ 0,7 lit oxi (ĐKTC). a) Hãy xác định đơn chất X. b) Đốt cháy hoàn toàn 17,92 lit khí Y (ĐKTC) là hợp chất tạo bởi X và H2 trong điều kiện dư oxi rồi cho toàn bộ các sản phẩm cháy (gồm hơi nước và một oxit axit) hấp thụ hết vào 300 ml dung dịch NaOH 25% (d=1,28 g/ml). Hãy tính nồng độ % của các chất tan trong dung dịch thu được. 3.44. Thêm 300 ml dung dịch NaOH 25% (d = 1,28 g/ml) vào 100 ml dung dịch H3PO4 66,2% (d = 1,482 g/ml) thu được dung dịch A. Hãy viết PTHH xảy ra và tính nồng độ phần trăm của các chất tan trong A. 3.45. Thêm 280 ml dung dịch NaOH 20% d = 1,2 g/ml vào 100 ml dung dịch H3PO4 45,3% có d = 1,3 g/ml rồi pha loãng dung dịch thu được bằng nước cất, được dung dịch A thể tích = 500 ml. Tính nồng độ mol của các chất tan trong A. 3.46. Cho một lượng sắt oxit vào ống sứ, nung nóng ống ở nhiệt độ cao rồi cho luồng khí dư CO đi chậm qua ống để khử hoàn toàn sắt oxit thành sắt kim loại. Khí CO2 đi ra khỏi ống sứ được hấp thụ hết vào bình đựng lượng dư nuớc vôi trong, thu được 13,5 g kết tủa trắng. Viết các PTHH xảy ra và xác định công thức của sắt oxit, biết rằng sau phản ứng cho lượng sắt trong ống sứ tác dụng hết với HCl thì thu được 2,268 lit khí hiđro (ĐKTC). 3.47. X và Y là 2 nguyên tố đứng kế tiếp nhau thuộc một nhóm A của bảng tuần hoàn dạng dài. Biết rằng tổng số các hạt proton trong hạt nhân X và Y là 24. Hãy cho biết vị trí của X và Y trong bảng và nêu các tính chất hóa học điển hình của các đơn chất X và Y. Viết các PTHH của các phản ứng để minh họa. 3.48. Hai nguyên tố A và B ở 2 nhóm A liên tiếp nhau trong bảng tuần hoàn dạng dài, B thuộc nhóm 5A, các đơn chất của A và B không phản ứng với nhau. Tổng số proton trong 2 hạt nhân nguyên tử A và B là 23. Hãy cho biết vị trí của A và B trong bảng tuàn hoàn. Câu hỏi trắc nghiệm khách quan nhiều lựa chọn 3.49. Dãy gồm các chất đều là muối axit : A. NaHCO3, CaCO3, Na2CO3. B. Mg(HCO3)2, NaHCO3, Ca(HCO3)2, Ba(HCO3)2. C. Ca(HCO3)2, Ba(HCO3)2, BaCO3. D. Mg(HCO3)2, Ba(HCO3)2, CaCO3. 3.50. Dãy gồm các muối đều tan trong nước là : A. CaCO3, BaCO3, Na2CO3, Mg(HCO3)2. B. BaCO3, NaHCO3, Mg(HCO3)2, Mg(HCO3)2. C. CaCO3, BaCO3, NaHCO3, MgCO3. D. Na2CO3, Ca(HCO3)2, Mg(HCO3)2, Ba(HCO3)2. 3.51. Dãy gồm các chất đều bị nhiệt phân hủy giải phóng khí cacbonic và oxit bazơ : A. Na2CO3, MgCO3, Ca(HCO3)2, BaCO3. B. NaHCO3, Ca(HCO3)2, Mg(HCO3)2. C. CaCO3, MgCO3, BaCO3, Ca(HCO3)2, Mg(HCO3)2. D. NaHCO3, CaCO3, MgCO3, BaCO3. 3.52. Dãy các muối đều phản ứng với dung dịch NaOH : A. Na2CO3, NaHCO3, MgCO3. B. NaHCO3, Ca(HCO3)2, Mg(HCO3)2, Ba(HCO3)2. C. Ca(HCO3)2, Mg(HCO3)2, BaCO3. D. CaCO3, BaCO3, Na2CO3, MgCO3. 3.53. Dãy các muối đều phản ứng với dung dịch Ba(HCO3)2 : A. Na2CO3, CaCO3 B. NaHCO3, MgCO3 C. K2SO4, Na2CO3 D. NaNO3, KNO3 3.54. Dãy các nguyên tố đều ở nhóm VII là : A. F, Cl, O, N B. F, Cl, Br, I C. O, I, S, F D. F, I, N, Br 3.55. Dãy các nguyên tố thuộc chu kỳ II là : A. F, Cl, Br, I B. F, N, I, O C. N, Cl, Br, O D. N, O, F 3.56. Dãy các đơn chất được sắp xếp theo chiều hoạt động hóa học tăng dần là A. F2, Cl2, Br2, I2 B. S, Cl2, F2, O2 C. I2, Br2, Cl2, F2 D. F2, Cl2, S, N2 3.57. Dãy các đơn chất có tính chất hóa học tương tự clo là : A. N2, O2, F2 B. F2, Br2, I2 C. S, O2, F2 D. Br2, O2, S 3.58. Dãy các đơn chất được tạo nên từ các nguyên tố mà nguyên tử của chúng đều có 7 electron ở lớp ngoài cùng. A. N2, O2, F2 B. F2, Cl2, Br2, I2 C. S, O2, Br2 D. O2, Cl2, F2 3.59. Dãy các nguyên tố mà nguyên tử đều có 2 lớp electron là : A. F, Cl, O B. F, Br, I C. O, S, Cl D. N, O, F 3.60. Lưu huỳnh đioxit được tạo thành từ cặp chất nào sau đây : A. Na2SO4 + CuCl2 B. Na2SO4 + NaCl C. K2SO3 + HCl D. K2SO4 + HCl 3.61. Nhóm gồm các khí đều phản ứng với oxi : A. CO, CO 2 B. CO, H 2 C. O2, CO2 D. H2, CO2 3.62. Nhóm gồm các khí đều phản ứng với dung dịch NaOH ở điều kiện thường : A. H2, Cl2 B. CO, CO2 C. Cl2, CO2 D. H2, CO 3.63. Nhóm gồm các khí đều khử được oxit CuO ở nhiệt độ cao : A. CO, H2 B. Cl2, CO2 C. CO, CO2 D. Cl2, CO 3.64. Nhóm gồm các nguyên tố phi kim được sắp xếp đúng theo chiều tính phi kim tăng dần : A. F, N, P, As B. F, O, N, P, As C. O, N, P, As D. As, P, N, O, F 3.65. Nhóm gồm các nguyên tố phi kim được sắp xếp theo chiều tính phi kim giảm dần : A. Si, Cl, S, P B. Cl, S, P, Si C. Si, S, P, Cl D. Si, Cl, P, S. 3.66. Các cặp chất sau dùng điều chế Cl2 trong phòng thí nghiệm: A. MnO2 và HCl B. MnCl2 và H2SO4 C. MnO2 và NaCl D. H2SO4 và NaCl 3.67. Oxit chứa 50% oxi về khối lượng là : A. CO2 B. CO C. SO2 D. SO3 3.68. Hỗn hợp khí được làm khô bằng cách dẫn qua bình chứa CaO là : A. SO2 và CO2 B. CO2 và H2 C. CO và H2 D. CO2 và CO 3.69. Đốt cháy đơn chất phi kim R trong không khí, thu được oxit của nó, trong đó R chiếm 50% khối lượng. R là A. cacbon B. photpho C. silic D. lưu huỳnh 3.70. Cần phải cho ít nhất bao nhiêu gam MnO2 tác dụng hết với lượng dư dung dịch HCl để thu được 11,2 lit khí clo (đktc) ? A. 87,0 (g) B. 43,5 (g) C. 130,5 (g) D. 45,3 (g) 3.71. Trộn 100 g dung dịch chứa 5,85 g NaCl với 170 g dung dịch AgNO3 10%. Khối lượng kết tủa tạo thành bằng A. 28,7 (g) B. 13,45 (g) C. 14,35 (g) D. 27,8 (g) 3.72. Đốt cháy 7,2 g một loại than chứa tạp chất trơ trong khí oxi dư. Cho toàn bộ sản phẩm cháy vào bình đựng lượng dư dung dịch NaOH. Sau đó thêm vào bình lượng dư dung dịch BaCl2, thấy tạo thành 114,26 g kết tủa trắng. Hàm lượng cacbon trong loại than đã đem đốt là A. 97,67% B. 96,67% C. 80,00% D. 75,00%
Tài liệu đính kèm:
 Tu hoc 9-3.doc
Tu hoc 9-3.doc HDG Tu hoc 9-3.doc
HDG Tu hoc 9-3.doc





