Kiểm tra học kì I – NH: 2012 - 2013 môn: Hóa học 9 Trường THCS Vĩnh Khánh
Bạn đang xem tài liệu "Kiểm tra học kì I – NH: 2012 - 2013 môn: Hóa học 9 Trường THCS Vĩnh Khánh", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
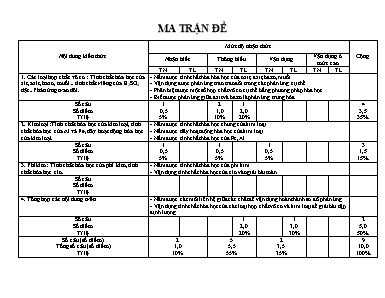
MA TRẬN ĐỀ Nội dung kiến thức Mức độ nhận thức Cộng Nhận biết Thông hiểu Vận dụng Vận dụng ở mức cao TN TL TN TL TN TL TN TL 1. Các loại hợp chất vô cơ : Tính chất hóa học của xit, axit, bazơ, muối ; tính chất riêng của H2SO4 đặc; Phản ứng trao đôi. - Nắm được tính chất hóa hóa học của oxit, axit, bazơ, muối. - Vận dụng được phản ứng trao trao đổi trong các phản ứng cụ thể. - Phân biệt được một số hợp chất vô cơ cụ thể bằng phương pháp hóa học. - Biết được phản ứng giữa axit và bazơ là phản ứng trung hòa. Số câu Số điểm Tỉ lệ 1 0,5 5% 2 1,0 10% 1 2,0 20% 4 3,5 35% 2. Kim loại: Tính chất hóa học của kim loại, tính chất hóa học của Al và Fe, dãy hoạt động hóa học của kim loại. - Nắm được tính chất hóa học chung của kim loại. - Nắm được dãy hoạt động hóa học của kim loại. - Nắm được tính chất hóa học của Fe, Al. Số câu Số điểm Tỉ lệ 1 0,5 5% 1 0,5 5% 1 0,5 5% 3 1,5 15% 3. Phi kim: Tính chất hóa học của phi kim, tính chất hóa học clo. - Nắm được tính chất hóa học của phi kim. - Vận dụng tính chất hóa học của clo vào giải bài toán. Số câu Số điểm Tỉ lệ 4. Tổng hợp các nội dung trên - Nắm được các mối liên hệ giữa các chất để vận dụng hoàn thành sơ đồ phản ứng. - Vận dụng tính chất hóa học của các loại hợp chất vô cơ và kim loại để giải bài tập định lượng. Số câu Số điểm Tỉ lệ 1 2,0 20% 1 3,0 30% 2 5,0 50% Số câu (số điểm) Tổng số câu (số điểm) Tỉ lệ 2 1,0 10% 5 5,5 55% 2 3,5 35% 9 10,0 100% Phòng GD huyện Thoại Sơn Trường THCS Vĩnh Khánh KIỂM TRA HỌC KÌ I – NH: 2012 - 2013 MÔN: HÓA HỌC 9 Thời gian làm bài: 45 phút (không kể thời gian phát đề) Mã đề thi 102 Họ, tên thí sinh:.......................................................................... Số báo danh:............................................................................... I. Phần A: Trắc nghiệm (4 điểm). Khoanh tròn chữ cái A, B, C hoặc D trước câu trả lời đúng. Cặp kim loại nào sau đây đều phản ứng với nước ở điều kiện thường ? A. Na, Fe. B. K, Na. C. Mg, K. D. Al, Fe. Phản ứng giữa axit và bazơ thuộc loại phản ứng nào sau đây ? A. Phản ứng trung hòa. B. Phản ứng thế. C. Phản ứng hóa hợp. D. Phản ứng phân hủy. Cặp dung dịch nào sau đây có thể tác dụng tác dụng được với nhau ? A. CuCl2 và NaCl. B. NaOH và NaCl. C. BaCl2 và dd HCl. D. CuCl2 và NaOH. Khí nào sinh ra khi cho kim loại Cu tác dụng với H2SO4 đặc, nóng ? A. Khí H2. B. Khí H2S. C. Khí SO2. D. Khí SO3. Dãy kim loại nào sau đây được sắp xếp đúng theo chiều hoạt động hóa học tăng dần ? A. K, Mg, Cu, Al, Zn, Fe. B. Zn, K, Mg, Cu, Al, Fe. C. Fe, Cu, K, Mg, Al, Zn. D. Cu, Fe, Zn, Al, Mg, K. Đốt cháy hoàn toàn 5,6 gam Fe trong bình đựng khí Cl2 (lấy dư). Thể tích khí Cl2 (đktc) phản ứng là: (cho biết: Fe = 5,6) A. 2,24 lít. B. 22,4 lít. C. 3,36 lít. D. 33,6 lít. II. Phần B: Tự luận(6 điểm). (2 điểm) Viết phương trình hóa học cho những chuyển đổi sau: Cu CuO CuSO4 Cu(OH)2 CuO (2,0 điểm) Bằng phương pháp hóa học hãy phân biệt 4 dung dịch đựng riêng biệt trong 4 lọ mất nhãn sau, viết phương trình phản ứng (nếu có). Na2SO4, H2SO4, HCl, NaOH (3,0 điểm) Cho 4,8 gam Mg tác dụng vừa đủ với 200 ml dung dịch HCl thu được dung dịch (A) và khí hiđro. a) Viết phương trình hóa học. b) Tính nồng độ mol dung dịch HCl phản ứng và thể tích khí hiđro sinh ra (đktc). c) Nếu cho 300ml dung dịch NaOH 1M vào dung dịch (A). Tính khối lượng kết tủa thu được sau phản ứng. (Cho biết: Mg = 24, O = 16, H = 1) ----------Hết-------- HƯỚNG DẪN CHẤM I. Phần A: Trắc nghiệm (3,0 điểm). Mỗi câu trắc nghiệm chọn đúng đạt 0,5 điểm x 8 = 4,0 điểm Câu 1 2 3 4 5 6 Đáp án B A D C D A II. Phần B: Tự luận (7,0 điểm). Câu Nội dung Điểm 1. (1) 2Cu + O2 2CuO 0,5 (2) CuO + H2SO4 CuSO4 + H2O 0,5 (3) CuSO4 + 2NaOH Cu(OH)2 + Na2SO4 0,5 (4) Cu(OH)2 CuO + H2O 0,5 2. Lấy mỗi chất một ít làm mẫu thử. Ta có bảng nhận biết sau Chất T.Thử Na2SO4 H2SO4 HCl NaOH Quỳ tím Không đổi màu Đỏ Đỏ xanh BaCl2 ¯ tráng Không PTHH: H2SO4 + BaCl2 ® BaSO4¯ + 2HCl 0,25 1,0 0,5 0,25 3. nMg = = 0,2 (mol) PTHH: Mg + 2HCl ® MgCl2 + H2 mol: 0,2 ® 0,4 ® 0,2 ® 0,2 0,5 0,5 CM(HCl) = = 2 M 0,5 VH2 = 0,2 . 22,4 = 4,48 (lít) 0,5 c) nNaOH = 0,3 . 1 = 0,3 (mol) PTHH: 2NaOH + MgCl2 ® Mg(OH)2¯ + 2NaCl bđ : 0,3 0,2 pư: 0,3 ® 0,15 ® 0,15 mMg(OH)2 = 0,15 . 58 = 8,7 g 0,25 0,25 0,5 *Chú ý: Học sinh làm cách khác đúng, đảm bảo tính khoa học vẫn được hưởng trọn số điểm.
Tài liệu đính kèm:
 de_thi_HKI.doc
de_thi_HKI.doc





