Các Chuyên đề Hóa học THCS
Bạn đang xem 20 trang mẫu của tài liệu "Các Chuyên đề Hóa học THCS", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
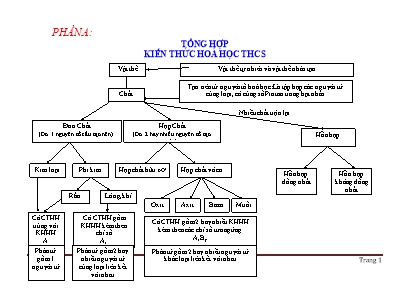
PHẦN A: TỔNG HỢP KIẾN THỨC HOÁ HỌC THCS Chất Phân tử gồm 1 nguyên tử Phân tử gồm 2 hay nhiều nguyên tử cùng loại liên kết với nhau Phân tử gồm 2 hay nhiều nguyên tử khác loại liên kết với nhau Nhiều chất trộn lại Vật thể Vật thể tự nhiên và vật thể nhân tạo Đơn Chất (Do 1 nguyên tố cấu tạo nên) Hợp Chất (Do 2 hay nhiều nguyên tố tạo nên) Kim loại Phi kim Oxit Axit Bazơ Muối Tạo nên từ nguyên tố hoá học: Là tập hợp các nguyên tử cùng loại, có cùng số Proton trong hạt nhân Hợp chất hữu cơ Hợp chất vô cơ Có CTHH trùng với KHHH A Rắn Lỏng, khí Có CTHH gồm KHHH kèm theo chỉ số Ax Có CTHH gồm 2 hay nhiều KHHH kèm theo các chỉ số tương ứng AxBy Hỗn hợp Hỗn hợp đồng nhất Hỗn hợp không đồng nhất TỔNG HỢP KIẾN THỨC CƠ BẢN HOÁ HỌC 8 Các khái niệm: Vật thể, chất. Vật thể: Là toàn bộ những gì xung quanh chúng ta và trong không gian. Vật thể gồm 2 loại: Vật thể tự nhiên và vật thể nhân tạo Chất: là nguyên liệu cấu tạo nên vật thể. Chất có ở khắp mọi nơi, ở đâu có vật thể là ở đó có chất. Mỗi chất có những tính chất nhất định. Bao gồm tính chất vật lý và tính chất hoá học. Tính chất vật lý: Trạng thái (R,L,K), màu sắc, mùi vị, tính tan, tính dẫn điện, dẫn nhiệt, nhiệt độ sôi (t0s), nhiệt độ nóng chảy (t0nc), khối l ợng riêng (d) Tính chất hoá học: Là khả năng bị biến đổi thành chất khác: Khả năng cháy, nổ, tác dụng với chất khác Hỗn hợp và chất tinh khiết. Hỗn hợp là 2 hay nhiều chất trộn lại với nhau. Mỗi chất trong hỗn hợp đ ợc gọi là 1 chất thành phần. Hỗn hợp gồm có 2 loại: hỗn hợp đồng nhất và hỗn hợp không đồng nhất Tính chất của hỗn hợp: Hỗn hợp có tính chất không ổn định, thay đổi phụ thuộc vào khối l ợng và số l ợng chất thành phần. Chất tinh khiết là chất không có lẫn chất nào khác. Chất tinh khiết có tính chất nhất định, không thay đổi. Khi tách riêng các chất ra khỏi hỗn hợp ta thu đ ợc các chất tinh khiết. Để tách riêng các chất ra khỏi hỗn hợp ng ời ta có thể sử dụng các ph ơng pháp vật lý và hoá học: tách, chiết, gạn, lọc, cho bay hơi, ch ng cất, dùng các phản ứng hoá học Nguyên tử. Định nghĩa: Là hạt vô cùng nhỏ, trung hoà về điện, cấu tạo nên các chất Cấu tạo: gồm 2 phần Hạt nhân: tạo bởi 2 loại hạt: Proton và Nơtron Proton: Mang điện tích +1, có khối l ợng 1 đvC, ký hiệu: P Nơtron: Không mang điện, có khối l ợng 1 đvC, ký hiệu: N Vỏ: cấu tạo từ các lớp Electron Electron: Mang điện tích -1, có khối l ợng không đáng kể, ký hiệu: e Trong nguyên tử, các e chuyển động rất nhanh và sắp xếp thành từng lớp từ trong ra. + Lớp 1: có tối đa 2e + Lớp 2,3,4 tạm thời có tối đa 8e Khối l ợng nguyên tử = số P + số N + số e = số P + số N (vì e có khối l ợng rất nhỏ) Nguyên tố hoá học. Là tập hợp những nguyên tử cùng loại, có cùng số P trong hạt nhân Những nguyên tử có cùng số P nh ng số N khác nhau gọi là đồng vị của nhau Hoá trị. Là con số biểu thị khả năng liên kết của nguyên tử hay nhóm nguyên tử Quy tắc hoá trị: ta có: a.x = b.y (với a, b lần l ợt là hoá trị của nguyên tố A và B) So sánh đơn chất và hợp chất ĐƠN CHẤT HỢP CHẤT VD Sắt, đồng, oxi, nitơ, than chì N ớc, muối ăn, đ ờng K/N Là những chất do 1 nguyên tố hoá học cấu tạo nên Là những chất do 2 hay nhiều nguyên tố hoá học cấu tạo nên Phân loại Gồm 2 loại: Kim loại và phi kim. Gồm 2 loại: hợp chất vô cơ và hợp chất hữu cơ Phân tử (hạt đại diện) - Gồm 1 nguyên tử: kim loại và phi kim rắn - Gồm các nguyên tử cùng loại: Phi kim lỏng và khí - Gồm các nguyên tử khác loại thuộc các nguyên tố hoá học khác nhau CTHH - Kim loại và phi kim rắn: CTHH º KHHH (A) - Phi kim lỏng và khí: CTHH = KHHH + chỉ số (Ax) CTHH = KHHH của các nguyên tố + các chỉ số t ơng ứng AxBy So sánh nguyên tử và phân tử NGUYÊN TỬ PHÂN TỬ Định nghĩa Là hạt vô cùng nhỏ, trung hoà về điện, cấu tạo nên các chất Là hạt vô cùng nhỏ, đại diện cho chất và mang đầy đủ tính chất của chất Sự biến đổi trong phản ứng hoá học. Nguyên tử đ ợc bảo toàn trong các phản ứng hoá học. Liên kết giữa các nguyên tử trong phân tử thay đổi làm cho phân tử này biến đổi thành phân tử khác Khối l ợng Nguyên tử khối (NTK) cho biết độ nặng nhẹ khác nhau giữa các nguyên tử và là đại l ợng đặc tr ng cho mỗi nguyên tố NTK là khối l ợng của nguyên tử tính bằng đơn vị Cacbon Phân tử khối (PTK) là khối l ợng của 1 phân tử tính bằng đơn vị Cacbon PTK = tổng khối l ợng các nguyên tử có trong phân tử. ÁP DỤNG QUY TẮC HOÁ TRỊ Tính hoá trị của 1 nguyên tố Gọi hoá trị của nguyên tố cần tìm (là a) Áp dụng QTHT: a.x = b.y đ a = b.y/x Trả lời Lập CTHH của hợp chất. Gọi công thức chung cần lập Áp dụng QTHT: a.x = b.y đ Trả lời. *** Có thể dùng quy tắc chéo để lập nhanh 1 CTHH: Trong CTHH, hoá trị của nguyên tố này là chỉ số của nguyên tố kia. L u ý: Khi các hoá trị ch a tối giản thì cần tối giản tr ớc Phản ứng hoá học. Là quá trình biến đổi chất này thành chất khác. Chất bị biến đổi gọi là chất tham gia, chất đ ợc tạo thành gọi là sản phẩm Đ ợc biểu diễn bằng sơ đồ: A + B đ C + D đọc là: A tác dụng với B tạo thành C và D A + B đ C đọc là A kết hợp với B tạo thành C A đ C + D đọc là A bị phân huỷ thành C và D OXIT (AxOy) Oxit axit: CO2, SO2, SO3, NO2, N2O5, SiO2, P2O5 PHÂN LOẠI HCVC Oxit bazơ: Li2O, Na2O, K2O, CaO, BaO, CuO,Fe2O3 Oxit trung tính: CO, NO HỢP CHẤT VÔ CƠ Oxit l ỡng tính: ZnO, Al2O3, Cr2O3 Axit không có oxi (Hidraxit): HCl, HBr, H2S, HF Axit có oxi (Oxaxit): HNO3, H2SO4, H3PO4 . AXIT (HnB) Bazơ tan (Kiềm): NaOH, KOH, Ca(OH)2, Ba(OH)2 Bazơ không tan: Mg(OH)2, Cu(OH)2, Fe(OH)3 BAZƠ- M(OH)n Muối axit: NaHSO4, NaHCO3, Ca(HCO3)2 Muối trung hoà: NaCl, KNO3, CaCO3 MUỐI (MxBy) Ngoài ra có thể chia axit thành axit mạnh và axit yếu HNO3 H2SO4 HCl H3PO4 H2SO3 H2CO3 H2S CH3COOH Axit mạnh Axit trung bình Axit yếu Axit rất yếu OXIT AXIT BAZƠ MUỐI ĐỊNH NGHĨA Là hợp chất của oxi với 1 nguyên tố khác Là hợp chất mà phân tử gồm 1 hay nhiều nguyên tử H liên kết với gốc axit Là hợp chất mà phân tử gồm 1 nguyên tử kim loại liên kết với 1 hay nhiều nhóm OH Là hợp chất mà phân tử gồm kim loại liên kết với gốc axit. CTHH Gọi nguyên tố trong oxit là A hoá trị n. CTHH là: - A2On nếu n lẻ - AOn/2 nếu n chẵn Gọi gốc axit là B có hoá trị n. CTHH là: HnB Gọi kim loại là M có hoá trị n CTHH là: M(OH)n Gọi kim loại là M, gốc axit là B CTHH là: MxBy TÊN GỌI Tên oxit = Tên nguyên tố + oxit L u ý: Kèm theo hoá trị của kim loại khi kim loại có nhiều hoá trị. Khi phi kim có nhiều hoá trị thì kèm tiếp đầu ngữ. - Axit không có oxi: Axit + tên phi kim + hidric - Axit có ít oxi: Axit + tên phi kim + ơ (rơ) - Axit có nhiều oxi: Axit + tên phi kim + ic (ric) Tên bazơ = Tên kim loại + hidroxit L u ý: Kèm theo hoá trị của kim loại khi kim loại có nhiều hoá trị. Tên muối = tên kim loại + tên gốc axit L u ý: Kèm theo hoá trị của kim loại khi kim loại có nhiều hoá trị. TCHH 1. Tác dụng với n ớc - Oxit axit tác dụng với n ớc tạo thành dd Axit - Oxit bazơ tác dụng với n ớc tạo thành dd Bazơ 2. Oxax + dd Bazơ tạo thành muối và n ớc 3. Oxbz + dd Axit tạo thành muối và n ớc 4. Oxax + Oxbz tạo thành muối 1. Làm quỳ tím đ đỏ hồng 2. Tác dụng với Bazơ đ Muối và n ớc 3. Tác dụng với oxit bazơ đ muối và n ớc 4. Tác dụng với kim loại đ muối và Hidro 5. Tác dụng với muối đ muối mới và axit mới 1. Tác dụng với axit đ muối và n ớc 2. dd Kiềm làm đổi màu chất chỉ thị - Làm quỳ tím đ xanh - Làm dd phenolphtalein không màu đ hồng 3. dd Kiềm tác dụng với oxax đ muối và n ớc 4. dd Kiềm + dd muối đ Muối + Bazơ 5. Bazơ không tan bị nhiệt phân đ oxit + n ớc 1. Tác dụng với axit đ muối mới + axit mới 2. dd muối + dd Kiềm đ muối mới + bazơ mới 3. dd muối + Kim loại đ Muối mới + kim loại mới 4. dd muối + dd muối đ 2 muối mới 5. Một số muối bị nhiệt phân L u ý - Oxit l ỡng tính có thể tác dụng với cả dd axit và dd - HNO3, H2SO4 đặc có các tính chất riêng - Bazơ l ỡng tính có thể tác dụng với cả dd axit và - Muối axit có thể phản ứng nh 1 axit TÍNH CHẤT HOÁ HỌC CỦA CÁC HỢP CHẤT VÔ CƠ MUỐI + H2O QUỲ TÍM đ XANH PHENOLPHALEIN K.MÀU đ HỒNG BAZƠ KIỀM K.TAN MUỐI MUỐI + AXIT MUỐI + H2 QUỲ TÍM đ ĐỎ MUỐI + H2O MUỐI + AXIT MUỐI + BAZƠ MUỐI + MUỐI MUỐI + KIM LOẠI CÁC SẢN PHẨM KHÁC NHAU TCHH CỦA OXIT TCHH CỦA AXIT TCHH CỦA MUỐI TCHH CỦA BAZƠ AXIT + dd bazơ + kim loại t0 + dd muối + axit + Oxax + Oxit Bazơ + Bazơ + dd Muối + KL + N ớc + N ớc OXIT AXIT OXIT BAZƠ MUỐI + N ỚC + axit KIỀM MUỐI + dd Axit + dd Bazơ AXIT OXIT + H2O MUỐI + BAZƠ + dd Muối t0 L ưu ý: Th ờng chỉ gặp 5 oxit bazơ tan đ ợc trong n ớc là Li2O, Na2O, K2O, CaO, BaO. Đây cũng là các oxit bazơ có thể tác dụng với oxit axit. Đối với bazơ, có các tính chất chung cho cả 2 loại nh ng có những tính chất chỉ của Kiềm hoặc bazơ không tan Một số loại hợp chất có các tính chất hoá học riêng, trong này không đề cập tới, có thể xem phần đọc thêm hoặc các bài giới thiệu riêng trong sgk. MỐI QUAN HỆ GIỮA CÁC LOẠI HỢP CHẤT VÔ CƠ KIM LOẠI PHI KIM + Oxi + H2, CO + Oxi OXIT AXIT OXIT BAZƠ + dd Kiềm + Oxax AXIT MẠNH YẾU + dd Muối + Oxbz + H2O BAZƠ KIỀM K.TAN MUỐI + H2O + Axit + H2O t0 + dd Muối + Oxax + Axit + dd Kiềm + Kim loại + Axit + Bazơ + Oxbz Phân huỷ CÁC PH ƠNG TRÌNH HOÁ HỌC MINH HOẠ TH ỜNG GẶP L u ý: Một số oxit kim loại nh Al2O3, MgO, BaO, CaO, Na2O, K2O không bị H2, CO khử. Các oxit kim loại khi ở trạng thái hoá trị cao là oxit axit nh : CrO3, Mn2O7, Các phản ứng hoá học xảy ra phải tuân theo các điều kiện của từng phản ứng. Khi oxit axit tác dụng với dd Kiềm thì tuỳ theo tỉ lệ số mol sẽ tạo ra muối axit hay muối trung hoà. VD: NaOH + CO2 đ NaHCO3 2NaOH + CO2 đ Na2CO3 + H2O Khi tác dụng với H2SO4 đặc, kim loại sẽ thể hiện hoá trị cao nhất, không giải phóng HidroVD: Cu + 2H2SO4 đ CuSO4 + SO2ư + H2O 4Al + 3O2 đ 2Al2O3 CuO + H2 Cu + H2O Fe2O3 + 3CO 2Fe + 3CO2 S + O2 đ SO2 CaO + H2O đ Ca(OH)2 Cu(OH)2 CuO + H2O CaO + 2HCl đ CaCl2 + H2O CaO + CO2 đ CaCO3 Na2CO3 + Ca(OH)2 đ CaCO3¯ + 2NaOH NaOH + HCl đ NaCl + H2O 2NaOH + CO2 đ Na2CO3 + H2O BaCl2 + Na2SO4 đ BaSO4¯ + 2NaCl SO3 + H2O đ H2SO4 P2O5 + 3H2O đ 2H3PO4 P2O5 + 6NaOH đ 2Na3PO4 + 3H2O N2O5 + Na2O đ 2NaNO3 BaCl2 + H2SO4 đ BaSO4¯ + 2HCl 2HCl + Fe đ FeCl2 + H2 2HCl + Ba(OH)2 đ BaCl2 + 2H2O 6HCl + Fe2O3 đ 2FeCl3 + 3H2O 2HCl + CaCO3 đ CaCl2 + 2H2O ĐIỀU CHẾ CÁC HỢP CHẤT VÔ CƠ 1 KIM LOẠI + OXI 4 NHIỆT PHÂN MUỐI 2 PHI KIM + OXI OXIT 5 NHIỆT PHÂN BAZƠ KHÔNG TAN 3 HỢP CHẤT + OXI 6 3Fe + 2O2 Fe3O4 4P + 5O2 2P2O5 CH4 + O2 CO2 + 2H2O CaCO3 CaO + CO2 Cu(OH)2 CuO + H2O Cl2 + H2 2HCl SO3 + H2O đ H2SO4 BaCl2 + H2SO4 đ BaSO4¯ + 2HCl Ca(OH)2 + Na2CO3 đ CaCO3¯ + 2NaOH CaO + H2O đ Ca(OH)2 NaCl + 2H2O NaOH + Cl2ư + H2ư PHI KIM + HIDRO OXIT AXIT + N ỚC AXIT MẠNH + MUỐI AXIT 7 8 9 KIỀM + DD MUỐI OXIT BAZƠ + N ỚC BAZƠ 10 11 ĐIỆN PHÂN DD MUỐI (CÓ MÀNG NGĂN) 12 19 AXIT + BAZƠ MUỐI KIM LOẠI + PHI KIM 20 13 OXIT BAZƠ + DD AXIT KIM LOẠI + DD AXIT ` 21 14 OXIT AXIT + DD KIỀM KIM LOẠI + DD MUỐI 15 OXIT AXIT + OXIT BAZƠ Ba(OH)2 + H2SO4 đ BaSO4¯ + 2H2O CuO + 2HCl đ CuCl2 + H2O SO2 + 2NaOH đNa2SO3 + H2O CaO + CO2 đ CaCO3 BaCl2 + Na2SO4 đ BaSO4¯ + 2NaCl CuSO4 + 2NaOH đ Cu(OH)2 + Na2SO4 CaCO3 + 2HCl đ CaCl2 + CO2ư + H2O 2Fe + 3Cl2 2FeCl3 Fe + 2HCl đ FeCl2 + H2ư Fe + CuSO4 đ FeSO4 + Cu¯ 16 DD MUỐI + DD MUỐI DD MUỐI + DD KIỀM 17 18 MUỐI + DD AXIT TÍNH CHẤT HOÁ HỌC CỦA KIM LOẠI OXIT MUỐI + H2 3Fe + 2O2 Fe3O4 2Fe + 3Cl2 2FeCl3 Fe + 2HCl đ FeCl2 + H2ư Fe + CuSO4 đ FeSO4 + Cu¯ + Axit + O2 KIM LOẠI + DD Muối + Phi kim MUỐI MUỐI + KL DÃY HOẠT ĐỘNG HOÁ HỌC CỦA KIM LOẠI. K, Na, Mg, Al, Zn, Fe, Pb, (H), Cu, Ag, Au (Khi Nào May Aó Záp Sắt Phải Hỏi Cúc Bạc Vàng) Ý nghĩa: K Ba Ca Na Mg Al Zn Fe Ni Sn Pb H Cu Ag Hg Au Pt + O2: nhiệt độ th ờng Ở nhiệt độ cao Khó phản ứng K Ba Ca Na Mg Al Zn Fe Ni Sn Pb H Cu Ag Hg Au Pt Tác dụng với n ớc Không tác dụng với n ớc ở nhiệt độ th ờng K Ba Ca Na Mg Al Zn Fe Ni Sn Pb H Cu Ag Hg Au Pt Tác dụng với các axit thông th ờng giải phóng Hidro Không tác dụng. K Ba Ca Na Mg Al Zn Fe Ni Sn Pb H Cu Ag Hg Au Pt Kim loại đứng tr ớc đẩy kim loại đứng sau ra khỏi muối K Ba Ca Na Mg Al Zn Fe Ni Sn Pb H Cu Ag Hg Au Pt H2, CO không khử đ ợc oxit khử đ ợc oxit các kim loại này ở nhiệt độ cao Chú ý: Các kim loại đứng tr ớc Mg phản ứng với n ớc ở nhiệt độ th ờng tạo thành dd Kiềm và giải phóng khí Hidro. Trừ Au và Pt, các kim loại khác đều có thể tác dụng với HNO3 và H2SO4 đặc nh ng không giải phóng Hidro. SO SÁNH TÍNH CHẤT HOÁ HỌC CỦA NHÔM VÀ SẮT * Giống: - Đều có các tính chất chung của kim loại. - Đều không tác dụng với HNO3 và H2SO4 đặc nguội * Khác: Tính chất Al (NTK = 27) Fe (NTK = 56) Tính chất vật lý - Kim loại màu trắng, có ánh kim, nhẹ, dẫn điện nhiệt tốt. - t0nc = 6600C - Là kim loại nhẹ, dễ dát mỏng, dẻo. - Kim loại màu trắng xám, có ánh kim, dẫn điện nhiệt kém hơn Nhôm. - t0nc = 15390C - Là kim loại nặng, dẻo nên dễ rèn. Tác dụng với phi kim 2Al + 3Cl2 2AlCl3 2Al + 3S Al2S3 2Fe + 3Cl2 2FeCl3 Fe + S FeS Tác dụng với axit 2Al + 6HCl đ 2AlCl3 + 3H2 Fe + 2HCl đ FeCl2 + H2 Tác dụng với dd muối 2Al + 3FeSO4 đ Al2(SO4)3 + 3Fe Fe + 2AgNO3 đ Fe(NO3)2 + 2Ag Tác dụng với dd Kiềm 2Al + 2NaOH + H2O đ 2NaAlO2 + 3H2 Không phản ứng Hợp chất - Al2O3 có tính l ỡng tính Al2O3 + 6HCl đ 2AlCl3 + 3H2O Al2O3+ 2NaOHđ2NaAlO2 + H2O - Al(OH)3 kết tủa dạng keo, là hợp chất l ỡng tính - FeO, Fe2O3 và Fe3O4 đều là các oxit bazơ Fe(OH)2 màu trắng xanh Fe(OH)3 màu nâu đỏ Kết luận - Nhôm là kim loại l ỡng tính, có thể tác dụng với cả dd Axit và dd Kiềm. Trong các phản ứng hoá học, Nhôm thể hiện hoá trị III - Sắt thể hiện 2 hoá trị: II, III + Tác dụng với axit thông th ờng, với phi kim yếu, với dd muối: II + Tác dụng với H2SO4 đặc nóng, dd HNO3, với phi kim mạnh: III Gang và thép Gang Thép Đ/N - Gang là hợp kim của Sắt với Cacbon và 1 số nguyên tố khác nh Mn, Si, S (%C=2á5%) - Thép là hợp kim của Sắt với Cacbon và 1 số nguyên tố khác (%C<2%) Sản xuất C + O2 CO2 CO2 + C 2CO 3CO + Fe2O3 2Fe + 3CO2 4CO + Fe3O4 3Fe + 4CO2 CaO + SiO2 CaSiO3 2Fe + O2 2FeO FeO + C Fe + CO FeO + Mn Fe + MnO 2FeO + Si 2Fe + SiO2 Tính chất Cứng, giòn Cứng, đàn hồi TÍNH CHẤT HOÁ HỌC CỦA PHI KIM. + Hidro + O2 PHI KIM OXIT AXIT SẢN PHẨM KHÍ HCl + HClO NaCl + NaClO N ớc Gia-ven + H2O HCl + NaOH + NaOH + Hidro + KOH, t0 + Kim loại CLO + Kim loại MUỐI CLORUA OXIT KIM LOẠI HOẶC MUỐI KCl + KClO3 Kim c ơng: Là chất rắn trong suốt, cứng, không dẫn điện Làm đồ trang sức, mũi khoan, dao cắt kính Than chì: Là chất rắn, mềm, có khả năng dẫn điện Làm điện cực, chất bôi trơn, ruột bút chì Cacbon vô định hình: Là chất rắn, xốp, không có khả năng dẫn điện, có ính hấp phụ. Làm nhiên liệu, chế tạo mặt nạ phòng độc Hidrocabon no Ankan CTTQ CnH2n+2 VD: CH4 (Metan) Hidrocacbon không no Anken CTTQ: CnH2n VD: C2H4 (Etilen) Hidrocacbon không no Ankin CTTQ: CnH2n-2 VD: C2H4 (Axetilen) Hidrocacbon thơm Aren CTTQ CnH2n-6 VD: C6H6 (Benzen) Dẫn xuất chứa Halogen VD: C2H5Cl C6H5Br Dẫn xuất chứa Oxi VD: C2H5OH CH3COOH Chất béo Gluxit Dẫn xuất chứa Nitơ VD: Protein PHÂN LOẠI HỢP CHẤT HỮU CƠ + Oxit KL DẪN XUẤT CỦA RH HIDRO CACBON HỢP CHẤT HỮU CƠ 6. NaCl + 2H2O 2NaOH + Cl2 + H2 C + 2CuO 2Cu + CO2 3CO + Fe2O3 2Fe + 3CO2 NaOH + CO2 đ NaHCO3 2NaOH + CO2 đ Na2CO3 + H2O CÁC PH ƠNG TRÌNH HOÁ HỌC ĐÁNG NHỚ 2Fe + 3Cl2 đ 2FeCl3 Fe + S FeS H2O + Cl2 đ HCl + HClO 2NaOH + Cl2 đ NaCl + NaClO + H2O 4HCl + MnO2 MnCl2 + Cl2 + 2H2O KIM LOẠI + CO2 CO2 CACBON Ba dạng thù hình của Cacbon + O2 Hợp chất Metan Etilen Axetilen Benzen CTPT. PTK CH4 = 16 C2H4 = 28 C2H2 = 26 C6H6 = 78 Công thức cấu tạo Liên kết đơn Liên kết đôi gồm 1 liên kết bền và 1 liên kết kém bền Liên kết ba gồm 1 liên kết bền và 2 liên kết kém bền 3lk đôi và 3lk đơn xen kẽ trong vòng 6 cạnh đều Trạng thái Khí Lỏng Tính chất vật lý Không màu, không mùi, ít tan trong n ớc, nhẹ hơn không khí. Không màu, không tan trong n ớc, nhẹ hơn n ớc, hoà tan nhiều chất, độc Tính chất hoá học - Giống nhau Có phản ứng cháy sinh ra CO2 và H2O CH4 + 2O2 đ CO2 + 2H2O C2H4 + 3O2 đ 2CO2 + 2H2O 2C2H2 + 5O2 đ 4CO2 + 2H2O 2C6H6 + 15O2 đ 12CO2 + 6H2O - Khác nhau Chỉ tham gia phản ứng thế CH4 + Cl2 CH3Cl + HCl Có phản ứng cộng C2H4 + Br2 đ C2H4Br2 C2H4 + H2 C2H6 C2H4 + H2O đ C2H5OH Có phản ứng cộng C2H2 + Br2 đ C2H2Br2 C2H2 + Br2 đ C2H2Br4 Vừa có phản ứng thế và phản ứng cộng (khó) C6H6 + Br2 C6H5Br + HBr C6H6 + Cl2 Ứng dụng Làm nhiên liệu, nguyên liệu trong đời sống và trong công nghiệp Làm nguyên liệu điều chế nhựa PE, r ợu Etylic, Axit Axetic, kích thích quả chín. Làm nhiên liệu hàn xì, thắp sáng, là nguyên liệu sản xuất PVC, cao su Làm dung môi, diều chế thuốc nhuộm, d ợc phẩm, thuốc BVTV Điều chế Có trong khí thiên nhiên, khí đồng hành, khí bùn ao. Sp chế hoá dầu mỏ, sinh ra khi quả chín C2H5OH C2H4 + H2O Cho đất đèn + n ớc, sp chế hoá dầu mỏ CaC2 + H2O đ C2H2 + Ca(OH)2 Sản phẩm ch ng nhựa than đá. Nhận biết Khôg làm mất màu dd Br2 Làm mất màu Clo ngoài as Làm mất màu dung dịch Brom Làm mất màu dung dịch Brom nhiều hơn Etilen Ko làm mất màu dd Brom Ko tan trong n ớc R ỢU ETYLIC AXIT AXETIC Công thức CTPT: C2H6O CTCT: CH3 – CH2 – OH CTPT: C2H4O2 CTCT: CH3 – CH2 – COOH Tính chất vật lý Là chất lỏng, không màu, dễ tan và tan nhiều trong n ớc. Sôi ở 78,30C, nhẹ hơn n ớc, hoà tan đ ợc nhiều chất nh Iot, Benzen Sôi ở 1180C, có vị chua (dd Ace 2-5% làm giấm ăn) Tính chất hoá học. Phản ứng với Na: 2C2H5OH + 2Na đ 2C2H5ONa + H2 2CH3COOH + 2Na đ 2CH3COONa + H2 R ợu Etylic tác dụng với axit axetic tạo thành este Etyl Axetat CH3COOH + C2H5OH CH3COOC2H5 + H2O Cháy với ngọn lửa màu xanh, toả nhiều nhiệt C2H6O + 3O2 đ 2CO2 + 3H2O Bị OXH trong kk có men xúc tác C2H5OH + O2 CH3COOH + H2O - Mang đủ tính chất của axit: Làm đỏ quỳ tím, tác dụng với kim loại tr ớc H, với bazơ, oxit bazơ, dd muối 2CH3COOH + Mg đ (CH3COO)2Mg + H2 CH3COOH + NaOH đ CH3COONa + H2O Ứng dụng Dùng làm nhiên liệu, dung môi pha sơn, chế r ợu bia, d ợc phẩm, điều chế axit axetic và cao su Dùng để pha giấm ăn, sản xuất chất dẻo, thuốc nhuộm, d ợc phẩm, tơ Điều chế Bằng ph ơng pháp lên men tinh bột hoặc đ ờng C6H12O6 2C2H5OH + 2CO2 Hoặc cho Etilen hợp n ớc C2H4 + H2O C2H5OH Lên men dd r ợu nhạt C2H5OH + O2 CH3COOH + H2O Trong PTN: 2CH3COONa + H2SO4 đ 2CH3COOH + Na2SO4 GLUCOZƠ SACCAROZƠ TINH BỘT VÀ XENLULOZƠ Công thức phân tử C6H12O6 C12H22O11 (C6H10O5)n Tinh bột: n ằ 1200 – 6000 Xenlulozơ: n ằ 10000 – 14000 Trạng thái Tính chất vật lý Chất kết tinh, không màu, vị ngọt, dễ tan trong n ớc Chất kết tinh, không màu, vị ngọt sắc, dễ tan trong n ớc, tan nhiều trong n ớc nóng Là chất rắn trắng. Tinh bột tan đ ợc trong n ớc nóng đ hồ tinh bột. Xenlulozơ không tan trong n ớc kể cả đun nóng Tính chất hoá học quan trọng Phản ứng tráng g ơng C6H12O6 + Ag2O đ C6H12O7 + 2Ag Thuỷ phân khi đun nóng trong dd axit loãng C12H22O11 + H2O C6H12O6 + C6H12O6 glucozơ fructozơ Thuỷ phân khi đun nóng trong dd axit loãng (C6H10O5)n + nH2O nC6H12O6 Hồ tinh bột làm dd Iot chuyển màu xanh ứng dụng Thức ăn, d ợc phẩm Thức ăn, làm bánh kẹo Pha chế d ợc phẩm Tinh bột là thức ăn cho ng ời và động vật, là nguyên liệu để sản xuất đ ờng Glucozơ, r ợu Etylic. Xenlulozơ dùng để sản xuất giấy, vải, đồ gỗ và vật liệu xây dựng. Điều chế Có trong quả chín (nho), hạt nảy mầm; điều chế từ tinh bột. Có trong mía, củ cải đ ờng Tinh bột có nhiều trong củ, quả, hạt. Xenlulozơ có trong vỏ đay, gai, sợi bông, gỗ Nhận biết Phản ứng tráng g ơng Có phản ứng tráng g ơng khi đun nóng trong dd axit Nhận ra tinh bột bằng dd Iot: có màu xanh đặc tr ng PHẦN B: C ÁC CHUY ÊN ĐỀ CƠ BẢN BỒI DƯỠNG HSG MÔN HOÁ THCS CHUYÊN ĐỀ 1: CƠ CHẾ VÀ CÂN BẰNG PH ƯƠNG TRÌNH HOÁ HỌC I/ Phản ứng oxi hoá- khử, và không oxi hoá- khử. 1/ Phản ứng hoá hợp. Đặc điểm của phản ứng: Có thể xảy ra sự thay đổi số oxi hoá hoặc không. Ví dụ: Phản ứng có sự thay đổi số oxi hoá. 4Al (r) + 3O2 (k) ----> 2Al2O3 (r) Phản ứng không có sự thay đổi số oxi hoá. BaO (r) + H2O (l) ----> Ba(OH)2 (dd) 2/ Phản ứng phân huỷ. - Đặc điểm của phản ứng: Có thể xảy ra sự thay đổi số oxi hoá hoặc không. Ví dụ: Phản ứng có sự thay đổi số oxi hoá. 2KClO3 (r) -------> 2KCl (r) + 3O2 (k) Phản ứng không có sự thay đổi số oxi hoá. CaCO3 (r) -----> CaO (r) + CO2 (k) II/ Phản ứng có sự thay đổi số oxi hoá. 1/ Phản ứng thế. Đặc điểm của phản ứng: Nguyên tử của đơn chất thay thế một hay nhiều nguyên tử của một nguyên tố trong hợp chất. Ví dụ: Zn (r) + 2HCl (dd) ----> ZnCl2 (dd) + H2 (k) 2/ Phản ứng oxi hoá - khử. Đặc điểm của phản ứng: Xảy ra đồng thời sự oxi hoá và sự khử. hay xảy ra đồng thời sự nh ờng electron và sự nhận electron. Ví dụ: CuO (r) + H2 (k) ------> Cu (r) + H2O (h) Trong đó: H2 là chất khử (Chất nh ờng e cho chất khác) CuO là chất oxi hoá (Chất nhận e của chất khác) Từ H2 -----> H2O đ ợc gọi là sự oxi hoá. (Sự chiếm oxi của chất khác) Từ CuO ----> Cu đ ợc gọi là sự khử. (Sự nh ờng oxi cho chất khác) III/ Phản ứng không có thay đổi số oxi hoá. 1/ Phản ứng giữa axit và bazơ. Đặc điểm của phản ứng: Sản phẩm thu đ ợc là muối và n ớc. Ví dụ: 2NaOH (dd) + H2SO4 (dd) ----> Na2SO4 (dd) + 2H2O (l) NaOH (dd) + H2SO4 (dd) ----> NaHSO4 (dd) + H2O (l) Cu(OH)2 (r) + 2HCl (dd) ----> CuCl 2 (dd) + 2H2O (l) Trong đó: Phản ứng trung hoà (2 chất tham gia ở trạng thái dung dịch). Đặc điểm của phản ứng: là sự tác dụng giữa axit và bazơ với l ợng vừa đủ. Sản phẩm của phản ứng là muối trung hoà và n ớc. Ví dụ: NaOH (dd) + HCl (dd) ----> NaCl (dd) + H2O (l) 2/ Phản ứng gữa axit và muối. Đặc điểm của phản ứng: Sản phẩm thu đ ợc phải có ít nhất một chất không tan hoặc một chất khí hoặc một chất điện li yếu. Ví dụ: Na2CO3 (r) + 2HCl (dd) ----> 2NaCl (dd) + H2O (l) + CO2 (k) BaCl2 (dd) + H2SO4 (dd) -----> BaSO4 (r) + 2HCl (dd) L u ý: BaSO4 là chất không tan kể cả trong môi tr ờng axit. 3/ Phản ứng giữa bazơ và muối. Đặc điểm của phản ứng: + Chất tham gia phải ở trạng thái dung dịch (tan đ ợc trong n ớc) + Chất tạo thành (Sản phẩm thu đ ợc) phải có ít nhất một chất không tan hoặc một chất khí hoặc một chất điện li yếu. + Chú ý các muối kim loại mà oxit hay hiđroxit có tính chất l ỡng tính phản ứng với dung dịch bazơ mạnh. Ví dụ: 2NaOH (dd) + CuCl2 (dd) ----> 2NaCl (dd) + Cu(OH)2 (r) Ba(OH)2 (dd) + Na2SO4 (dd) ---> BaSO4 (r) + 2NaOH (dd) NH4Cl (dd) + NaOH (dd) ---> NaCl (dd) + NH3 (k) + H2O (l) AlCl3 (dd) + 3NaOH (dd) ----> 3NaCl (dd) + Al(OH)3 (r) Al(OH)3 (r) + NaOH (dd) ---> NaAlO2 (dd) + H2O (l) 4/ Phản ứng giữa 2 muối với nhau. Đặc điểm của phản ứng: + Chất tham gia phải ở trạng thái dung dịch (tan đ ợc trong n ớc) + Chất tạo thành (Sản phẩm thu đ ợc) phải có ít nhất một chất không tan hoặc một chất khí hoặc một chất điện li yếu. Ví dụ: NaCl (dd) + AgNO3 (dd) ----> AgCl (r) + NaNO3 (dd) BaCl2 (dd) + Na2SO4 (dd) ----> BaSO4 (r) + 2NaCl (dd) 2FeCl3 (dd) + 3H2O (l) + 3Na2CO3 (dd) ----> 2Fe(OH)3 (r) + 3CO2 (k) + 6NaCl (dd) GIỚI THIỆU 1 SỐ PH ƠNG PHÁP CÂN BẰNG PH ƠNG TRÌNH HOÁ HỌC. 1/ Cân bằng ph ơng trình theo ph ơng pháp đại số. Ví dụ: Cân bằng ph ơng trình phản ứng P2O5 + H2O -> H3PO4 Đ a các hệ số x, y, z vào ph ơng trình ta có: - Căn cứ vào số nguyên tử P ta có: 2x = z (1) - Căn cứ vào số nguyên tử O ta có: 5x + y = z (2) - Căn cứ vào số nguyên tử H ta có: 2y = 3z (3) Thay (1) vào (3) ta có: 2y = 3z = 6x => y = = 3x Nếu x = 1 thì y = 3 và z = 2x = 2.1 = 2 => Ph ơng trình ở dạng cân bằng nh sau: P2O5 + 3H2O -> 2H3PO4 Ví dụ: Cân bằng ph ơng trình phản ứng. Al + HNO3 (loãng) ----> Al(NO3)3 + NO + H2O B ớc 1: Đặt hệ số bằng các ẩn số a, b, c, d tr ớc các chất tham gia và chất tạo thành (Nếu 2 chất mà trùng nhau thì dùng 1 ẩn) Ta có. a Al + b HNO3 ----> a Al(NO3) 3 + c NO + b/2 H2O. B ớc 2: Lập ph ơng trình toán học với từng loại nguyên tố có sự thay đổi về số nguyên tử ở 2 vế. Ta nhận thấy chỉ có N và O là có sự thay đổi. N: b = 3a + c (I) O: 3b = 9a + c + b/2 (II) B ớc 3: Giải ph ơng trình toán học để tìm hệ số Thay (I) vào (II) ta đ ợc. 3(3a + c) = 9a + c + b/2 2c = b/2 ----> b = 4c ---> b = 4 và c = 1. Thay vào (I) ---> a = 1. B ớc 4: Thay hệ số vừa tìm đ ợc vào ph ơng trình và hoàn thành ph ơng trình. Al + 4 HNO3 ----> Al(NO3)3 + NO + 2 H2O B ớc 5: Kiểm tra lại ph ơng trình vừa hoàn thành. 2/ Cân bằng theo ph ơng pháp electron. Ví dụ: Cu + HNO3 (đặc) -----> Cu(NO3)2 + NO2 + H2O B ớc 1: Viết PTPƯ để xác định sự thay đổi số oxi hoá của nguyên tố. Ban đầu: Cu0 ----> Cu+ 2 Trong chất sau phản ứng Cu(NO3)2 Ban đầu: N+ 5 (HNO3) ----> N+ 4 Trong chất sau phản ứng NO2 B ớc 2: Xác định số oxi hoá của các nguyên tố thay đổi. Cu0 ----> Cu+ 2 N+ 5 ----> N+ 4 B ớc 3: Viết các quá trình oxi hoá và quá trình khử. Cu0 – 2e ----> Cu+ 2 N+ 5 + 1e ----> N+ 4 B ớc 4: Tìm bội chung để cân bằng số oxi hoá. 1 Cu0 – 2e ----> Cu+ 2 2 N+ 5 + 1e ----> N+ 4 B ớc 5: Đ a hệ số vào ph ơng trình, kiểm tra, cân bằng phần không oxi hoá - khử và hoàn thành PTHH. Cu + 2HNO3 (đặc) -----> Cu(NO3)2 + 2NO2 + H2O + 2HNO3 (đặc) -----> Cu + 4HNO3 (đặc) -----> Cu(NO3)2 + 2NO2 + 2H2O 3/ Cân bằng theo ph ơng pháp bán phản ứng ( Hay ion - electron) Theo ph ơng pháp này thì các b ớc 1 và 2 giống nh ph ơng pháp electron. B ớc 3: Viết các bán phản ứng oxi hoá và bán phản ứng khử theo nguyên tắc: + Các dạng oxi hoá và dạng khử của các chất oxi hoá, chất khử nếu thuộc chất điện li mạnh thì viết d ới dạng ion. Còn chất điện li yếu, không điện li, chất rắn, chất khí thì viết d ới dạng phân tử (hoặc nguyên tử). Đối với bán phản ứng oxi hoá thì viết số e nhận bên trái còn bán phản ứng thì viết số e cho bên phải. B ớc 4: Cân bằng số e cho – nhận và cộng hai bán phản ứng ta đ ợc ph ơng trình phản ứng dạng ion. Muốn chuyển ph ơng trình phản ứng dạng ion thành dạng phân tử ta cộng 2 vế những l ợng t ơng đ ơng nh nhau ion trái dấu (Cation và anion) để bù trừ điện tích. Chú ý: cân bằng khối l ợng của nửa phản ứng. Môi tr ờng axit hoặc trung tính thì lấy oxi trong H2O. B ớc 5: Hoàn thành ph ơng trình. MỘT SỐ PHẢN ỨNG HOÁ HỌC TH ỜNG GẶP. Cần nắm vững điều kiện để xảy ra phản ứng trao đổi trong dung dịch. Gồm các phản ứng: 1/ Axit + Bazơ Muối + H2O 2/ Axit + Muối Muối mới + Axít mới 3/ Dung dịch Muối + Dung dịch Bazơ Muối mới + Bazơ mới 4/ 2 Dung dịch Muối tác dụng với nhau 2 Muối mới Điều kiện để xảy ra phản ứng trao đổi là: Sản phẩm thu đ ợc phải có ít nhất một chất không tan hoặc một chất khí hoặc phải có H2O và các chất tham gia phải theo yêu cầu của từng phản ứng. Tính tan của một số muối và bazơ. Hầu hết các muối clo rua đều tan ( trừ muối AgCl , PbCl2 ) Tất cả các muối nit rat đều tan. Tất cả các muối của kim loại kiềm đều tan. Hầu hết các bazơ không tan ( trừ các bazơ của kim loại kiềm, Ba(OH)2 và Ca(OH)2 tan ít. * Na2CO3 , NaHCO3 ( K2CO3 , KHCO3 ) và các muối cacbonat của Ca, Mg, Ba đều tác dụng đ ợc với a xít. NaHCO3 + NaHSO4 Na2SO4 + H2O + CO2 Na2CO3 + NaHSO4 Không xảy ra NaHCO3 + NaOH Na2CO3 + H2O Na2CO3 + NaOH Không xảy ra 2NaHCO3 Na2CO3 + H2O + CO2 NaHCO3 + Ba(OH)2 BaCO3 + NaOH + H2O 2NaHCO3 + 2KOH Na2CO3 + K2CO3 + 2H2O Na2CO3 + Ba(OH)2 BaCO3 + 2NaOH Ba(HCO3)2 + Ba(OH)2 2BaCO3 + 2H2O Ca(HCO3)2 + Ba(OH)2 BaCO3 + CaCO3 + 2H2O NaHCO3 + BaCl2 không xảy ra Na2CO3 + BaCl2 BaCO3 + 2NaCl Ba(HCO3)2 + BaCl2 không xảy ra Ca(HCO3)2 + CaCl2 không xảy ra NaHSO3 + NaHSO4 Na2SO4 + H2O + SO2 Na2SO3 + H2SO4 Na2SO4 + H2O + SO2 2NaHSO3 + H2SO4 Na2SO4 + 2H2O + 2SO2 Na2SO3 + 2NaHSO4 2Na2SO4 + H2O + SO2 2KOH + 2NaHSO4 Na2SO4 + K2SO4 + H2O (NH4)2CO3 + 2NaHSO4 Na2SO4 + (NH4)2SO4 + H2O + CO2 Fe + CuSO4 FeSO4 + Cu Cu + Fe SO4 không xảy ra Cu + Fe2(SO4)3 2FeSO4 + CuSO4 Fe + Fe2(SO4)3 3FeSO4 2FeCl2 + Cl2 2FeCl3 BẢNG TÍNH TAN TRONG N ỚC CỦA CÁC AXIT – BAZƠ - MUỐI Nhóm hiđroxit và gốc axit HIĐRO VÀ CÁC KIM LOẠI H I K I Na I Ag I Mg II Ca II Ba II Zn II Hg II Pb II Cu II Fe II Fe III Al III - OH t t - k i t k - k k k k k - Cl t/b t t k t t t t t i t t t t - NO3 t/b t t t t t t t t t t t t t - CH3COO t/b t t t t t t t t t t t - t = S t/b t t k - t t k k k k k k – = SO3 t/b t t k k k k k k k k k - – = SO4 t/kb t t i t i k t - k t t t t = CO3 t/b t t k k k k k - k - k - – = SiO3 k/kb t t – k k k k – k – k k k = PO4 t/kb t t k k k k k k k k k k k t : hợp chất không tan đ ợc trong n ớc . k: hợp chất không tan i: hợp chất ít tan. b: hợp chất bay hơi hoặc dễ bi phân huỷ thành khí bay lên. kb : hợp chất không bay hơi. Vạch ngang “ - " :hợp chất không tồn tại hoặc bị phân huỷ trong n ớc. Một số PTHH cần l u ý: Ví dụ: Hoà tan m( gam ) MxOy vào dung dịch axit (HCl, H2SO4, HNO3) Ta có PTHH cân bằng nh sau: l u ý 2y/x là hoá trị của kim loại M MxOy + 2yHCl xMCl2y/x + yH2O 2MxOy + 2yH2SO4 xM2(SO4)2y/x + 2yH2O MxOy + 2yHNO3 xM(NO3)2y/x + yH2O VD: Hoà tan m( gam ) kim loại M vào dung dịch a xit (HCl, H2SO4) Ta có PTHH cân bằng nh sau: l u ý x là hoá trị của kim loại M 2M + 2xHCl 2MClx + xH2 áp dụng: Fe + 2HCl FeCl2 + H2 2Al + 2*3 HCl 2AlCl3 + 3H2 6 2M + xH2SO4 M2(SO4)x + xH2 áp dụng: Fe + H2SO4 FeSO4 + H2 2Al + 3H2SO4 Al2(SO4)3 + 3H2 Các phản ứng điều chế một số kim loại: Đối với một số kim loại nh Na, K, Ca, Mg thì dùng ph ơng pháp điện phân nóng chảy các muối Clorua. PTHH chung: 2MClx (r ) 2M(r ) + Cl2( k ) (đối với các kim loại hoá trị II thì nhớ đơn giản phần hệ số) Đối với nhôm thì dùng ph ơng pháp điện phân nóng chảy Al2O3, khi có chất xúc tác Criolit(3NaF.AlF3) , PTHH: 2Al2O3 (r ) 4Al ( r ) + 3 O2 (k ) Đối với các kim loại nh Fe , Pb , Cu th
Tài liệu đính kèm:
 cac_chuyen_de_hoa_hoc_thcs.doc
cac_chuyen_de_hoa_hoc_thcs.doc





