Đề kiểm tra cuối học kì I môn Hóa học Lớp 9 - Năm học 2022-2023 - Trường TH và THCS Cư Yên (Có đáp án)
Bạn đang xem tài liệu "Đề kiểm tra cuối học kì I môn Hóa học Lớp 9 - Năm học 2022-2023 - Trường TH và THCS Cư Yên (Có đáp án)", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
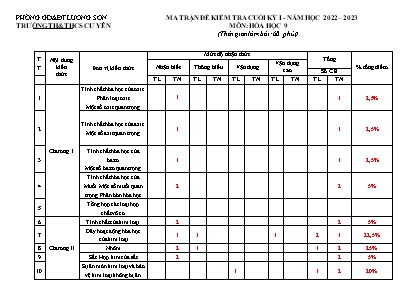
PHÒNG GD&ĐT LƯƠNG SƠN MA TRẬN ĐỀ KIỂM TRA CUỐI KỲ I - NĂM HỌC 2022 – 2023 TRƯỜNG TH&THCS CƯ YÊN MÔN: HÓA HỌC 9 (Thời gian làm bài: 60 phút) TT Nội dung kiến thức Đơn vị kiến thức Mức độ nhận thức Tổng % tổng điểm Nhận biết Thông hiểu Vận dụng Vận dụng cao Số CH TL TN TL TN TL TN TL TN TL TN 1 Chương 1 Tính chất hóa học của oxit. Phân loại oxit Một số oxit quan trọng 1 1 2,5% 2 Tính chất hóa học của axit. Một số axit quan trọng 1 1 2,5% 3 Tính chất hóa học của bazơ. Một số bazơ quan trọng 1 1 2,5% 4 Tính chất hóa học của Muối. Một số muối quan trọng. Phân bón hóa học 2 2 5% 5 Tổng hợp các loại hợp chất vô cơ 6 Chương II Tính chất của kim loại. 2 2 5% 7 Dãy hoạt động hóa học của kim loại 1 1 1 2 1 22,5% 8 Nhôm 2 1 1 2 25% 9 Sắt. Hợp kim của sắt 2 2 5% 10 Sự ăn mòn kim loại và bảo vệ kim loại không bị ăn mòn 1 1 2 20% Tổng 12 2 20p 1 8p 1 14p 16 4 Tỉ lệ (%) 40% 30% 20% 10% 100% Tỉ lệ chung (%) 70% 30% BẢNG ĐẶC TẢ ĐỀ KIỂM TRA CUỐI KÌ 1 MÔN: HÓA HỌC 9 – THỜI GIAN LÀM BÀI 60 PHÚT TT Nội dung kiến thức Đơn vị kiến thức Mức độ kiến thức, kĩ năng cần kiểm tra, đánh giá Số câu hỏi theo các mức độ nhận thức Tổng Nhận biết Thông hiểu Vận dụng Vận dụng cao 1 Oxit - Tính chất hoá học của oxit. Khái quát về sự phân loại oxit. - Một số oxit quan trọng. Nhận biết: - Tính chất hoá học của oxit [1] - Sự phân loại oxit, chia ra các loại: oxit axit, oxit bazơ, oxit lưỡng tính và oxit trung tính. - Tính chất, ứng dụng, điều chế canxi oxit và lưu huỳnh đioxit. Thông hiểu: - Viết được các phương trình hoá học minh họa tính chất hoá học của một số oxit. - Phân biệt được một số oxit cụ thể. Vận dụng: - Tính thành phần phần trăm về khối lượng của oxit trong hỗn hợp hai chất. Vận dụng cao: Giải được các câu hỏi, bài tập liên quan đến oxit trong thực tiễn đời sống. 1 1 2 Axit - Tính chất hoá học của axit. - Một số axit quan trọng. Nhận biết: - Tính chất vật lí của axit. [2] - Tính chất hóa học của axit (Tác dụng với quỳ tím, với bazơ, oxit bazơ và kim loại). - ứng dụng H2SO4 - Phương pháp sản xuất H2SO4 trong công nghiệp. Thông hiểu: - Xác định sản phẩm phản ứng của một số phản ứng đơn giản Vận dụng: - Viết các phương trình hoá học chứng minh tính chất của H2SO4 loãng và H2SO4 đặc, nóng. - cách nhận biết axit HCl, H2SO4 loãng và H2SO4 đặc (tác dụng với kim loại, tính háo nước). - Giải được các câu hỏi lí thuyết liên quan đến axit trong thực tiễn đời sống Vận dụng cao: - Tính nồng độ hoặc khối lượng dung dịch axit HCl, H2SO4 trong phản ứng. 1 1 3 Bazơ - Tính chất hoá học của bazơ. - Một số bazơ quan trọng. Nhận biết: - Tính chất hoá học chung của bazơ (tác dụng với chất chỉ thị màu, và với axit); tính chất hoá học riêng của bazơ tan (kiềm) (tác dụng với oxit axit và với dung dịch muối); tính chất riêng của bazơ không tan trong nước(bị nhiệt phân huỷ). [3] - Tính chất, ứng dụng của natri hiđroxit NaOH và canxi hiđroxit Ca(OH)2; phương pháp sản xuất NaOH từ muối ăn. - Thang pH và ý nghĩa giá trị pH của dung dịch. Thông hiểu: - Nhận biết môi trường dung dịch bằng chất chỉ thị màu (giấy quỳ tím hoặc dung dịch phenolphtalein); nhận biết được dung dịch NaOH và dung dịch Ca(OH)2. - Xác định sản phẩm phản ứng của một số phản ứng đơn giản Vận dụng: - Viết các phương trình hoá học minh họa tính chất hoá học của bazơ. - Giải được các câu hỏi liên quan đến bazơ trong thực tiễn đời sống. Vận dụng cao: - Tìm khối lượng hoặc thể tích dung dịch NaOH và Ca(OH)2 tham gia phản ứng. 1 1 4 Muối. Phân bón hóa học - Tính chất hoá học của muối. - Một số muối quan trọng. - Phân bón hóa học Nhận biết: - Tính chất hoá học của muối: tác dụng với kim loại, dung dịch axit, dung dịch bazơ, dung dịch muối khác, nhiều muối bị nhiệt phân huỷ ở nhiệt độ cao. [4] - Một số tính chất và ứng dụng, trạng thái tự nhiên của natri clorua (NaCl) - Khái niệm phản ứng trao đổi và điều kiện để phản ứng trao đổi thực hiện được. - Tên, thành phần hoá học và ứng dụng của một số phân bón hoá học thông dụng. [5] Thông hiểu: - Nhận biết được một số muối cụ thể và một số phân bón hoá học thông dụng. - Viết được các phương trình hoá học minh hoạ tính chất hoá học của muối. Vận dụng: - Tính khối lượng hoặc thể tích dung dịch muối trong phản ứng. Vận dụng cao: Giải được các câu hỏi, bài tập liên quan đến muối, phân bón hóa học trong thực tiễn đời sống. 2 2 5 Tổng hợp về các hợp chất vô cơ Thông hiểu: - Tính chất vật lý của các oxit, axit, bazo, muối - Tính chất hóa học đặc trưng của các oxit, axit, bazo, muối Vận dụng – Lập sơ đồ mối quan hệ giữa các loại hợp chất vô cơ. – Viết được các phương trình hoá học biểu diễn sơ đồ chuyển hoá. – Phân biệt một số hợp chất vô cơ cụ thể. Vận dụng cao: - Tính khối lượng, thể tích các chất có trong hỗn hợp các oxit, axit, bazo, muối 6 Tính chất của kim loại. Nhận biết: - Tính chất vật lý, chất hóa học, ứng dụng của kim loại trong đời sống, sản xuất. [6, 7] - Biết kim loại mạnh đẩy được kim loại yếu hơn ra khỏi muối. Thông hiểu: - Viết được các phương trình hoá học minh họa tính chất hoá học của kim loại. Vận dụng: - Tính thành phần phần trăm về khối lượng của kim loại trong hỗn hợp hai chất. Vận dụng cao: Giải được các bài câu hỏi, bài tập liên quan đến kim loại trong thực tiễn đời sống. 2 2 7 Dãy hoạt động hóa học của kim loại Nhận biết: - Ý nghĩa của dãy hoạt động hóa học. [ 8] Thông hiểu: - Viết được các phương trình hoá học minh họa tính chất hoá học của kim loại theo dãy hoạt động hóa học. - Sắp xếp kim loại theo mức độ hoạt động hóa học. [1 - TL] Vận dụng: - Vận dụng ý nghĩa của dãy HĐHH của kim loại để xét phản ứng cụ thể của kim loại với các chất khác có xảy ra hay không. Vận dụng cao: - Giải được các bài tập liên quan đến dãy hoạt động hóa học của kim loại. [4 - TL] 1 1 1 3 8 Nhôm Nhận biết: - Tính chất vật lý, chất hóa học ứng dụng, sản xuất Nhôm. [9, 10] Thông hiểu: - Viết được các phương trình hoá học minh họa tính chất hoá học của Nhôm. [ 2 - TL] Vận dụng: - Phân biệt Nhôm với các lim loại khác dựa vào tính chất hóa học riêng của Nhôm là phản ứng với kiềm. - Giải thích được những câu hỏi liên quan đến ứng dụng của nhôm trong đời sống. Vận dụng cao: - Giải được các bài tập liên quan đến phần trăm khối lượng kim loại Nhôm trong hỗn hợp 2 kim loại. 2 1 3 9 Sắt. Hợp kim của sắt Nhận biết: - Tính chất vật lý, chất hóa học của Sắt. [11, 12] - Biết được gang, thép là gì. Tính chất , ứng dụng của gang, thép - Biết nguyên liệu, nguyên tắc, quá trình sản xuất gang, thép. Thông hiểu: - Viết được các phương trình hoá học cơ bản trong quá trình luyện gang thép. - Viết PTHH thực hiện chuỗi phản ứng. Vận dụng: - Giải quyết được các câu hỏi liên quan đến khí thải trong quá trình sản xuất gang, thép. Vận dụng cao: - Tính khối lượng quặng manhetit hoặc hematit chứa các oxit sắt cần thiết để sản xuất gang. 2 2 10 Sự ăn mòn kim loại và bảo vệ kim loại không bị ăn mòn Nhận biết: - Khái niệm về sự ăn mòn kim loại. - Nguyên nhân làm kim loại bị ăn mòn, các yếu tố ảnh hưởng đến sự ăn mòn. - Biện pháp bảo vệ các đồ vật bằng kim loại không bị ăn mòn. Thông hiểu: - Bản chất của sự ăn mòn kim loại. Vận dụng: - Giải thích được các hiện tượng ăn mòn kim loại hoặc hợp kim trong đời sống, sản xuất. [3 - TL] 1 1 Tổng 12 2 1 1 20 Tỉ lệ % từng mức độ nhận thức 30% 40% 20% 10% 100% Tỉ lệ chung 70% 30% PHÒNG GD&ĐT LƯƠNG SƠN ĐỀ KIỂM TRA CUỐI KỲ I TRƯỜNG TH&THCS CƯ YÊN NĂM HỌC 2022-2023 MÔN: HÓA HỌC – LỚP 9 (Thời gian làm bài 60 phút không kể thời gian giao đề) I. Trắc nghiệm: (4 điểm) Câu 1: CaO không phản ứng được với chất nào sau đây: Nước B. dung dịch HCl C. O2 D. dung dịch H2SO4 Câu 2: Axit nào sau đây dễ bay hơi. A. HCl B. H2SO4 C. H3PO4 D. HNO3 Câu 3: Bazơ nào sau đây dễ bị nhiệt phân hủy? A. NaOH. B. Ba(OH)2. C. Cu(OH)2. D. KOH. Câu 4: Dung dịch Na2CO3 tác dụng được với chất nào sau đây: A. HCl. B. Na2SO4. C. Cu(OH)2. D. KNO3. Câu 5: Loại phân đạm nào sau đây giàu nitơ nhất: A. NH4NO3 B. (NH4)2SO4 C. Ca(NO3)2 D. CO(NH2)2 Câu 6: Trong các kim loại sau: Đồng, kẽm, sắt, bạc. Kim loại dẫn điện tốt nhất là: A. Đồng B. Kẽm C. Sắt D. Bạc Câu 7: Hiện tượng gì xảy ra khi cho thanh Đồng vào dung dịch HCl: A. Thanh Đồng tan dần có khí không màu thoát ra B. Thanh Đồng tan dần dung dịch chuyển màu xanh lam C. Không có hiện tượng gì. D. Xuất hiện kết tủa trắng Câu 8: Kim loại phản ứng với nước ở nhiệt độ thường là: A. Fe B. Cu C. K D. Ag Câu 9: Kim loại nhẹ, màu trắng bạc, được ứng dụng rộng rãi trong đời sống là A. Fe. B. Ag. C. Cu. D. Al. Câu 10: Quặng Boxit có chứa: A. SiO2 B. Al2O3 C. Fe2O3 D. Fe3O4 Câu 11: Có thể tách kim loại sắt ra khỏi hỗn hợp sắt lẫn đồng bằng cách: A. Hòa tan chúng trong HCl B. Đốt trong không khí C. Dùng nam châm hút D. Cho chúng vào dung dịch CuSO4 Câu 12: Muối Fe(III) được tạo thành khi cho Fe tác dụng với: A. Dung dịch CuSO4 B. Dung dịch H2SO4 C. Dung dịch HCl D. Cl2 II. Tự luận: (7 điểm) Câu 1 (2 điểm): Có bốn kim loại A, B, C, D đứng sau Mg trong dãy hoạt động hóa học. Biết rằng: + A và B không phản ứng với dung dịch HCl + C và D tác dụng với dung dịch HCl giải phóng khí hiđro. + A tác dụng với dung dịch muối của B và giải phóng B. + D tác dụng với dung dịch muối của C và giải phóng C. Hãy xác định thứ tự sắp xếp các kim loại trên theo chiều hoạt động hóa học giảm dần. Câu 2 (2 điểm): Hoàn thành chuỗi biến hóa sau: Al2O3 → Al→ AlCl3 → Al(OH)3 → Al2(SO4)3 Câu 3 (2 điểm): - Cuốc, xẻng, đinh sắt, bản lề sắt ở các cửa hàng kim khí, điện máy thường được bôi một lớp dầu mỡ để làm gì? Sắt, thép dùng trong xây dựng không bôi dầu, mỡ, vì sao? Câu 4 (1 điểm): Cho 10,8 gam Al tác dụng với dung dịch HCl dư, sau phản ứng thu được AlCl3 và H2. a. Viết phương trình hóa học. b. Tính thể tích khí H2(đktc). PHÒNG GD&ĐT LƯƠNG SƠN HƯỚNG DẪN CHẤM KIỂM TRA CUỐI KỲ I TRƯỜNG TH&THCS CƯ YÊN NĂM HỌC 2022-2023 MÔN: HOÁ HỌC – LỚP 9 I. TRẮC NGHIỆM (3,0 điểm): Mỗi phương án trả lời đúng 0,25 điểm Câu 1 2 3 4 5 6 7 8 9 10 11 12 Đáp án C A C A D D C C D B C D II. TỰ LUẬN (7,0 điểm) Câu Nội dung Điểm 1 (2,0 điểm) - A, B không phản ứng với HCl → A, B đứng sau H. - A tác dụng với dung dịch muối của B và giải phóng B → A hoạt động hóa học mạnh hơn B → A đứng trước B - C và D tác dụng với dung dịch HCl giải phóng khí hiđro → C, D đứng trước H. - D tác dụng với dung dịch muối của C và giải phóng C → D hoạt động hóa học mạnh hơn C → D đứng trước C → D, C, A, B 0,25 0,5 0,25 0,5 0,5 2 (2,0 điểm) Viết đúng mỗi phương trình được 0,5 điểm, cân bằng sai trừ 0,25 điểm. 2Al2O3 → 4Al + 3O2 2Al + 3Cl2 → 2AlCl3 AlCl3 + 3NaOH vừa đủ → Al(OH)3 + 6NaCl 2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 6H2O 0,5 0,5 0,5 0,5 3 (2,0 điểm) - Cuốc, xẻng, đinh sắt, bản lề sắt ở các cửa hàng thường được bôi dầu, mỡ để chống gỉ, cách làm này ngăn không cho các đồ dùng bằng sắt tiếp xúc với môi trường xung quanh. - Sắt, thép xây dựng không bôi dầu mỡ vì để xi măng bám dính. 1.0 1.0 4 (1,0 điểm) nAl=10,827=0,4 mol PTHH: 2Al + 6 HCl → 2AlCl3 + 3H2 (1) Theo (1) ta có: Số mol của H2 = 3/2 số mol của Al = 0,6 mol → VH2 = 0,6 . 22,4 = 13,44 lít 0,5 0,5 0,5 0,5 Chú ý: mọi cách trả lời hợp lí đều cho điểm tương ứng. Cư Yên, ngày 13 tháng 12 năm 2022 NGƯỜI RA ĐỀ Đào Văn Chung DUYỆT CỦA BAN GIÁM HIỆU DUYỆT CỦA TỔ CHUYÊN MÔN Ngày 19 tháng 12 năm 2022 Quách Thu Ngọc Ngày 19 tháng 12 năm 2022 Phạm Thị Vân Anh
Tài liệu đính kèm:
 de_kiem_tra_cuoi_hoc_ki_i_mon_hoa_hoc_lop_9_nam_hoc_2022_202.docx
de_kiem_tra_cuoi_hoc_ki_i_mon_hoa_hoc_lop_9_nam_hoc_2022_202.docx






