Ôn tập Kim loại kiềm và kiềm thổ
Bạn đang xem tài liệu "Ôn tập Kim loại kiềm và kiềm thổ", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
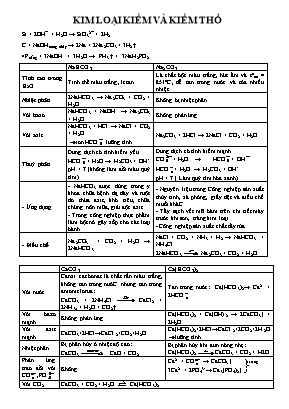
KIM LOẠI KIỀM VÀ KIỀM THỔ Si + 2OH¯ + H2O → SiO32¯ + 2H2 C + NaOHnóng chảy → 2Na + 2Na2CO3 + 3H2↑ 4Ptrắng + 3NaOH + 3H2O → PH3 ↑ + 3NaH2PO2 NaHCO3 Na2CO3 Tính tan trong H2O Tinh thể màu trắng , ít tan Là chất bột màu trắng, hút ẩm và tonc = 851oC, dễ tan trong nước và tỏa nhiều nhiệt. Nhiệt phân 2NaHCO3 → Na2CO3 + CO2 + H2O Không bị nhiệt phân Với bazơ NaHCO3 + NaOH → Na2CO3 + H2O Không phản ứng Với axit NaHCO3 + HCl → NaCl + CO2 + H2O ion HCO lưỡng tính. Na2CO3 + 2HCl → 2NaCl + CO2 + H2O Thuỷ phân Dung dịch có tính kiềm yếu HCO+ H2O → H2CO3 + OH- pH > 7 (không làm đổi màu quỳ tím) Dung dịch có tính kiềm mạnh CO+ H2O → HCO+ OH HCO+ H2O → H2CO3 + OH- pH > 7 ( Làm quỳ tím hóa xanh) - Ứng dụng - NaHCO3 được dùng trong y khoa chữa bệnh dạ dày và ruột do thừa axit, khó tiêu, chữa chứng nôn mữa, giải độc axit. - Trong công nghiệp thực phẩm làm bột nở gây xốp cho các loại bánh - Nguyên liệu trong Công nghiệp sản xuất thủy tinh, xà phòng, giấy dệt và điều chế muối kháC. - Tẩy sạch vết mỡ bám trên chi tiết máy trước khi sơn, tráng kim loại. - Công nghiệp sản xuất chất tẩy rửa - Điều chế Na2CO3 + CO2 + H2O → 2NaHCO3 NaCl + CO2 + NH3 + H2 → NaHCO3 + NH4Cl 2NaHCO3 Na2CO3 + CO2 + H2O CaCO3 Ca(HCO3)2 Với nước Canxi cacbonat là chất rắn màu trắng, không tan trong nướC. nhưng tan trong amoniclorua: CaCO3 + 2NH4Cl CaCl2 + 2NH3↑ + H2O + CO2↑ Tan trong nước: Ca(HCO3)2→ Ca2+ + 2HCO Với bazơ mạnh Không phản ứng Ca(HCO3)2 + Ca(OH)2 → 2CaCO3↓ + 2H2O Với axit mạnh CaCO3+2HCl→CaCl2+CO2+H2O Ca(HCO3)2+2HCl→CaCl2+2CO2+2H2O lưỡng tính Nhiệt phân Bị phân hủy ở nhiệt độ cao: CaCO3 CaO + CO2 Bị phân hủy khi đun nóng nhẹ: Ca(HCO3)2 CaCO3 + CO2 + H2O Phản ứng trao đổi với CO,PO Không trắng Ca2+ + CO → CaCO3↓ 3Ca2+ + 2PO43-→ Ca3(PO4)2↓ Với CO2 CaCO3 + CO2 + H2O Ca(HCO3)2 Chiều thuận (1): Giải thích sự xâm thực của nước mưa đối với đá vôi tạo hang động. Chiều nghịch (2): Giải thích sự tạo thành thạch nhũ trong hang động. CaSO4 1) Tính chất: - Là chất rắn màu trắng tan ít trong nước ( ở 25◦C tan 0,15g/100g H2O). - Tùy theo lượng nước kết tinh trong muối sunfat, ta có 3 loại: + CaSO4.2H2O : thạch cao sống trong tự nhiên, bền ở nhiệt độ thường. + CaSO4.H2O hoặc CaSO4.0,5H2O : thạch cao nung (hemihiđrat) CaSO4.2H2O → CaSO4.0,5H2O + 1,5H2O (125◦C) - Đun nóng 200◦C; thạch cao nung thành thạch cao khan. (CaSO4) CaSO4.0,5H2O → CaSO4 + 0,5H2O (200◦C) - CaSO4: không tan trong nước, không tác dụng với nước, chỉ phân hủy ở nhiệt độ rất cao. 2CaSO4 → 2CaO + 2SO2 + O2 ( 960◦C) 2) Ứng dụng: - Thạch cao nung có thể kết hợp với nước tạo thành thạch cao sống và khi đông cứng thì giãn nở thể tích, do vậy thạch cao rất ăn khuôn. Thạch cao nung thường được đúc tượng, đúc các mẫu chi tiết tinh vi dùng trang trí nội thất, làm phấn viết bảng, bó bột khi gãy xương - Thạch cao sống dùng để sản xuất xi măng. - Nhôm có nhiều ưu điểm nhưng vì nó khá mềm lại kém dai nên người ta thường chế tạo hợp kim nhôm với magie, đồng, silic để tăng độ bền. Sau đây là vài hợp kim và ứng dụng của nó: + Đura (95% Al, 4%Cu, 1%Mg, Mn, Si). Hợp kim đura nhẹ bằng ⅓ thép, cứng gần như thép. + Silumin (~90% Al, 10%Si): nhẹ, bền. + Almelec (98,5% Al. còn lại là Mg, Si, Fe) dùng làm dây cáp. + Hợp kim electron (10,5% Al, 83,3% Mg, còn lại là Zn, Mn), hợp kim này chỉ nặng bằng 65% Al lại bền hơn thép, chịu được sự thay đổi đột ngột nhiệt độ trong một giới hạn lớn nên được dùng làm vỏ tên lửa. - Nhôm được dùng chế tạo các thiết bị trao đổi nhiệt và dụng cụ nấu ăn gia đình, nhôm còn được dùng là khung cửa và trang trí nội thất. - Bột nhôm dùng để chế tạo hỗn hợp tecmit (hỗn hợp bột Al và Fe2O3), được dùng để hàn đường ray, Al2O3 + 9C Al4C3 + 6CO - Nhôm sunfat Al2SO4 là chất bột màu trắng, bị phân hủy nhiệt trên 770oC. Nhôm sunfat kết hợp với kim loại kiềm tạo thành loại muối gọi là phèn nhôm, mà quan trọng nhất là phèn chua K2SO4.Al2SO4.24H2O. - Phèn chua có dạng tinh thể, không màu, có vị hơi chua và chát. - Phèn chua được dùng nhiều trong công nghiệp giấy, nhuộm, thuộc da và đánh trong nước. Những công dụng này đều xuất phát từ sự thủy phân khá mạnh trong nước của muối nhôm tạo thành nhôm hiđroxit: KAl(SO4)2.12H2O→K+ +Al3+ +2SO42- +12H2O Al3+ +3H2O ↔Al(OH)3↓+ 3H+ - Khi nhuộm vải, hiđroxit đó được sợi vải hấp phụ và giữ chặt trên sợi sẽ kết hợp với phẩm nhuộm tạo thành màu bền, nên nó được gọi là chất cắn màu. - Tác dụng đánh trong nước cũng là do hiđroxit gây ra, nó kéo các chất bay lơ lửng trong nước cùng lắng xuống. - Trong công nghiệp giấy, nhôm sunfat và phèn nhôm được cho vào bột giấy cùng với muối ăn. Nhôm clorua được tạo nên do phản ứng trao đổi, bị thủy phân mạnh hơn nên cho hiđroxit. Hiđroxit này sẽ kết dính các phân tử xenlulozơ với nhau làm giấy không bị nhòe mực khi viết. I. TÁC DỤNG VỚI NaOH, KOH - Khi cho CO2 (hoặc SO2) tác dụng với OH– đều xảy ra 3 khả năng tạo muối. Ta thường Nếu: k 1: Chỉ tạo ion HCO3- 1< k < 2: Tạo 2 ion HCO3- và CO32- k 2: Chỉ tạo ion CO32-. * Chú ý: PTHH tạo muối: CO2 + 2OH- CO32- + H2O CO2 + OH- HCO3-. 1. Công thức tính lượng kết tủa xuất hiện khi hấp thụ hết một lượng CO2 vào dd Ca(OH)2 hoặc Ba(OH)2 : - Sử dụng công thức trên với điều kiện: , nghĩa là bazơ phản ứng hết. - Nếu bazơ dư thì 2. Công thức tính lượng kết tủa xuất hiện khi hấp thụ hết một lượng CO2 vào dd chứa hỗn hợp gồm NaOH và Ca(OH)2 hoặc Ba(OH)2 : - Trước hết tính rồi so sánh với hoặc để xem chất nào phản ứng hết. Lượng kết tủa tính theo số mol chất phản ứng hết. - Điều kiện là: 3. Công thức tính cần hấp thụ hết vào 1 dd Ca(OH)2 hoặc Ba(OH)2 để thu được 1 lượng kết tủa theo yêu cầu: Dạng này có 2 kết quả: - Có 2 dạng thường gặp: +) Phản ứng nhiệt phân 2MHCO3 M2CO3 + CO2 + H2O M(HCO3)2 MCO3 + CO2 + H2O MCO3 MO + CO2 (M: kim loại kiềm thổ). +) Phản ứng trao đổi: Với axit tạo khí CO2 Với một số muối tạo kết tủa. - Hay sử dụng: Định luật bảo toàn khối lượng và Định luật tăng giảm khối lượng. - Lưu ý: Khi cho từ từ dd HCl vào hỗn hợp muối cacbonat và hidrocacbonat, phản ứng xảy ra theo trình tự: Đầu tiên: H+ + CO32- HCO3- Sau đó: HCO3- + H+ CO2 + H2O - Gặp dạng: Muối cacbonat + ddHCl Muối clorua + CO2 + H2O. Tính nhanh khối lượng muối clorua bằng công thức: - Gặp dạng: Muối cacbonat + H2SO4 loãng Muối sunfat + CO2 + H2O. Tính nhanh khối lượng muối sufat bằng CT: - Nhận dạng: Cho bột nhôm phản ứng với các oxit kim loại. Tính hiệu suất phản ứng hoặc thành phần khối lượng sau phản ứng.... 2yAl + 3MxOy yAl2O3 + 3x M - Chú ý: +) Trường hợp phản ứng xảy ra hoàn toàn (H = 100%), nếu cho sản phẩm tác dụng với dung dịch kiềm có khí H2 thoát ra thì sản phẩm sau phản ứng có Al dư , M và Al2O3. +) Trường hợp phản ứng xảy ra không hoàn toàn (H<100%), khi đó sản phẩm có Al dư, Al2O3, MxOy dư, M. + Hay sử dụng Định luật bảo toàn khối lượng, định luật bảo toàn nguyên tố.... Dạng 1: Cho từ từ a mol OH- vào dd chứa b mol Al3+. Tìm khối lượng kết tủa. Al3+ + 3OH- Al(OH)3 Nếu OH- dư: Al(OH)3 + OH- AlO2- + H2O - Khi đó tùy theo tỉ lệ mol OH-; số mol Al3+ mà có kết tủa hoặc không có kết tủa hoặc vừa có kết tủa vừa có muối tan. * Để giải nhanh bài toán này ta có công thức tính nhanh: Dạng này phải có hai kết quả. Công thức: Dạng 2: Cho từ từ H+ vào dd chứa AlO2- (hay Al(OH)4-) tạo kết tủa. AlO2- + H+ + H2O Al(OH)3 Nếu H+ dư: Al(OH)3 + 3H+ Al3+ + 3H2O - Khi đó tùy theo tỉ lệ mol H+; số mol AlO2- mà có kết tủa hoặc không có kết tủa hoặc vừa có kết tủa vừa có muối tan. * Để giải nhanh bài toán này ta có công thức tính nhanh: Dạng này phải có hai kết quả. Công thức: Dạng 3: Công thức cần cho vào dd để xuất hiện 1 lượng kết tủa theo yêu cầu: Dạng này có 2 kết quả:
Tài liệu đính kèm:
 DE_LUYEN_TAP_MON_HOA_GIUP_ON_THI_THPT_QUOC_GIA_2016.doc
DE_LUYEN_TAP_MON_HOA_GIUP_ON_THI_THPT_QUOC_GIA_2016.doc





