Kiểm tra 1 tiết (tiết 53) Hóa 9
Bạn đang xem tài liệu "Kiểm tra 1 tiết (tiết 53) Hóa 9", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
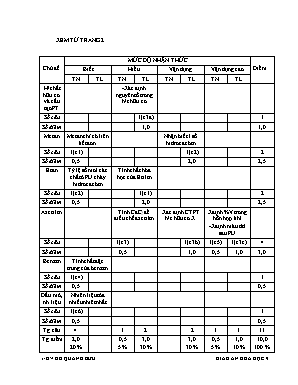
XEM TỪ TRANG 2 Chủ đề MỨC ĐỘ NHẬN THỨC Điểm Biết Hiểu Vận dụng Vận dụng cao TN TL TN TL TN TL TN TL H/chất hữu cơ và cấu tạo PT -Xác định nguyên tố trong h/c hữu cơ Số câu 1(c3a) 1 Số điểm 1,0 1,0 Metan Metan chỉ có liên kết đơni cXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXX Nhận biết 1 số hidrocacbon Số câu 1(c1) 1(c2) 2 Số điểm 0,5 2,0 2,5 Etan Tỷ lệ số mol các chất ở PU cháy hidrocacbon Tính chất hóa học của Etilen Số câu 1(c2) 1(c1) 2 Số điểm 0,5 2,0 2,5 Axetilen Tính CaC2 để điều chế axetilen Xac định CTPT h/c hữu cơ X Xđịnh %V trong hỗn hợp khí -Xđịnh màu dd sau PU Số câu 1(c3) 1(c3b) 1(c5) 1(c3c) 4 Số điểm 0,5 1,0 0,5 1,0 3,0 Benzen Tính chất đặc trưng của benzen Số câu 1(c4) 1 Số điểm 0,5 0,5 Dầu mỏ, nh liệu Nhiên liệu tỏa nhiều nhiêt nhất Số câu 1(c6) 1 Số điểm 0,5 0,5 Tg.câu 4 1 2 2 1 1 11 Tg.điểm 2,0 20 % 0,5 5 % 3,0 30 % 3,0 30 % 0,5 5 % 1,0 10 % 10,0 100 % Trường THCS Nguyễn Thị Định Năm học : 2015 - 2016 Tuần 27 Ngày soạn: 11.3.2016 Tiết 53 Ngày giảng : 14.3.2016 KIỂM TRA MỘT TIẾT TÍNH CHẤT CỦA HIDROCACBON I. Mục tiêu : 1– Kiến thức: Kiểm tra các kiến thức về các hợp chất thuộc HC: CH4, C2H4, C2H2. Phân biệt các hợp chất hữu cơ: CH4, C2H2, C2H4. 2– Kỹ năng: -Vận dụng kiến thức tính toán theo phương trình hóa học có liên quan đến các hợp chất hữu cơ. -Rèn luyện kĩ năng giải BT định tính hóa học . -Nâng cao hơn khả năng tinh toán HH (BT định lượng) 3-Thái độ : -Nghiêm túc trung thực, có tinh thần vượt khó -Độc lập, sang tạo giải quyết vấn đề mà đề KT ddawqtj ra. 4-Năng lực cần hướng tới : Biết được các dạng bài tập HH. Vận dung một cách linh hoạt kiến thức của HH, Toán họcđể giải được BT Từ đó yêu thích và học tốt các chương trình cao hơn. II. Chuẩn bị . +GV: -Hướng dẫn , ôn tập cho HS -Chuẩn bị ma trận,đề kiểm tra -Photo đề cho HS +HS : -Ôn tập và làm các BT GV giao cho -Giấy làm bài kiểm tra III-.Các hoạt động kiểm tra : Ổn định Kiểm tra sĩ số HS 3 Học sinh làm bài A-MA TRẬN Chủ đề MỨC ĐỘ NHẬN THỨC Điểm Biết Hiểu Vận dụng Vận dụng cao TN TL TN TL TN TL TN TL H/chất hữu cơ và cấu tạo PT -Xác định nguyên tố trong h/c hữu cơ Số câu 1(c3a) 1 Số điểm 1,0 1,0 Metan Metan chỉ có liên kết đơni cXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXX Nhận biết 1 số hidrocacbon Số câu 1(c1) 1(c2) 2 Số điểm 0,5 2,0 2,5 Etan Tỷ lệ số mol các chất ở PU cháy hidrocacbon Tính chất hóa học của Etilen Số câu 1(c2) 1(c1) 2 Số điểm 0,5 2,0 2,5 Axetilen Tính CaC2 để điều chế axetilen Xac định CTPT h/c hữu cơ X Xđịnh %V trong hỗn hợp khí -Xđịnh màu dd sau PU Số câu 1(c3) 1(c3b) 1(c5) 1(c3c) 4 Số điểm 0,5 1,0 0,5 1,0 3,0 Benzen Tính chất đặc trưng của benzen Số câu 1(c4) 1 Số điểm 0,5 0,5 Dầu mỏ, nh liệu Nhiên liệu tỏa nhiều nhiêt nhất Số câu 1(c6) 1 Số điểm 0,5 0,5 Tg.câu 4 1 2 2 1 1 11 Tg.điểm 2,0 20 % 0,5 5 % 3,0 30 % 3,0 30 % 0,5 5 % 1,0 10 % 10,0 100 % KIỂM TRA 1 TIẾT (T- 53) HÓA 9 B-ĐỀ . Họ và tên : ..Lớp . I-TRẮC NGHIỆM : Câu 1 : Hidrocacbon nào sau đây chỉ có liên kết đơn : A-Metan B-Etilen C-Axetilen D-Benzen Câu 2 :Phản ứng giữa Etilen và Oxi tỷ lệ số mol giữa CO2 và O2 Là : A-1:2 B-2:3 C-3:2 D-2:4 Câu 3 : Để điều chế được 5,6 lít khí Axetilen thì khối lượng CaC2 cần là : A-10 gam B- 12 gam C- 16 gam D- 18 gam Câu 4 : tính chất đặc trưng của Benzen là : A-Chất lỏng , cháy cho ngọn lửa sang. B-Chất khi,có mùi đặc trưng và tan trong nước. C-Chất lỏng,có mùi đặc trưng và không tan trong nước. D-Chất rắn, hòa tan tốt trong nước. Câu 5: Cho 5,6 lít hỗn hợp khí CH4 và C2H2 lọi qua bình đựng 200 ml ddBr2 2M thì tac dụng vừa hết. thành phần % về thể tích của metan và axetilen lần lượt là : A-25% và 75%, B-30% và 70% , C-80% và 20% , D-20% và 80% Câu 6 : Đốt cháy cùng một khối lượng , nhiên liệu nào sau đây tảo nhiều nhiệt nhất : A-Nhiên liệu khí , B-Nhiên liệu lỏng , C- Nhiên liệu rắn , D-Than gầy. .Cắt.. II-TỰ LUẬN : Câu 1 : Trình bày tính chất hóa học của Etilen ? (Viết phương trình hóa học minh họa) Câu 2 : Bằng phương pháp hóa học nêu cach nhận biết 3 bình mất nhãn đựng 3 chất khí :Metan, Khí cacbonic và khí Axetilen. Câu 3: Đốt cháy hoàn toàn 1,3 gam một hợp chất hữu cơ X thu được 4,4 gam Khí cacbonic và 0,9 gam nước . a-Trong X có những nguyên tố nào ? b-Xác định công thức phân tử của X.(Biết MX < 30) c-Nếu cho toàn bộ khối lượng X trên lội qua bình đựng 150 gam dd Br2 8% thì dd brom có bị mât màu hoàn toàn không ? C-ĐÁP ÁN CÂU NỘI DUNG ĐIỂM I-TRẮC NGHIỆM : 6 câu , mỗi câu 0,5 điểm => 0,5 . 6 = 1-A 2-B 3-C 4-C 5-D 6-A 3,0 II-TƯ LUẬN Câu 1 Trình bày đúng tính chất: +PU cháy với oxi – viết PTPU đúng +PUcộng với Brom-Viết PTPU đúng +PU trùng hợp-Viết PTPU đúng 0,5 0,75 0,75 Câu 2 +Cho 3 mẫu vào ddBr2, mẫu nào làm mất màu dd Br2 thì đó là Axetilen theo PTPU: C2H2 + 2Br2 = C2H2Br4 +Cho 2 mẫu còn lại vào dd Ca(OH)2 nếu mẫu nào làm cho dd này đục thì đó là mẫu khí CO2 theo PTPU : CO2 + Ca(OH)2 = CaCO3 + H2O +Mẫu còn lại là CH4 (Dán nhãn) 0,25 0,5 0,25 0,5 0,5 Câu 3 a-mC = (4,4. 12) : 44 = 1,2,gam mH = (0,9.2): 18 = 0,1 gam mC + mH = 1,2 + 0,1 = 1,3 gam = mX Vậy trong X chỉ có C và H và CTPT của X là CxHy b-Lập tỷ số : x : y = 1,2/12 : 0,1:1 = 0,1 : 0,1 = 1 : 1 Công thức nguyên của X là : (CH)n Nếu n = 1 -> CH (loại) Nếu n = 2 -> C2H2 => MC2H2 = 26 < 30 ( Thỏa đk) c-Từ 150 gam dd Br2 8 % => mBr2 = (C% . mdd) : 100 \= (8 . 150) : 100 = 12 gam =>nBr2 = m : M = 12 : 160 = 0,075 mol PTPU giữa Etilen và Brom : C2H2 + 2Br2 -> C2H2Br4 n C2H2 = m : M = 1,3 : 26 = 0,05 mol Theo PTPU thì nBr2 = 2n C2H2 = 2.0,05 = 0,1 mol > 0,075 mol ->Etilen dư , Brom hết vậy dd sau phản ứng không còn màu. 0,25 0,25 0,25 0,25 0,25 0,25 0,25 0,25 0,25 0,25 0,25 0,25 Tổng cộng : 10 điểm
Tài liệu đính kèm:
 GA_KIEM_TRA_TIET_53_HOA_9.docx
GA_KIEM_TRA_TIET_53_HOA_9.docx





