Kiểm tra 1 tiết môn Hóa học 10 cơ bản ( bài số 3)
Bạn đang xem tài liệu "Kiểm tra 1 tiết môn Hóa học 10 cơ bản ( bài số 3)", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
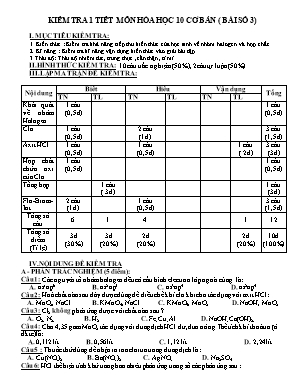
KIỂM TRA 1 TIẾT MÔN HÓA HỌC 10 CƠ BẢN ( BÀI SỐ 3) I. MỤC TIÊU KIỂM TRA: 1. Kiến thức : Kiểm tra khả năng tiếp thu kiến thức của học sinh về nhóm halogen và hợp chất 2. Kĩ năng : Kiểm tra kĩ năng vận dụng kiến thức vào giải bài tập 3.Thái độ: Thái độ nhiêm túc, trung thực ,cẩn thận , tỉ mỉ. II.HÌNH THỨC KIỂM TRA: 10 câu trắc nghiệm (50%), 2câu tự luận(50%) III.LẬP MA TRẬN ĐỀ KIỂM TRA: Nội dung Biết Hiểu Vận dụng Tổng TN TL TN TL TN TL Khái quát về nhóm Halogen 1 câu (0,5đ) 1 câu (0,5đ) Clo 1 câu (0,5đ) 2 câu (1đ) 3 câu (1,5đ) Axit HCl 1 câu (0,5đ) 1 câu (0,5đ) 1 câu ( 2đ) 3 câu (3đ) Hợp chất chứa oxi của Clo 1 câu (0,5đ) 1 câu (0,5đ) Tổng hợp 1 câu ( 3đ) 1 câu (3đ) Flo-Brom-Iot 2 câu (1đ) 1 câu (0,5đ) 3 câu (1,5đ) Tổng số câu 6 1 4 1 12 Tổng số điểm (Tỉ lệ) 3đ (30%) 3đ (20%) 2đ (20%) 2đ (20%) 10đ (100%) IV.NỘI DUNG ĐỀ KIỂM TRA A - PHẦN TRẮC NGHIỆM (5 điểm): Câu 1: Các nguyên tố nhóm halogen đều có cấu hình electron lớp ngoài cùng là: A. ns1np6 B. ns2np5 C. ns3np4 D. ns2np4 Câu 2: Hoá chất nào sau đây được dùng để điều chế khí clo khi cho tác dụng với axit HCl: A. MnO2, NaCl B. KMnO4, NaCl C. KMnO4, MnO2 D. NaOH, MnO2 Câu 3: Cl2 không phản ứng được với chất nào sau ? A. O2; N2. B. H2. C. Fe;Cu;Al. D. NaOH;Ca(OH)2. Câu 4: Cho 4,35 gam MnO2 tác dụng với dung dịch HCl dư, đun nóng.Thể tích khí thoát ra (ở đktc) là: A. 0,112 lít B. 0,56 lít C. 1,12 lít. D. 2,24 lít. Câu 5 : Thuốc thử dùng để nhận ra ion clorua trong dung dịch là : A. Cu(NO3)2 B. Ba(NO3)2 C. AgNO3 D. Na2SO4 Câu 6: HCl thể hiện tính khử trong bao nhiêu phản ứng trong số các phản ứng sau : (1) 4HCl + MnO2 ® MnCl2 + Cl2 + 2H2O (2) 2HCl + Zn ® ZnCl2 + H2 (3) 14HCl + K2Cr2O7 ® 2KCl + 2CrCl3 + 3Cl2 + 7H2O (4) 6HCl + 2Al ® 2AlCl3 + 3H2 A. 4 B. 1 C. 2 D. 3 Câu 7: Nước Gia- ven dùng để tẩy trắng vải ,sợi vì: A. có tính khử mạnh B. có khả năng hấp thụ màu C. có tính axit mạnh D. có tính oxi hóa mạnh Câu 8: Hiện tượng sẽ quan sát được khi thêm dần dần nước Clo vào dd KI có chứa sẵn một ít hồ tinh bột ? A. có hơi màu tím bay lên B. dd chuyển sang màu vàng C. dd có màu xanh đặc trưng D. không có hiện tượng gì Câu 9:Axit không thể đựng trong bình thủy tinh là: A. HNO3 B. HF. C. H2SO4. D. HCl. Câu 10: Dãy nào thể hiện tính oxi hoá các halogen giảm dần theo thứ tự từ phải sang trái? A. Br2 > Cl2 > F2 > I2 . B. F2 > Cl2 > Br2 >I2 . C. I2 > Br2 > Cl2 > F2 . D. Cl2 > F2 > Br2 > I2 . B – PHẦN TỰ LUẬN (5 điểm) Bài 1( 3đ): Viết PTHH thực hiện sơ đồ chuyển hóa sau (ghi đầy đủ điều kiện nếu có) MnO2 Cl2 HCl FeCl2 AgCl Ag Nước Gia – ven Bài 2( 2đ ): Hòa tan hoàn toàn 5,65 gam hỗn hợp Mg và Zn vào dung dịch HCl 2M thu được 3,36 lít khí (đktc). Tính phần trăm theo khối lượng mỗi kim loại trong hỗn hợp ban đầu. Tính thể tích dung dịch HCl 2M đã dùng. ( Cho Mg = 24, O = 16, H = 1, Cl = 35,5 , Mn = 55, Zn = 65 ) V- ĐÁP ÁN VÀ THANG ĐIỂM Phần I: Trăc nghiệm Câu 1 2 3 4 5 6 7 8 9 10 Đáp án B C A C C C D C B B Phần II : Tự luận Câu Nội dung Điểm 1 (Không cân băng PTPU và đkpư trừ 1 nửa số điểm) 1. 4HCl + MnO2 ® MnCl2 + Cl2 + 2H2O 2. Cl2 + H2 2HCl 3. 2HCl + Fe FeCl2 + H2 4. FeCl2 + 2AgNO3 Fe(NO3)2 + 2AgCl 5. 2AgCl 2Ag + Cl2 6. Cl2 + 2NaOH NaCl + NaClO +2H2O ( Nước Gia – ven) 0,5đ 0,5đ 0,5đ 0,5đ 0,5đ 0,5đ 2 a. Phương trình phản ứng : Mg + 2HCl MgCl2 + H2 (1) x 2x x (mol) Zn + 2HCl ZnCl2 + H2 (2) y 2y y (mol) Gọi x, y là số mol của Fe và Cu Số mol : nH2 Ta có hệ phương trình sau : Vậy phần trăm khối lượng của mỗi kim loại trong hợp kim là : %Zn = 100 – 42,47=57,53% b. Theo pt ( 1 , 2) Vậy thể tích dung dịch HCl 2M đã dùng là: 0,25đ 0,25đ 0,25đ 0,25đ 0,5đ 0,5đ
Tài liệu đính kèm:
 DE_KIEM_TRA_HOA_10BAI_SO_3.doc
DE_KIEM_TRA_HOA_10BAI_SO_3.doc





