Đề thi học kì 1 môn: Hóa học 9
Bạn đang xem tài liệu "Đề thi học kì 1 môn: Hóa học 9", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
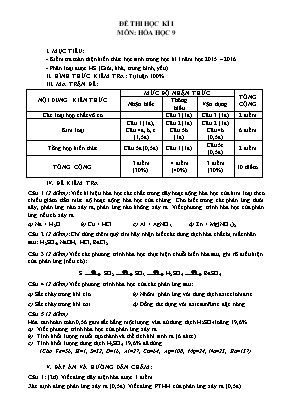
ĐỀ THI HỌC KÌ I MÔN: HÓA HỌC 9 I. MỤC TIÊU: - Kiểm tra toàn diện kiến thức học sinh trong học kì I năm học 2015 – 2016. - Phân loại được HS (Giỏi, khá, trung bình, yếu) II. HÌNH THỨC KIỂM TRA: Tự luận 100% III. MA TRẬN ĐỀ: NỘI DUNG KIẾN THỨC MỨC ĐỘ NHẬN THỨC TỔNG CỘNG Nhận biết Thông hiểu Vận dụng Các loại hợp chất vô cơ Câu 3 (1đ) Câu 3 (1đ) 2 điểm Kim loại Câu 1 (1đ), Câu 4a, b, c (1,5đ) Câu 2 (1đ) Câu 5b (1đ) Câu 2 (1đ) Câu 4b (0,5đ) 6 điểm Tổng hợp kiến thức Câu 5a (0,5đ) Câu 1 (1đ) Câu 5c (0,5đ) 2 điểm TỔNG CỘNG 3 điểm (30%) 4 điểm (40%) 3 điểm (30%) 10 điểm IV. ĐỀ KIỂM TRA Câu 1 (2 điểm): Viết kí hiệu hóa học các chất trong dãy hoạt động hóa học của kim loại theo chiều giảm dần mức độ hoạt động hóa học của chúng. Cho biết trong các phản ứng dưới đây, phản ứng nào xảy ra, phản ứng nào không xảy ra. Viết phương trình hóa học của phản ứng nếu có xảy ra. a) Na + H2O b) Cu + HCl c) Al + AgNO3 d) Zn + Mg(NO3)2. Câu 2 (2 điểm): Chỉ dùng thêm quỳ tím hãy nhận biết các dung dịch hóa chất bị mất nhãn sau: H2SO4, NaOH, HCl, BaCl2. Câu 3 (2 điểm) Viết các phương trình hóa học thực hiện chuỗi biến hóa sau, ghi rõ điều kiện của phản ứng (nếu có): S SO2 SO3 H2SO4 BaSO4. Câu 4 (2 điểm) Viết phương trình hóa học của các phản ứng sau: a) Sắt cháy trong khí clo b) Nhôm phản ứng với dung dịch axit clohiđric c) Sắt cháy trong khí oxi. d) Đồng tác dụng với axit sunfuric đặc nóng. Câu 5 (2 điểm) Hòa tan hoàn toàn 0,56 gam sắt bằng một lượng vừa đủ dung dịch H2SO4 loãng 19,6%. Viết phương trình hóa học của phản ứng xảy ra. Tính khối lượng muối tạo thành và thể tích khí sinh ra (ở đktc). Tính khối lượng dung dịch H2SO4 19,6% đã dùng. (Cho Fe=56, H=1, S=32, O=16, Al=27, Cu=64, Ag=108, Mg=24, Na=23, Ba=137) V. ĐÁP ÁN VÀ HƯỚNG DẪN CHẤM: Câu 1: (2đ) Viết đúng dãy điện hóa được 1 điểm Xác định đúng phản ứng xảy ra (0,5đ). Viết đúng PTHH của phản ứng xảy ra (0,5đ). Câu 2: (2đ) Trích các chất làm mẫu thử. (0,25đ) - Cho quỳ tím vào các mẫu thử. (0,25đ) - Nếu quỳ tím hóa đỏ là HCl hoặc H2SO4. (0,25đ) - Nếu quỳ tím hóa xanh là NaOH, không màu là BaCl2. (0,25đ) - Cho BaCl2 vừa tìm được vào hai mẫu thử HCl và H2SO4. (0,25đ) - Nếu mẫu nào có xuất hiện kết tủa trắng là H2SO4 còn lại là HCl. (0,25đ) BaCl2 + H2SO4 BaSO4¯ + 2HCl. (0,5đ) Câu 3: (2đ) (1) S + O2 SO2 (2) 2SO2 + O2 2SO3 (3) SO3 + H2O ® H2SO4 (4) BaCl2 + H2SO4 BaSO4¯ + 2HCl. Viết đúng mỗi phương trình hóa học được 0,5 điểm, thiếu cân bằng hoặc thiếu điều kiện của phản ứng bị trừ 0,25 điểm/phương trình Câu 4: (2đ) Viết đúng mỗi PTHH được 0,5 điểm: a) 2Fe + 3Cl2 2FeCl3. b) 2Al + 6HCl 2AlCl3 + 3H2. c) 3Fe + 2O2 Fe3O4. d) Cu + 2H2SO4 đặc CuSO4 + SO2 + 2H2O. Câu 5: (2đ) a) Fe + H2SO4 FeSO4 + H2. (0,5 điểm) b) ; (1 điểm) c) (0,5 điểm) Lại Sơn, ngày 12 tháng 12 năm 2015 Tổ chuyên môn duyệt GV ra đề Lê Thanh Tâm
Tài liệu đính kèm:
 Ma_tran_de_thi_Hoa_9_HK_1_nam_2015_2016.doc
Ma_tran_de_thi_Hoa_9_HK_1_nam_2015_2016.doc





