Đề kiểm tra tiết 10 Hóa 9
Bạn đang xem tài liệu "Đề kiểm tra tiết 10 Hóa 9", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
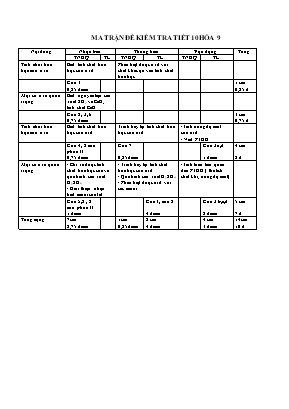
MA TRẬN ĐỀ KIỂM TRA TIẾT 10 HÓA 9 Nội dung Nhận biết Thông hiểu Vận dụng Tổng TNKQ TL TNKQ TL TNKQ TL Tính chất hóa học của oxit Biết tính chất hóa học của oxit Phân biệt được oxit với chất khác ựa vào tính chất hóa học Câu 1 0,25 điểm 1 câu 0,25 đ Một số oxit quan trọng Biết nguyên liệu sản xuất SO2 và CaO, tính chất CaO Câu 2, 3, 6 0,75 điểm 3 câu 0,75 đ Tính chất hóa học của axit Biết tính chất hóa học của axit Trình bày lại tính chất hóa học của axit -Tính nồng độ mol của axit - Viết PTHH Câu 4; 2 câu phần II 0,75 điểm Câu 7 0,25 điểm Câu 3a,d 1 điểm 4 câu 2 đ Một số axit quan trọng - Chỉ ra được tính chất hóa học của và quá trình sản xuất H2SO4 - Giới thiệu nhận biết muối sunfat - Trình bày lại tính chất hóa học của axit - Quá trình sản xuất H2SO4 - Phân biệt được axit với các muối -Tính toán liên quan đến PTHH ( thể tích chất khí, nồng độ mol) Câu 5,8 ; 2 câu phần II 1 điểm Câu 1, câu 2 4 điểm Câu 3 b,c,d 2 điểm 5 câu 7 đ Tổng cộng 7câu 2,75 điểm 1câu 0,25 điểm 2 câu 4 điểm 4 câu 3 điểm 14câu 10 đ Trường THCS Nguyễn Huệ KIỂM TRA: HÓA HỌC 9 Họ và tên: (Thời gian: 45 phút) Lớp : 9.. A. Trắc nghiệm ( 4 điểm ) I. Hãy khoanh tròn trước các phương án đúng ( 3 điểm ) 1. Dãy oxit nào sau đây vừa tác dụng với nước, vừa tác dụng với dung dịch bazơ a. CaO, CuO b. CO, Na2O c. CO2, SO2 d. P2O5, MgO 2. Lưu huỳnh đioxit được tạo thành từ cặp chất nào sau đây? a. Na2SO3 và H2O b. Na2SO3 và NaOH c. Na2SO4 và HCl d. Na2SO3 và H2SO4 3. Chất nào sau đây được dùng để sản xuất vôi sống a. CaCO3 b. NaCl c. K2CO3 d. Na2SO4 4. Phản ứng giữa dung dịch HCl và NaOH là phản ứng a. Hóa hợp b. Trung hòa c. Thế d. Phân hủy 5. Trong công nghiệp, sản xuất axit sunfuric qua mấy công đoạn a. 1 b. 2 c. 3 d. 4 6. Oxit vừa tan trong nước vừa hút ẩm là: a. SO2 b. CaO c. Fe2O3 d. Al2O3 7. Cặp chất nào sau đây tác dụng với nhau sinh ra chất khí cháy trong không khí với ngọn lửa màu xanh? a. Zn + HCl b. ZnO + HCl c. Zn(OH)2+ HCl d. NaOH + HCl 8. Cặp chất nào sau đây xảy ra phản ứng: a. Na2O + NaOH b. Cu + HCl c. P2O5 + H2SO4 loãng d. Cu + H2SO4 đặc, nóng II. Ghép các chữ số 1,2,3,4 chỉ thí nghiệm với các chữ cái a, b, c, d,e chỉ hiện tượng xảy ra cho phù hợp ( 1 điểm ) Thí nghiệm Hiện tượng Kết quả 1. Nhỏ dung dịch axit lên giấy quỳ tím 2. Cho kẽm viên( Zn) vào dung dịch HCl 3. Đun nóng hỗn hợp Cu với dung dịch H2SO4 đặc 4. Nhỏ dung dịch BaCl2 vào dung dịch Na2 SO4 a. Xuất hiện kết tủa trắng b. Xuất hiện màu xanh lam trong dung dịch c. Quỳ tím chuyển sang màu đỏ d. Quỳ tím chuyển sang màu xanh e. Có sủi bọt khí, phản ứng tỏa nhiệt 1. 2. 3. 4. B. Tự luận ( 7 điểm ) Câu 1. (2 điểm) Viết phương trình hóa học cho mỗi chuyển đổi hóa học sau và ghi rõ điều kiện phản ứng ( nếu có) CaO CaCO3 CaO Ca(OH)2 CaSO4 Câu 2. (2 điểm) Bằng phương pháp hóa học hãy phân biệt các dung dịch mất nhãn sau: Na2SO4, H2SO4, HCl. Viết PTHH minh họa. Câu 3. (3 điểm)Hòa tan hoàn toàn 6,5g kẽm bằng 100ml dung dịch HCl a. Viết phương trình hóa học b. Tính thể tích khí hiđro thoát ra (ở đktc) c. Tính nồng độ mol dung dịch HCl đã phản ứng d. Nếu dùng 50ml dung dịch HCl trên trung hòa Vml dung dịch Ca(OH)2 2M . Tính V? ( Zn = 65, H = 1, Cl = 35,5, Ca = 40, Na = 23, S = 32, O = 16 ) HƯỚNG DẪN CHẤM BÀI KIỂM TRA TIẾT 10 HÓA 9 A. Trắc nghiệm ( 3 điểm ) I. Mỗi phương án đúng được 0,25 điểm 1 2 3 4 5 6 7 8 c d a b c b a d II. Mỗi nối ghép đúng được 0,25 điểm c e b a B. Tự luận (7 điểm) Câu 1. (2điểm) Mỗi PTHH đúng được 0,5 điểm Câu 2. Trích mỗi mẫu một ít làm mẫu thử. 0,25đ - Nhỏ lần lượt các mẫu thử lên giấy quỳ tím nếu: + Mẫu làm cho quỳ tím hóa đỏ là dd HCl và dd H2SO4 0,25 đ + Không làm thay đổi màu của quỳ tím là dd Na2SO4 0,5đ - Cho 2 mẫu thử còn lại HCl và H2SO4 tác dụng với dung dịch BaCl2 nếu: 0,25 đ + Xuất hiện kết tủa trắng là H2SO4 0,25đ + Không có hiện tượng gì là HCl 0,25đ - PTHH: BaCl2 + H2SO4 BaSO4 + 2HCl 0,25 đ Câu 3. a/ nZn = 6,5 : 65 = 0,1 mol 0,25 đ Zn + 2HCl ZnCl2 + H2 0,5 đ 1mol 2mol 1mol 0,1mol 0,2mol 0,1mol 0,25đ b/ VH = n. 22,4 = 0,1 . 22,4 = 2,24 l 0,5đ c/ CM = n : V = 0,2 : 0,1 = 2 M 0,5đ d/ nHCl = 0,5. 2 = 0,1 mol 0,25 đ 2HCl + Ca(OH)2 CaCl2 + 2H2O 0,5 đ 2mol 1mol 0,1mol 0,05mol V = V Ca(OH)= 0,05: 2 = 0,025(lit) = 25 (ml) 0,25 đ
Tài liệu đính kèm:
 DKT_HOA_9_TIET_10_20152016.doc
DKT_HOA_9_TIET_10_20152016.doc





