Đề cương ôn tập giữa kì II môn Hóa học Lớp 10
Bạn đang xem tài liệu "Đề cương ôn tập giữa kì II môn Hóa học Lớp 10", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
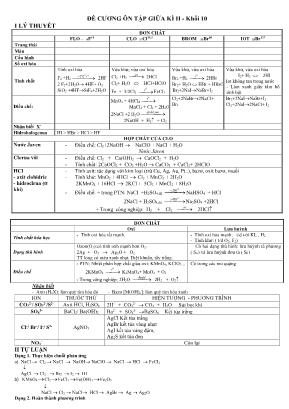
ĐỀ CƯƠNG ÔN TẬP GIỮA KÌ II - Khối 10 I LÝ THUYẾT ĐƠN CHẤT FLO - 9F19 CLO 17Cl35,5 BROM 35Br80 IOT 53Br127 Trang thái Màu Cấu hình Số oxi hóa Tính chất Tính oxi hóa F2 +H2 ⎯⎯ →⎯− C 0252 2HF 2 F2+2H2O→ 4HF+ O2 SiO2 +4HF→SiF4+2H2O Vừa khử, vừa oxi hóa Cl2 +H2 ⎯→⎯ as 2HCl Cl2+ H2O HCl+HClO Fe + 3/2Cl2 ⎯→⎯ 0t FeCl3 Vừa khử, vừa oxi hóa Br2 +H2 ⎯→⎯ 0t 2HBr Br2+ H2O HBr + HBrO Br2+2NaI→NaBr+I2 Vừa khử, vừa oxi hóa I2+ H2 2HI Iot không tan trong nước - Làm xanh giấy tẩm hồ tinh bột Điều chế: MnO2 + 4HClđ ⎯→⎯ 0t MnCl2 + Cl2 + 2H2O 2NaCl +2 H2O ⎯⎯ →⎯ mnđpdd, 2NaOH + H2 + Cl2 Cl2+2NaBr→2NaCl+ Br2 Br2+2NaI→NaBr+I2 Cl2+2NaI→2NaCl+ I2 Nhận biết X- Hidrohalogenua HI > HBr > HCl > HF HỢP CHẤT CỦA CLO Nước Javen - Điều chế: Cl2+2NaOH → NaClO + NaCl + H2O Nước Javen Clorua vôi - Điều chế: Cl2 + Ca(OH)2 → CaOCl2 + H2O - Tính chất: 2CaOCl2 + CO2 +H2O → CaCO3 + CaCl2+ 2HClO HCl - axit clohidric - hidroclrua (tt khí) - Tính axit: tác dụng với kim loại (trừ Cu, Ag, Au, Pt..), bazơ, oxit bazơ, muối - Tính khử: MnO2 + 4HCl → Cl2 + MnCl2 + 2H2O 2KMnO4 + 16HCl → 2KCl + 5Cl2 + MnCl2 + 8H2O - Điều chế: + trong PTN: NaCl +H2SO4,đđ ⎯⎯ →⎯ 0250 NaHSO4 + HCl 2NaCl + H2SO4,đđ ⎯⎯ →⎯ 0450 Na2SO4 +2HCl + Trong công nghiệp: H2 + Cl2 ⎯→⎯ as 2HCl ĐƠN CHẤT Oxi Lưu huỳnh Tính chất hóa học - Tính oxi hóa rất mạnh. - Tính oxi hóa mạnh: t/d với KL , H2 - Tính khử: ( t/d O2, F2) Dạng thù hình Ozon(O3):có tính oxh mạnh hơn O2. 2Ag + O3 → Ag2O + O2 TT lỏng có màu xanh nhạt. Diệt khuẩn, tẩy trắng. Có hai dạng thù hình: lưu huỳnh tà phương ( S) và lưu huỳnh đơn tà ( S) Điều chế - PTN: Nhiệt phân hợp chất giàu oxi: KMnO4, KClO3... 2KMnO4 ⎯→⎯ 0t K2MnO4+ MnO2 + O2 - Trong công nghiệp: 2H2O ⎯⎯→⎯ đpdd 2H2 + O2 Có trong các mỏ quặng Nhận biết - Axit (HnX): làm quỳ tím hóa đỏ - Bazơ [M(OH)n]: làm quỳ tím hóa xanh ION THUỐC THỬ HIỆN TƯỢNG - PHƯƠNG TRÌNH CO32-/ SO32-/S2- Axit HCl, H2SO4 2H+ + CO32- → CO2 + H2O Sủi bọt khí SO42- BaCl2/ Ba(OH)2 Ba2+ + SO42- →BaSO4 Kết tủa trắng Cl-/ Br-/ I-/ S2- AgNO3 AgCl Kết tủa trắng AgBr kết tủa vàng nhạt AgI kết tủa vàng đậm, Ag2S kết tủa đen NO3- Còn lại II TỰ LUẬN Dạng 1. Thực hiện chuỗi phản ứng a) NaCl → Cl2 → NaCl → NaOH→ NaClO → NaCl → HCl → FeCl2 AgCl → Cl2 → Br2 → I2 → HI b) KMnO4→Cl2→FeCl3→Fe(OH)3→Fe2O3 NaCl → Cl2 → NaCl→ HCl → AgBr → Ag → Ag2O Dạng 2. Hoàn thành phương trình a) Phương trình điều chế nước javen b) Phương trình điều chế clorua vôi c) Điện phân dung dịch có màng ngăn NaCl d) Thổi khí Clo vào nước e) Phương trình hòa tan SiO2 của HF f) F2 hòa tan trong nước g. Đốt cháy ancol etylic. H) ozon tác dụng với bạc Dạng 3. Nhận biết các dung dịch sau: a. Na2SO4, NaCl, NaNO3, K2CO3. b. HCl, H2SO4, NaCl, Na2SO4 c H2SO4, NaOH, NaCl, NaNO3. d) NaNO3, NaBr, NaI, Na2SO4. Dạng 5: Bài toán 1. Cho 26,1g MnO2 tác dụng hết với 200ml dung dịch axit clohidric đậm đặc. a. Tính thể tích khí thoát ra đktc. b. Tính nồng độ mol HCl. c. Lượng khí clo thu được có đủ để tác dụng hết với 1,12g sắt không? 2. Cho 30g hỗn hợp gồm Cu và Zn tác dụng hết với 200g dung dịch HCl thu được 5600ml khí (đktc). a. Tính khối lượng mỗi kim loại. b. Tính thành phần % khối lượng mỗi kim loại theo khối lượng. c. Tính nồng độ % HCl. 3. Cho 15g hỗn hợp gồm Fe, Ag tác dụng hết với dung dịch HCl 15,6% thu được 3360ml khí thu được (đktc). a. Tính khối lượng mỗi kim loại trong hỗn hợp. b. Tính thành phần % khối lượng mỗi kim loại. c. Tính khối lượng dung dịch HCl phản ứng. 4. Cho 8 g hỗn hợp Fe và Mg tác dụng vừa đủ với dung dịch HCl 2M thu được 4,48 lít khí đktc a. Tính % khối lượng mỗi kim loại trong hỗn hợp đầu ? b. Tính thể tích dd HCl 2M đã dùng ? 5. Cho a(g) hh Al và Fe tác dụng vừa đủ với 6,72lít khí Clo (đkc) thu được 29,6g hỗn hợp muối (B) a. Xác định khối lượng a(g) b. Cho hỗn hợp muối (B) tác dụng hoàn toàn với dung dịch AgNO3 thu được kết tủa (C) . Tính khối lượng kết tủa (C) và V dung dịch AgNO3 2M đã dùng ? 6. Cho 29,8g hỗn hợp gồm Fe,Zn tác dụng hết với 600ml dung dịch HCl thu dược 11,2 lít khí (đktc). a. Tính thành phần % theo khối lượng mỗi kim loại. b. Tính nồng độ mol HCl. 7. Hòa tan 26,6g hỗn hợp hai muối NaCl, KCl vào nước thành 500g dung dịch A. Cho dung dịch AgNO3 dư vào dung dịch A thì được 57,4g kết tủa. Tính C% của mỗi muối trong dung dịch A. III TRẮC NGHIỆM CÂU 1.Cấu hình e lớp ngoài cùng của các nguyên tử các nguyên tố halogen là: A. ns2np4. B. ns2np5. C. ns2np3. D. ns2np6. CÂU 2.Tìm phát biểu sai: A. Các halogen có màu sắc đậm dần từ flo đến iot. B. Liên kết trong phân tử các halogen đều là CHT có cực vì các halogen có độ âm điện khác nhau. C. Tính oxi hoá các halogen tăng dần từ iot đến flo. D.Atatin là nguyên tố phóng xạ CÂU 3.Liên kết trong các phân tử đơn chất halogen là gì? A. công hóa trị không cực. B. cộng hóa trị có cực. C. liên kết ion. D. liên kết cho nhận. CÂU 4.Chất nào có tính khử mạnh nhất? A. HI. B. HF. C. HBr. D. HCl. CÂU 5.Trong phản ứng clo với nước, clo là chất: A. oxi hóa. B. khử. C. vừa oxi hóa, vừa khử. D. không oxi hóa, khử CÂU 6. Thuốc thử của axit clohidric và muối clorua là A. ddAgNO3. B. dd Na2CO3. C. ddNaOH. D. phenolphthalein. CÂU 7. Những nguyên tố ở nhóm nào sau đây có cấu hình electron lớp n/cùng là ns2np5? A. Nhóm VA B. Nhóm IVA C. Nhóm II A D. Nhóm VII A CÂU 8. Trạng thái đúng của brom là: A. rắn B. lỏng. C. khí. D. tất cả sai. CÂU 9. Cho dãy axit: HF, HCl,HBr,HI. Theo chiều từ trái sang phải tính chất axit biến đổi như sau: A. giảm. B. tăng. C. vừa tăng, vừa giảm. D. Không tăng, không giảm. CÂU 10. Hãy lựa chọn phương pháp điều chế khí hidroclorua trong phòng thí nghiệm: A. Thủy phân AlCl3. B. Tổng hợp từ H2 và Cl2. C. clo tác dụng với H2O. D. NaCl tinh thể và H2SO4đặc. CÂU 11. Axit không thể đựng trong bình thủy tinh là: A. HNO3 B. HF. C. H2SO4. D. HCl. CÂU 12. Dung dịch AgNO3 không phản ứng với dung dịch nào sau đây? A. NaCl. B. NaBr. C. NaI. D. NaF. CÂU 13. Cho phản ứng: SO2 + Cl2 + 2H2O → 2HCl + H2SO4. Clo là chất: A oxi hóa. B. khử. C. vừa oxi hóa, vừa khử. D. Không oxi hóa khử CÂU 14. Đặc điểm nào không phải là đặc điểm chung của các halogen? A. Đều là chất khí ở điều kiện thường. B. Đều có tính oxi hóa mạnh. C. Tác dụng với hầu hết các kim loại và phi kim. D. Khử năng tác dụng với nước giảm dần tử F2 đến I2. CÂU 15. Trong phòng thí nghiệm clo được điều chế từ hóa chất nào sau đây? A. KClO3 B. NaCl. C. MnO2. D. HClO. CÂU 16. Theo chiều tăng điện tích hạt nhân thì khả năng oxi hóa của các halogen đơn chất: a. tăng dần. B. giảm dần. C. không thay đổi. D. vừa tăng, vừa giảm. CÂU 17. Các halogen có tính chất hóa học gần giống nhau vì có cùng: A. cấu hình e lớp ngoài cùng. B. tính oxi hóa mạnh. C. số e độc thân. D. số lớp e. CÂU 18. Khi mở vòi nước máy, nếu chú ý một chút sẽ phát hiện mùi lạ. Đó là do nước máy còn lưu giữ vết tích của thuốc sát trùng. Đó chính là clo và người ta giải thích khả năng diệt khuẩn là do: A. clo độc nên có tính sát trùng. B. clo có tính oxi hóa mạnh. C. clo tác dụng với nước tạo ra HClO chất này có tính oxi hóa mạnh. D. một nguyên nhân khác. CÂU 19. Axit clohidric có thể tham gia phản ứng oxi hóa khử với vai trò: A. chất khử. B. chất oxi hóa. C. môi trường. D. tất cả đều đúng. CÂU 20. Trong các kim loại sau đây, kim loại nào khi tác dụng với clo và axit clohidric cho cùng một loại muối? A. Zn. B. Fe. C. Cu. D. Ag CÂU 21. Phản ứng nào dướI đây được xem là phản ứng điều chế khí hidro clorua trong phòng thí nghiệm? A. H2 + Cl2 → 2HCl B. NaCl(r) + H2SO4 d → NaHSO4 + HCl C. Cl2 + H2O → HCl + HClO D. Cl2 + SO2 + H2O → HCl + H2SO4 CÂU 22. Phản ứng nào sau đây chứng tỏ HCl có tinh khử ? A. 4 HCl + MnO2 → MnCl2 + Cl2 + 2H2O B. 2HCl + Mg(OH)2 → MgCl2 + 2H2O C. 2HCl + CuO → CuCl2 + 2H2O D. A, B, C đều đúng CÂU 23.Trong các kim loại sau đây, kim loại nào khi tá dụng với clo và axit clohidric cho cùng một loại muối? A. Zn. B. Fe. C. Cu. D. Ag CÂU 24.Cho các dung dịch HCl , NaOH , NaCl , NaNO3 , Na2CO3 , AgNO3. Hãy chọn thuốc thử theo thứ tự thích hợp để dùng nhận biết các dung dịch trên A. quì tím , AgNO3, HCl C. HCl, quì tím , AgNO3 B. quì tím , HCl , BaCl2 , AgNO3 D. AgNO3, HCl , quì tím CÂU 25.Để nhận biết được cả 3 lọ khí riêng biệt CO2, SO2, O2 người ta có thể dùng: A. D.dịch nước brôm B. D.dịch Ca(OH)2 C. O2. D.d/dịch brôm và tàn đóm CÂU 26. O2 và O3 là 2 dạng thù hình vì: A. Tạo ra từ cùng một nguyên tố và cùng là đơn chất B. Vì O2 và O3 có công thức phân tử không giống nhau C. O2 và O3 có cấu tạo khác nhau. D. O3 có khối lượng phân tử lớn hơn O2. CÂU 27.Trong không khí, oxi chiếm : A. 23% B. 25% C. 20% D. 19% CÂU 28. Hỗn hợp nào sau đây có thể nổ khi có tia lửa điện A. O2 và H2 B. O2 và CO C. H2 và Cl2 D. 2V (H2) và 1V(O2) CÂU 29. Các nguyên tố nhóm VIA có cấu hình electron lớp ngoài cùng giống nhau có thể viết ở dạng tổng quát là A. ns2 np5. B. ns2 np4. C. ns2 np3. D. ns2 np6. CÂU 30.Oxi không phản ứng trực tiếp với A. Flo B. Crom C. Cacbon D. Lưu huỳnh CÂU 31. Cấu hình electron lớp ngoài cùng cuả nguyên tố oxi là A. 2s22p2 B. 2s22p3 C. 2s22p4 D. 2s22p5 CÂU 32. Chọn phát biểu đúng: A. Oxi là chất khí không màu, có mùi xốc, hơi nặng hơn không khí. B. Oxi là chất khí màu lục nhạt, không mùi, nhẹ hơn không khí. C. Oxi là chất khí màu lục nhạt, có mùi xốc, nhẹ hơn không khí. D. Oxi là chất khí không màu, không mùi, hơi nặng hơn không khí. CÂU 33. Oxi tác dụng được với dãy chất nào sau đây? A. CO; CO2; C2H5OH; C; Fe B. CO; S; C2H5OH; Cu; Fe C. CO; SO2; C2H5OH; S; Ag D. CO; P; C2H5OH; Au; Fe CÂU 34.Trong phòng thí nghiệm, oxi được điều chế bằng cách: A. Nhiệt phân KMnO4. B. Điện phân H2O. C. Cho MnO2 tác dụng với HCl đặc. D. Cho KMnO4 tác dụng với HCl đặc. CÂU 35. Dùng kim loại nào để nhận biết khí ozon và oxi? A. Cu B. Fe C. Al D. Ag CÂU 36.Chất nào sau đây tác dụng được với oxi? A. Au B. Ag C. NaCl D. C2H5OH CÂU 37.X2 là chất khí, không màu, không mùi, nặng hơn không khí. X là A. Nitơ. B. Oxi. C. Clo. D. Hiđro. CÂU 38. Phương trình hóa học nào sai? A. 2Cu + O2 ot⎯⎯→ 2CuO B. CH4 + 2O2 ot⎯⎯→ CO2 + 2H2O C. 4Ag + O2 ot⎯⎯→ 2AgO D. 4P + 5O2 ot⎯⎯→ 2P2O5 CÂU 39. Chất nào sau đây có liên kết cộng hóa trị không cực? A. H2S B. O2 C. Al2S3 D. SO2 CÂU 40. Thể tích khí O2 (ở đktc) thu được khi nhiệt phân hoàn toàn 4,74 gam KMnO4 là A. 0,672 lit B. 0,336 lit C. 0,448 lit D. 0,896 lit CÂU 41. Chỉ ra nội dung sai A. Nguyên tử oxi có độ âm điện lớn (chỉ sau flo). B. Oxi là phi kim hoạt động hoá học, có tính oxi hoá mạnh. C. Oxi tác dụng với hầu hết các kim loại (trừ Au, Pt ). D. Oxi tác dụng với hầu hết các phi kim (trừ N2, khí hiếm). CÂU 42. Oxi có thể thu được từ phản ứng nhiệt phân chất nào dưới đây? A. CaCO3. B. KMnO4. C. (NH4)2SO4. D. NaHCO3. CÂU 43.Trong các cách dưới đây, cách nào được dùng để điều chế oxi trong phòng thí nghiệm A. Điện phân H2O. B. Phân huỷ KClO3 với chất xúc tác là MnO2. C. Điện phân CuSO4. D. Chưng cất phân đoạn không khí lỏng. CÂU 44. Sản xuất oxi từ không khí bằng cách A. hoá lỏng không khí. B. chưng cất không khí. C. chưng cất phân đoạn không khí. D. chưng cất phân đoạn không khí lỏng. CÂU 45.Chất khí có màu xanh nhạt, có mùi đặc trưng là A. Cl2. B. O2. C. O3. D. N2. CÂU 46.Chỉ ra phương trình hoá học đúng, xảy ra ở nhiệt độ thường A. 4Ag + O2 → 2Ag2O. B. 6Ag + O3 → 3Ag2O. C. 2Ag + O3 → Ag2O + O2. D. 2Ag + 2O2 → Ag2O + O2. CÂU 47. Chỉ ra nội dung sai A. O3 là một dạng thù hình của O2. B. O3 tan nhiều trong nước hơn O2. C. O3 oxi hoá được tất cả các kim loại. D. Ở điều kiện thường, O2 không oxi hoá được Ag nhưng O3 oxi hoá được Ag. CÂU 48. Đơn chất O2 và O3 là thù hình của nhau vì: A. Có số lượng nguyên tử khác nhau B. Đều có tính oxi hóa C. Chúng đều là chất khí D. Đều được cấu tạo nên từ nguyên tố oxi CÂU 49. Trong các phản ứng dưới đây, phản ứng nào không dùng để điều chế oxi trong phòng thí nghiệm? A. 2KClO3 ot⎯⎯→ 2KCl + 3O2 B. 2KMnO4 ot⎯⎯→K2MnO4 + MnO2 + O2 C. 2H2O dien phan⎯⎯⎯⎯→ 2H2 + O2 D. 2Cu(NO3)2 ot⎯⎯→ 2CuO + 4NO2 + O2 CÂU 50.Phản ứng không xảy ra là A. 2Mg + O2 ot⎯⎯→ 2MgO B. C2H5OH + 3O2 ot⎯⎯→ 2CO2 + 3H2O C. 2Cl2 + 7O2 ot⎯⎯→ 2Cl2O7 D. 4P + 5O2 ot⎯⎯→ 2P2O5 CÂU 51. Cho phản ứng: FeS2 + O2 ot⎯⎯→ Fe2O3 + SO2. Tổng hệ số cân bằng (số nguyên, tối giản) của phản ứng trên là: A. 23. B. 22. C. 24. D. 25. CÂU 52. Khi nhiệt phân 24,5 gam KClO3 thu được V lít khí (đktc). Giá trị của V là: A. 4,48. B. 6,72. C. 2,24. D. 8,96. CÂU 53. Đốt 13 gam một kim loại hóa trị II trong khí oxi dư đến khối lượng không đổi thu được chất rắn X có khối lượng là 16,2 gam. Kim loại đó là: (Cho Zn=65, Fe=56, Cu=64, Ca=40) A. Fe. B. Cu. C. Zn. D. Ca. CÂU 54. Nhiệt phân hoàn toàn 3,634 gam KMnO4, thể tích O2 (đktc) thu được là (K=39, Mn=55, O=16) A. 224 ml B. 257,6 ml C. 515,2 ml D. 448 ml CÂU 55. Đốt cháy hoàn toàn m gam cacbon trong V lít khí oxi dư (đktc), thu được hỗn hợp khí X có tỉ khối đối với oxi là 1,25. Thành phần % theo thể tích của CO2 trong hỗn hợp X là: A. 6,67 % B. 66,67 % C. 33,33 % D. 3,33 % CÂU 56. Để oxi hóa hoàn toàn 3,24 gam một kim loại R thì cần vừa đủ 2,016 lít khí oxi (đktc). Kim loại R là: A. Fe. B. Cu. C. Zn. D. Al. CÂU 57. Khi tiến hành nhiệt phân 4,9 gam KClO3 thì khối lượng oxi thu được là: (Biết hiệu suất phản ứng là 75%) A. 1,92 gam. B. 1,44 gam. C. 1,28 gam. D. 0,96 gam. CÂU 58. Tiến hành phân hủy hết m gam ozon thì thu được 94,08 lít khí oxi (ở đktc). Giá trị của m là: A. 89,6. B. 134,4. C. 201,6. D. 302,4. CÂU 59. Biết rằng tỉ khối hơi của hỗn hợp X gồm oxi và ozon đối với khí metan là 2,4. Phần trăm theo thể tích của mỗi khí trong hỗn hợp X là: A. 60% và 40%. B. 70% và 30%. C. 50% và 50%. D. 45% và 55%. CÂU 60. Cho 6 gam một kim loại M có hóa trị không đổi tác dụng với oxi tạo ra 10 gam oxit. Công thức oxit của kim loại M đó là: A. Fe2O3. B. CaO. C. MgO. D. CuO. CÂU 61. Một hỗn hợp khí O2 và CO2 có tỷ khối so với hiđro là 19. Khối lượng mol trung bình của hỗn hợp khí trên và tỷ lệ % theo thể tích của O2 là: A. 40g và 40% B. 38g và 40% C. 38g và 50% D. 36g và 50% CÂU 62.Tỷ khối của hỗn hợp X gồm O2 v à O3 so với H2 là 18. Phần trăm thể tích của O2 và O3 có trong hỗn hợp X lần lượt là: A. 25 & 75 B. 20 & 70 C. 50&50 D. 75 & 25 CÂU 63. Cho hỗn hợp SO2 và O2 có tỉ khối với H2 là 24. % thể tích SO2 trong hỗn hợp là: A. 10% B. 50% C. 16% D. 61,5% CÂU 64. Hỗn hợp X gồm O2 và O3 có tỉ khối so với H2 bằng 20. Để đốt cháy hoàn toàn 1 mol CH4 cần bao nhiêu mol X? A. 1,2 mol. B. 1,5 mol. C. 1,6 mol. D. 1,75 mol. CÂU 65. Đốt cháy hoàn toàn mg cacbon trong Vl khí oxi dư (đktc), thu được hỗn hợp khí X có tỉ khối với oxi là 1,25. Thành phần % theo thể tích của CO2 có trong hỗn hợp là A. 6,67% B. 66,67% C. 33.33% D. 3,33%
Tài liệu đính kèm:
 de_cuong_on_tap_giua_ki_ii_mon_hoa_hoc_lop_10.pdf
de_cuong_on_tap_giua_ki_ii_mon_hoa_hoc_lop_10.pdf






