Đề kiểm tra học kì II môn: Hóa học khối 10
Bạn đang xem tài liệu "Đề kiểm tra học kì II môn: Hóa học khối 10", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
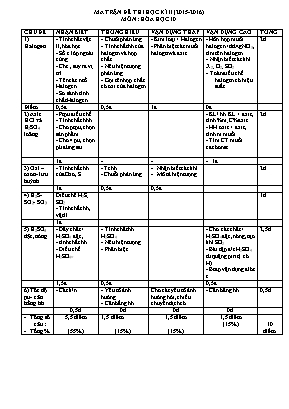
MA TRẬN ĐỀ THI HỌC KÌ II (2015-2016) MÔN : HÓA HỌC 10 CHỦ ĐỀ NHẬN BIẾT THÔNG HIỂU VẬN DỤNG THẤP VẬN DỤNG CAO TỔNG 1) Halogen - Tính chất vật lí, hóa học - Số e lớp ngoài cùng - Che , suy ra vị trí - Tên các ntố Halogen - So sánh tính chất Halogen - Chuỗi phản ứng - Tính chất hh của halogen và hợp chất - Nêu hiện tượng phản ứng - Gọi tên hợp chất có oxi của halogen - Kim loại + Halogen - Phân biệt các muối halogen và axit - Hỗn hợp muối halogen+dd AgNO3, tìm tên halogen - Nhận biết các khí X2; O2; SO2... - Toán điều chế halogen có hiệu suất 2đ Điểm 0,5đ 0,5đ 1đ 0đ 2) Axit HCl và H2SO4 loãng - Ptpu điều chế - Tính chất hhh - Cho ptpu, chọn sản phẩm - Cho 4 pư, chọn pứ đúng sai - KL/ hh KL + axit , tính %m; C%axit... - HH oxit + axit , tính m muối - Tìm CT muối cacbonat 2đ 1đ 1đ 3) Oxi – ozon- lưu huỳnh - Tính chất hh của Oxo, S Tchh Chuỗi phản ứng Nhận biết các khí.. Mô tả hiện tượng 2đ 1đ 0,5đ 0,5đ 4) H2S- SO2- SO3 Điều chế H2S; SO2 - Tính chất hh, vật lí 1đ 1đ 5) H2SO4 đặc, nóng - Dãy chất + H2SO4 đặc, - tính chất hh - Điều chế H2SO4= - Tính chất hh H2SO4 - Nêu hiện tượng - Phân biệt - Cho các chất + H2SO4đặc, nóng, tạo khí SO2 - Bài tập đ/c H2SO4 từ quặng pirit ( có H) - Btap vận dụng đlbt e 2,5đ 1,5đ 0,5đ 0,5đ 6) Tốc độ pu- cân bằng hh - Các k/n - Yếu tố ảnh hưởng - Cân bằng hh Cho các yếu tố ảnh hưởng hỏi, chiều chuyển dịch cb - Cân bằng hh 0,5đ 0,5đ 0đ 0đ 0đ Tổng số câu : Tồng % 5,5 điểm (55%) 1,5 điểm (15%) 1,5 điểm (15%) 1,5 điểm (15%) 10 điểm Sở Giáo Dục và Đào Tạo Đăklăk ĐỀ KIỂM TRA HỌC KÌ II NĂM HỌC 2015-2016 Trường PTTH Quang Trung Môn: Hóa Học Khối 10 ------***------ Thời gian 45 phút (Đề có 02 trang) Họ và Tên: Lớp: . Điểm Chữ kí GT: ( Học làm trực tiếp vào đề và không được sử dụng bảng hệ thống tuần hoàn) (1đ) Hãy gọi tên các chất có công thức hoá học sau: a. KClO3 ; c. Na2SO3 b. NaBr ; d. H2S (0,5đ) Cho đồ thị biểu diễn sự phụ thuộc của tốc độ phản ứng vào thời gian như sau: Theo đồ thị này, hay cho biết thời gian để phản ứng đạt đến trạng thái cân bằng? giải thích? ....................................................................... .................................................................................... ....................................................................... .................................................................................... ....................................................................... .................................................................................... (1đ) Cho các phản ứng: Na2SO3 + H2SO4 → Khí X FeS + HCl → Khí Y NaCl rắn + H2SO4đặc Khí Z KMnO4 Khí T Viết công thức hoá học các khí: X: .......................; Y ....................; Z ......................; T ......................... (2đ) Hoàn thành các phương trình hoá học sau: a. SO2 + Cl2 + H2O → b. HCl + MnO2 → c. Cu + H2SO4 đặc, nóng→ d. Fe3O4 + H2SO4 đặc, nóng → (2đ) Viết phương trình hoá học minh hoạ các ý sau: Lưu hùynh có tính oxi hoá: Hiđro sunfua có tính khử: Clo có tính oxi hoá mạnh hơn brom: Axit clohiđric có tính oxi hoá: (1đ) Cho 14,4g hỗn hợp X gồm Cu và CuO tác dụng vừa đủ với 500ml dung dịch HCl 0,4M. Viết phương trình phản ứng xảy ra và tính khối lượng của kim loại đồng trong hỗn hợp trên. ....................................................................... .................................................................................... ....................................................................... .................................................................................... ....................................................................... .................................................................................... ....................................................................... .................................................................................... ....................................................................... .................................................................................... ....................................................................... .................................................................................... ....................................................................... .................................................................................... ....................................................................... .................................................................................... ....................................................................... .................................................................................... ....................................................................... .................................................................................... (1đ) Nối hiện tượng mô tả ở cột B với thí nghiệm ở cột A sao cho phù hợp A. Thí nghiệm B. Hiện tượng Thổi mẫu khí thải nhiễm H2S vào dd Pb(NO3)2 1. Mất màu dần Nhỏ dung dịch NaBr vào dd AgNO3 2. Xuất hiện kết tủa vàng Nhỏ nước javen lên mẫu giấy màu 3. Xuất hiện kết tủa đen Nhỏ H2 SO4 đặc vào cốc chứa đường saccarozơ 4. Tinh thể màu trắng chuyển dần thành màu đen (1đ) Trong các phát biểu sau, phát biểu nào đúng (điền chữ Đ)? phát biểu nào sai (điền chữ S)? .. Khí SO2 được dùng để tẩy trắng giấy, bột giấy, chống nấm mốc cho lượng thực, thực phẩm, khử trùng nước sinh hoạt. .. Phần lớn iot được dùng để sản xuất dược phẩm. Dung dịch 5% iot trong etanol (cồn iot) dùng làm thuốc sát trùng vết thương. .. Trong công nghiệp, người ta sản xuất iot từ rong biển. Muối iot (muối NaCl trộn thêm KI hoặc KIO3) dùng để phòng bệnh bướu cổ do thiếu iot. .. Axit sunfuric là hoá chất hàng đầu được dùng trong nhiều ngành sản xuất như sản xuất phân bón, thuốc trừ sâu, chất giặc rửa tổng hợp, tơ sợi, chất dẻo, sơn màu, phẩm nhuộm, dược phẩm, chế biến dầu mỏ... (0,5đ) Tính kết quả của các bài toán sau và điền vào chỗ trống: a. Cho hỗn hợp gồm 0,3 mol FeS2 và 0,4 mol FeS vào dung dịch H2SO4 đặc nóng (dư) thu được dung dịch Fe2(SO4)3 và V lít khí SO2 (đktc). Giá trị của V là: ......................... d. Để sản xuất được 25,35 tấn oleum H2SO4.3SO3 phải dùng m tấn quặng pirit chứa 16% tạp chất trơ, hiệu suất của quá trình sản xuất là 80%. Giá trị của m bằng: ........................................... Sở Giáo Dục và Đào Tạo Đăklăk ĐÁP ÁN ĐỀ KIỂM TRA HỌC KÌ II NĂM HỌC 2015-2016 Trường PTTH Quang Trung Môn: Hóa Học Khối 10 ------***------ Thời gian 45 phút (Đề có 02 trang) Họ và Tên: Lớp: . Điểm Chữ kí GT: ( Học làm trực tiếp vào đề và không được sử dụng bảng hệ thống tuần hoàn) (1đ) Hãy gọi tên các chất có công thức hoá học sau: a. KClO3 : kaliclorat; (0,25đ) c. Na2SO3 : natrisunfit (0,25đ) b. NaBr : natribromua; (0,25đ) d. H2S : hiđosunfua (0,25đ) (0,5đ) Cho đồ thị biểu diễn sự phụ thuộc của tốc độ phản ứng vào thời gian như sau: Theo đồ thị này, hãy cho biết thời gian để phản ứng đạt đến trạng thái cân bằng? giải thích? Trả lời: - Sau 10 giây phản ứng đạt đến trạng thái cân bằng. (0,25đ) - Giải thích: + Lúc đầu , nồng độ chất tham gia lớn nên tốc độ phản ứng thuận lớn. + Sau một thời gian , nồng độ chất tham gia giảm nên tốc độ phản ứng thuận giảm ,đồng thời nồng độ chất sản phẩm tăng nên tốc độ phản ứng nghịch tăng. + Khi tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch thì phản ứng đạt đến trạng thái cân bằng. (0,25đ) (1đ) Cho các phản ứng: Na2SO3 + H2SO4 → Khí X FeS + HCl → Khí Y NaCl rắn + H2SO4đặc Khí Z KMnO4 Khí T Trả lời: X: SO2 ; Y : H2S ; Z : HCl; T : O2 (0,25đ) / chất (2đ) Hoàn thành các phương trình hoá học sau: a. SO2 + Cl2 + H2O → H2SO4 + 2HCl (0,5đ) b. 4HCl + MnO2 → MnCl2 + Cl2 + 2H2O (0,5đ) c. Cu + 2 H2SO4 đặc, nóng → CuSO4 + SO2 + 2H2O (0,5đ) d. 2Fe3O4 + 10 H2SO4 đặc, nóng → 3Fe2(SO4)3 + SO2 + 10 H2O (0,5đ) to (2đ) Viết phương trình hoá học minh hoạ các ý sau: a. Lưu hùynh có tính oxi hoá: Fe + S FeS (0,5đ) b. Hiđro sunfua có tính khử: 2H2S + O2 2S + 2H2O (0,5đ) Clo có tính oxi hoá mạnh hơn brom: Cl2 + 2NaBr 2NaCl + Br2 (0,5đ) Axit clohiđric có tính oxi hoá: 2HCl + Zn ZnCl2 + H2 (0,5đ) (1đ) Cho 14,4g hỗn hợp X gồm Cu và CuO tác dụng vừa đủ với 500ml dung dịch HCl 0,4M. Viết phương trình phản ứng xảy ra và tính khối lượng của kim loại đồng trong hỗn hợp trên. Bài giải: nHCl =0,2 CuO + 2 HCl → CuCl2 + H2O 0,5đ 0,1 0,2 MCuO = 8 (g) ; mCu = 6,4 (g) 0,5đ (1đ) Nối hiện tượng mô tả ở cột B với thí nghiệm ở cột A sao cho phù hợp A. Thí nghiệm B. Hiện tượng Thổi mẫu khí thải nhiễm H2S vào dd Pb(NO3)2 1. Mất màu dần Nhỏ dung dịch NaBr vào dd AgNO3 2. Xuất hiện kết tủa vàng Nhỏ nước javen lên mẫu giấy màu 3. Xuất hiện kết tủa đen Nhỏ H2 SO4 đặc vào cốc chứa đường saccarozơ 4. Tinh thể màu trắng chuyển dần thành màu đen Trả lời: e - 3 ; f - 2 ; g - 1 ; h - 4 . (0,25đ)/ ý đúng (1đ) Trong các phát biểu sau, phát biểu nào đúng (điền chữ Đ)? phát biểu nào sai (điền chữ S)? S Khí SO2 được dùng để tẩy trắng giấy, bột giấy, chống nấm mốc cho lượng thực, thực phẩm, khử trùng nước sinh hoạt. Đ Phần lớn iot được dùng để sản xuất dược phẩm. Dung dịch 5% iot trong etanol (cồn iot) dùng làm thuốc sát trùng vết thương. Đ Trong công nghiệp, người ta sản xuất iot từ rong biển. Muối iot (muối NaCl trộn thêm NaI) dùng để phòng bệnh bướu cổ do thiếu iot. Đ Axit sunfuric là hoá chất hàng đầu được dùng trong nhiều ngành sản xuất như sản xuất phân bón, thuốc trừ sâu, chất giặc rửa tổng hợp, tơ sợi, chất dẻo, sơn màu, phẩm nhuộm, dược phẩm, chế biến dầu mỏ... (0,25đ)/ ý đúng (0,5đ) Tính kết quả của các bài toán sau và điền vào chỗ trống: a. Cho hỗn hợp gồm 0,3 mol FeS2 và 0,4 mol FeS vào dung dịch H2SO4 đặc nóng (dư) thu được dung dịch Fe2(SO4)3 và V lít khí SO2 (đktc). Giá trị của V là: 90,72 lít (0,25đ) d. Để sản xuất được 25,35 tấn oleum H2SO4.3SO3 phải dùng m tấn quặng pirit chứa 16% tạp chất trơ, hiệu suất của quá trình sản xuất là 80%. Giá trị của m bằng: 26,79 tấn (0,25đ)
Tài liệu đính kèm:
 HK_2_lop_10.doc
HK_2_lop_10.doc





