Bảng nhận biết các chất hóa học
Bạn đang xem tài liệu "Bảng nhận biết các chất hóa học", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
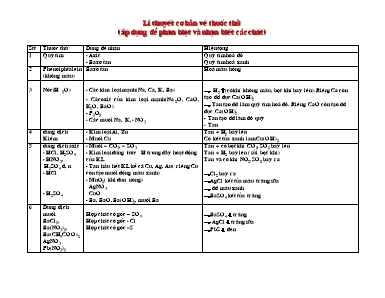
Lí thuyết cơ bản về thuốc thử (áp dụng để phân biệt và nhận biết các chất) Stt Thuốc thử Dùng để nhận Hiện tượng 1 Quỳ tím - Axit - Bazơ tan Quỳ tím hoá đỏ Quỳ tím hoá xanh 2 Phenolphtalein (không màu) Bazơ tan Hoá màu hồng 3 Nước(H2O) - Các kim loại mạnh(Na, Ca, K, Ba) - Cácoxit của kim loại mạnh(Na2O, CaO, K2O, BaO) - P2O5 - Các muối Na, K, - NO3 đ H2 ư(có khí không màu, bọt khí bay lên).Riêng Ca còn tạo dd đục Ca(OH)2 đ Tan tạo dd làm quỳ tím hoá đỏ. Riêng CaO còn tạo dd đục Ca(OH)2 - Tan tạo dd làm đỏ quỳ - Tan 4 dung dịch Kiềm - Kim loại Al, Zn - Muối Cu Tan + H2 bay lên Có kết tủa xanh lam Cu(OH)2 5 dung dịch axit - HCl, H2SO4 - HNO3, H2SO4 đ, n - HCl - H2SO4 - Muối = CO3, = SO3 - Kim loại đứng trước H trong dãy hoạt động của KL - Tan hầu hết KL kể cả Cu, Ag, Au( riêng Cu còn tạo muối đồng màu xanh) - MnO2( khi đun nóng) AgNO3 CuO - Ba, BaO, Ba(OH)2, muối Ba Tan + có bọt khí CO2, SO2 bay lên Tan + H2 bay lên ( sủi bọt khí) Tan và có khí NO2,SO2 bay ra đCl2 bay ra đAgCl kết tủa màu trắng sữa đ dd màu xanh đBaSO4 kết tủa trắng 6 Dung dịch muối BaCl2, Ba(NO3)2, Ba(CH3COO)2 AgNO3 Pb(NO3)2 Hợp chất có gốc = SO4 Hợp chất có gốc - Cl Hợp chất có gốc =S đBaSO4 ¯ trắng đ AgCl ¯ trắng sữa đPbS ¯ đen Nhận biết một số loại chất STT Chất cần nhận biết Thuốc thử Hiện tượng 1 Na, K( kim loại kiềm hoá trị 1) Ba(hoá trị 2) Ca(hoá trị 2) Al, Zn Phân biệt Al và Zn Các kim loại từ Mg đPb Kim loại Cu +H2O Đốt cháy quan sát màu ngọn lửa +H2O +H2O Đốt cháy quan sát màu ngọn lửa + dd NaOH +HNO3 đặc nguội + ddHCl + HNO3 đặc + AgNO3 đ tan + dd trong có khí H2 bay lên đ màu vàng(Na) đ màu tím (K) đ tan + dd trong có khí H2 bay lên đtan +dd đục + H2ư đ màu lục (Ba) đmàu đỏ(Ca) đ tan và có khí H2ư đAl không phản ứng còn Zn có phản ứng và có khí bay lên đ tan và có H2ư( riêng Pb có ¯ PbCl2 trắng) đ tan + dd màu xanh có khí bay lên đ tan có Ag trắng bám vào 2 S ( màu vàng) P( màu đỏ) C (màu đen) đốt cháy đốt cháy đốt cháy đ tạo SO2 mùi hắc đ tạo P2O5 tan trong H2O làm làm quỳ tím hoá đỏ đ CO2làm đục dd nước vôi trong 3 Na2O, BaO, K2O CaO P2O5 CuO +H2O +H2O Na2CO3 +H2O + dd HCl ( H2SO4 loaừng) đ dd trong suốt làm quỳ tím hoá xanh đ tan + dd đục Kết tủa CaCO3 đ dd làm quỳ tím hoá đỏ đ dd màu xanh 4 Các dung dịch muối a) Nhận gốc axit - Cl = SO4 = SO3 = CO3 º PO4 b) Kim loại trong muối Kim loại kiềm Mg(II) Fe(II) Fe(III) Al(III) Cu(II) Ca(II) Pb(II) Ba(II) + AgNO3 +dd BaCl2, Ba(NO3)2,Ba(OH)2 + dd HCl, H2SO4, HNO3 + dd HCl, H2SO4, HNO3 + AgNO3 đốt cháy và quan sát màu ngọn lửa + dd NaOH + dd NaOH + dd NaOH + dd NaOH (đến dư) + dd NaOH + dd Na2CO3 + H2SO4 Hợp chất có gốc SO4 đAgCl¯ trắng sữa đBaSO4 ¯ trắng đ SO2 mùi hắc đ CO2 làm đục dd Ca(OH)2 đ Ag3PO4¯ vàng đ màu vàng muốiNa đ màu tím muối K đ Mg(OH)2¯ trắng đ Fe(OH)2 ¯ trắng để lâu trong không khí tạo Fe(OH)3 ¯ nâu đỏ đFe(OH)3 ¯ nâu đỏ đ Al(OH)3 ¯ trắng khi dư NaOH sẽ tan dần đ Cu(OH)2 ¯ xanh đ CaCO3 ¯ trắng đ PbSO4¯ trắng đBaSO4 ¯ trắng Nhận biết các chất hữu cơ Chất cần nhận biết Thuốc thử Hiện tượng CH4 Khí Cl2 Khí clo mất màu, khi có giấy quỳ tím tẩm ướt đđỏ C2H4 Nước brom Mất màu vàng C2H2 Nước brom Mất màu vàng Rượu etylic Na Sủi bọt khí không màu Axit axetic Quỳ tím, CaCO3 Quỳ tím đđỏ, đá vôi tan và có bọt khí Glucozơ AgNO3 trong ddNH3 Có bạc sáng bám vào thành ống nghiệm Tinh bột Iot Hồ tinh bột có xuất hiện màu xanh Bảng nhận biết cỏc chất khớ Chất Đặc điểm Thuốc thử Hiện tượng và phương trỡnh phản ứng H2 Khụng màu, khụng mựi Bột CuO, Đốt chỏy Bột đen bột đỏ Giọt nước Cl2 Màu vàng lục. Mựi hắc, xốc Dung dịch KI pha hồ tinh bột Dung dịch AgNO3 Xuất hiện màu xanh I2 + tinh bột hiện màu xanh Kết tủa AgCl HCl (khớ) Khụng màu, mựi hắc, xốc NH3 Dung dịch AgNO3 Khúi trắng xuất hiện Cú kết tủa trắng H 2S (khớ) Khụng màu, mựi trứng thối Dung dịch Pb(NO3)2 Dung dịch Cd(NO3)2 Cú kết tủa đen Kết tủa CdS màu vàng SO2 Khụng màu, mựi hắc, xốc Dung dịch Br2 (màu nõu đỏ) Nước vụi trong Mất màu nõu đỏ SO3 Dung dịch BaCl2 Kết tủa BaSO4 CO2 Khụng màu, khụng mựi Dung dịch Ba(OH)2, Ca(OH)2 Que diờm đang chỏy Xuất hiện kết tủa trắng Que diờm tắt NH3 Khụng màu, mựi khai Quỳ tớm phenolphtalein Màu xanh Khụng màu màu đỏ NO2 Màu nõu đỏ, mựi hắc, xốc Dung dịch kiềm (NaOH) Mất màu NO Khụng màu Cho tiếp xỳc với khụng khớ Húa nõu O2 Khụng màu, khụng mựi Que đúm tắt Cu, nhiệt độ Que đúm bựng chỏy Bột đỏbột đen O3 Khụng màu, mựi hắc, xốc Dung dịch KI+ hồ tinh bột Xuất hiện màu xanh I2 + tinh bột hiện màu xanh H2O (hơi) Khụng màu, khụng mựi CuSO4 khan,khụng màu Húa xanh xanh CO Khụng màu, khụng mựi Bột CuO Bột đen bột đỏ N2 Khụng màu, khụng mựi Que diờm đang chỏy Que diờm tắt Nhận biết, tách, làm khô Bài 1: Chỉ có CO2 và H2O làm thế nào để nhận biết được các chất rắn sau NaCl, Na2CO3, CaCO3, BaSO4. Trình bày cách nhận biết. Viết phương trình phản ứng. Bài 2: Tách 4 kim loại Ag, Al, Cu, Mg dạng bột bằng phương pháp hoá học. Bài 3: Dùng thêm một thuốc thử hãy tìm cách nhận biết các dung dịch sau, mất nhãn NH4HSO4, Ba(OH)2, BaCl2, HCl, NaCl và H2SO4. Bài 4: Nhận biết các dung dịch sau NaHSO 4, KHCO3, Mg(HCO3)2, Na2SO3, Ba(HCO3)2, bằng cách đun nóng và cho tác dụng lẫn nhau. Bài 5: 1. Chỉ dùng dung dịch H2SO4l (không dùng hoá chất nào khác kể cả nước) nhận biết các kim loại sau Mg, Zn, Fe, Ba. 2. Hỗn hợp A gồm Na2CO3, MgCO3, BaCO3, FeCO3. Chỉ dùng HCl và các phương pháp cần thiết trình bày các điều chế từng kim loại. Bài 6: Hỗn hợp X gồm Al2O3, SiO3, SiO2. Trình bày phương pháp hoá học để tách riêng từng oxits ra khỏi hỗn hợp. Bài 7: Hỗn hợp A gồm các oxít Al2O3, K2O; CuO; Fe3O4. 1. Viết phương trình phản ứng phân tử và ion rút gọn với các dung dịch sau: a. NaOH b. HNO3 c. H2SO4đ,nóng 2. Tách riêng từng oxít Bài 8: Tách các chất sau ra khỏi hỗn hợp của chúng: AlCl3; FeCl3 và BaCl2. Bài 9: Có 3 lọ hoá chất không màu là NaCl, Na2CO3 và HCl. Nếu không dùng thêm hoá chất nào kể cả quỳ tím thì có thể nhận biết được không. Bài 10: Chỉ dùng quỳ tím hãy phân biệt các dung dịch sau: BaCl2; NH4Cl; (NH4)SO4; NaOH; Na2CO3 Bài 11: Ba cốc đựng 3 dung dịch mất nhãn gồm FeSO4; Fe2(SO4)3 và MgSO4. Hãy nhận biết. Bài 12: Có 3 lọ đựng hỗn hợp dạng bột (Al + Al2O3); (Fe + Fe2O3) và (FeO + Fe2O3). Bằng phương pháp hoá học nhận biết chúng. Bài 13: Tách các kim loại Fe, Al, Cu ra khỏi hỗn hợp của chúng. Bài 14: Hỗn hợp A gồm CuO, AlCl3, CuCl2 và Al2O3. Bằng phương pháp hoá học hãy tách riêng từng chất tinh khiết nguyên lượng. Bài 15: Chỉ dùng quỳ tím nhận biết 3 dung dịch cùng nồng độ sau HCl, H2SO4 và NaOH. Bài 16: Cho các ion sau: Na+, NH4+, Ba+, Ca2+, Fe3+, Al3+, K+, Mg2+, Cu2+, CO32+, PO42+, Cl-, NO3-, SO42-, Br-. Trình bày một phương án lựa chọn ghép tất cả các ion trên thành 3 dung dịch, mỗi dung dịch có cation và 2 anion. Trình bày phương pháp hoá học nhận biết 3 dung dịch này. Bài 17: Hãy tìm cách tách riêng các chất trong hỗn hợp gồm CaCl2, CaO, NaCl tinh khiến nguyên lượng. Bài 18: Có các lọ mất nhãn chứa dung dịch các chất AlCl3, ZnCl2, NaCl, MgCl2. Bằng phương pháp hoá học hãy nhận biết, viết phương trình phản ứng. Bài 19: Có một hỗn hợp rắn gồm 4 chất như bài 18. Bằng phương pháp hoá học hãy tách các chất ra, nguyên lượng tinh khiết. Bài 20: Làm thế nào để tách riêng 3 muốn NaCl, MgCl2 và NH4Cl. Bài 21: Hoà tan hỗn hợp gồm Fe2O3 và Al2O3 bằng dung dịch H2SO4. Hãy chứng minh trong dung dịch thu được có ion Fe2+, Fe3+ và Al3+. Bài 22: Nhận biết các dung dịch sau mất nhãn. NH4HCO3, (NH4)2CO3, NaHCO3, NH4NO3, BaCO3, Na2CO3, HCl, H2SO4 . Bài 23: Tách các muối sau ra khỏi hỗn hợp của chúng: Fe(NO3)3, Al(NO3)3, Cu(NO3)2 và Zn(NO3)2 tinh khiết nguyên lượng. Bài 24: Có 5 dung dịch 0,1M đựng trong 5 lọ mất nhãn Na2Co3; Ba(OH)2, NaOH, KHSO4, KCl. Nếu không dùng thêm thuốc thử có thể nhận biết được dung dịch nào. Bài 25: Tách các chất sau ra khỏi hỗn hợp của chúng nguyên lượng tinh khiết BaO, Al2O3, ZnO, CuO, Fe2O3. Bài 26: Có 4 dung dịch trong suốt. Mỗi dung dịch chứa một loại ion âm và một loại ion dương trong các ion sau: Ba2+, Mg2+, Pb2+, Na+, SO42-, Cl-, CO32-, NO3-. a. Tìm các dung dịch. b. Nhận biết từng dung dịch bằng phương pháp hoá học. Bài 27: Có 3 lọ đựng hỗn hợp bột Fe + FeO, Fe + Fe2O3; FeO + Fe2O3. Bằng phương pháp hoá học nhận biết các chất rắn trên. Bài 28: Lựa chọn một hoá chất thích hợp để phân biệt các dung dịch muối: NH4Cl, (NH4)2SO4, NaNO3, MgCl2, FeCl2, FeCl3, Al(NO3)3. Bài 29: Dùng phương pháp hoá học để tách Fe, Al, Cu ra khỏi hỗn hợp 3 kim loại trên. Viết các phương trình phản ứng. Bài 30: Hãy tìm cách tách Al2(SO4) ra khỏi hỗn hợp muối khan gồm Na2SO4, MgSO4, BaSO4, Al2(SO4)3 bằng các phương pháp hoá học? Có cách nào để tách các muối đó ra khỏi hỗn hợp của chúng, tinh khiết hay không? Nếu có hãy viết phương trình phản ứng và nêu cách tách. Bài 31: Chỉ được dùng kim loại hãy nhận biết các dung dịch sau đây HCl, HNO3đặc, AgNO3, KCl, KOH. Nếu chỉ dùng một kim loại có thể nhận biết được các dung dịch trên hay không. Bài 32: Có 6 lọ không nhãn đựng riêng biệt từng dung dịch sau: K2CO3, (NH4)2SO4, MgSO4, Al2(SO4)3, FeSO4 và Fe2(SO4 )3. Chỉ được dùng xút hãy nhận biết. Bài 33: Cho 3 bình mất nhãn là A gồm KHCO3 và K2CO3. B gồm KHCO3 và K2SO4. C gồm K2CO3 và K2SO4. Chỉ dùng BaCl2 và dung dịch HCl hãy nêu cách nhận biết mỗi dung dịch mất nhãn trên. Bài 34: Bằng phương pháp nào có thể nhận ra các chất rắn sau đây Na2CO3, MgCO3, BaCO3. Bài 35: Chỉ dùng một axit và một bazơ thường gặp hãy phân biệt 3 mẫu hợp kim sau: Cu - Ag; Cu - Al và Cu - Zn Bài 36: Không dùng thêm hoá chất khác, dựa vào tính chất hãy phân biệt các dung dịch K2SO4, Al(NO3)3, (NH4)2SO4, Ba(NO3) 2 và NaOH. Bài 37: Có một mẫu đồng bị lẫn Fe, Ag, S. Hãy tìm ra phương pháp (trừ phương pháp điện phân) để tách Cu tinh khiết từ mẫu đó. Bài 38: Một hỗn hợp gồm Al2O3, cuO, Fe2O3. Dùng phương pháp hoá học tách riêng từng chất. Bài 39: Hãy nêuphương pháp để nhận biết các dung dịch bị mất nhãn sau đây: AlCl3, NaCl, MgCl2, H2SO4. Được dùng thêm một trong các thuốc thử sau: quỳ tím, Cu, Zn, dung dịch NH3, HCl, NaOH, BaCl2, AgNO3, Pb(NO3)2. Bài 40: Bằng phương pháp hoá học hãy phân biệt 4 kim loại Al, Zn, Fe, Cu. Bài 41: Từ hỗn hợp hai kim loại hãy tách riêng để thu được từng kim loại nguyên chất. Bài 42: Có 4 chất bột màu trắng NaCl, AlCl3, MgCO3 và BaCO3. Chỉ được dùng H2O và các thiết bị cần thiết như lò nung, bình điện phân... Hãy tìm cách nhận biết từng chất trên. Bài 43: Chỉ có CO2 và H2O làm thế nào để nhận biết đ ợc các chất rắn sau NaCl, Na2CO3, CaCO3, BaSO4. Trình bày cách nhận biết. Viết ph ơng trình phản ứng. Bài 44: Tách 4 kim loại Ag, Al, Cu, Mg dạng bột bằng ph ơng pháp hoá học. Bài 45: Dùng thêm một thuốc thử hãy tìm cách nhận biết các dung dịch sau, mất nhãn NH4HSO4, Ba(OH)2, BaCl2, HCl, NaCl và H2SO4. Bài 46: Nhận biết các dung dịch sau NaHSO 4, KHCO3, Mg(HCO3)2, Na2SO3, Ba(HCO3)2, bằng cách đun nóng và cho tác dụng lẫn nhau. Bài 47: 1. Chỉ dùng dung dịch H2SO4l (không dùng hoá chất nào khác kể cả n ớc) nhận biết các kim loại sau Mg, Zn, Fe, Ba. 2. Hỗn hợp A gồm Na2CO3, MgCO3, BaCO3, FeCO3. Chỉ dùng HCl và các ph ơng pháp cần thiết trình bày các điều chế từng kim loại. Bài 48: Hỗn hợp X gồm Al2O3, SiO3, SiO2. Trình bày ph ơng pháp hoá học để tách riêng từng oxits ra khỏi hỗn hợp. Bài 49: Hỗn hợp A gồm các oxít Al2O3, KlO; CuO; F3 , O4. 1. Viết ph ơng trình phản ứng phân tử và ion rút gọn với các dung dịch sau: a. NaOH b. HNO3 c. H2SO4đ,nóng 2. Tách riêng từng oxít Bài 50: Tách các chất sau ra khỏi hỗn hợp của chúng: AlCl3; FeCl3 và BaCl2. Bài 51: Có 3 lọ hoá chất không màu là NaCl, Na2CO3 và HCl. Nếu không dùng thêm hoá chất nào kể cả quỳ tím thì có thể nhận biết đư ợc không. Bài 52: Chỉ dùng quỳ tím hãy phân biệt các dung dịch sau: BaCl2; NH4Cl; (NH4)SO4; NaOH; Na2CO3 Bài 53: Ba cốc đựng 3 dung dịch mất nhãn gồm FeSO4; Fe2(SO4)3 và MgSO4. Hãy nhận biết. Bài 55: Tách các kim loại Fe, Al, Cu ra khỏi hỗn hợp của chúng. Bài 56: Hỗn hợp A gồm CuO, AlCl3, CuCl2 và Al2O3. Bằng ph ơng pháp hoá học hãy tách riêng từng chất tinh khiết nguyên l ợng. Bài 57: Chỉ dùng quỳ tím nhận biết 3 dung dịch cùng nồng độ sau HCl, H2SO4 và NaOH. Bài 58: Cho các ion sau: Na+, NH4+, Ba+, Ca2+, Fe3+, Al3+, K+, Mg2+, Cu2+, CO32+, PO42+, Cl-, NO3-, SO42-, Br-. Trình bày một ph ơng án lựa chọn ghép tất cả các ion trên thành 3 dung dịch, mỗi dung dịch có cation và 2 anion. Trình bày ph ơng pháp hoá học nhận biết 3 dung dịch này. Bài 59: Hãy tìm cách tách riêng các chất trong hỗn hợp gồm CaCl2, CaO, NaCl tinh khiến nguyên l ợng. Bài 60: Có các lọ mất nhãn chứa dung dịch các chất AlCl3, ZnCl2, NaCl, MgCl2. Bằng ph ơng pháp hoá học hãy nhận biết, viết ph ơng trình phản ứng. Bài 61: Có một hỗn hợp rắn gồm 4 chất nh bài 18. Bằng ph ơng pháp hoá học hãy tách các chất ra, nguyên l ợng tinh khiết. Bài 62: Làm thế nào để tách riêng 3 muốn NaCl, MgCl2 và NH4Cl. Bài 63: Hoà tan hỗn hợp gồm Fe2O3 và Al2O3 bằng dung dịch H2SO4. Hãy chứng minh trong dung dịch thu đ ợc có ion Fe2+, Fe3+ và Al3+. Bài 64: Nhận biết các dung dịch sau mất nhãn. NH4HCO3, (NH4)2CO3, NaHCO3, NH4NO3, BaCO3, Na2CO3, HCl, H2SO4 . Bài 65: Tách các muối sau ra khỏi hỗn hợp của chúng: Fe(NO3)3, Al(NO3)3, Cu(NO3)2 và Zn(NO3)2 tinh khiết nguyên l ợng. Bài 66: Có 5 dung dịch 0,1M đựng trong 5 lọ mất nhãn Na2Co3; Ba(OH)2, NaOH, KHSO4, KCl. Nếu không dùng thêm thuốc thử có thể nhận biết đ ợc dung dịch nào. Bài 67: Tách các chất sau ra khỏi hỗn hợp của chúng nguyên l ợng tinh khiết BaO, Al2O3, ZnO, CuO, Fe2O3. Bài 68: Có 4 dung dịch trong suốt. Mỗi dung dịch chứa một loại ion âm và một loại ion d ơng trong các ion sau: Ba2+, Mg2+, Pb2+, Na+, SO42-, Cl-, CO32-, NO3-. a. Tìm các dung dịch. b. Nhận biết từng dung dịch bằng ph ơng pháp hoá học. Bài 70: Lựa chọn một hoá chất thích hợp để phân biệt các dung dịch muối: NH4Cl, (NH4)2SO4, NaNO3, MgCl2, FeCl2, FeCl3, Al(NO3)3. Bài 71: Dùng ph ơng pháp hoá học để tách Fe, Al, Cu ra khỏi hỗn hợp 3 kim loại trên. Viết các ph ơng trình phản ứng. Bài 72: Hãy tìm cách tách Al2(SO4) ra khỏi hỗn hợp muối khan gồm Na2SO4, MgSO4, BaSO4, Al2(SO4)3 bằng các ph ơng pháp hoá học? Có cách nào để tách các muối đó ra khỏi hỗn hợp của chúng, tinh khiết hay không? Nếu có hãy viết ph ơng trình phản ứng và nêu cách tách. Bài 73: Chỉ đ ợc dùng kim loại hãy nhận biết các dung dịch sau đây HCl, HNO3đặc, AgNO3, KCl, KOH. Nếu chỉ dùng một kim loại có thể nhận biết đ ợc các dung dịch trên hay không. Bài 74: Có 6 lọ không nhãn đựng riêng biệt từng dung dịch sau: K2CO3, (NH4)2SO4, MgSO4, Al2(SO4)3, FeSO4 và Fe2(SO4 )3. Chỉ đ ợc dùng xút hãy nhận biết. Bài 75: Cho 3 bình mất nhãn là A gồm KHCO3 và K2CO3. B gồm KHCO3 và K2SO4. C gồm K2CO3 và K2SO4. Chỉ dùng BaCl2 và dung dịch HCl hãy nêu cách nhận biết mỗi dung dịch mất nhãn trên. Bài 76: Bằng ph ơng pháp nào có thể nhận ra các chất rắn sau đây Na2CO3, MgCO3, BaCO3. Bài 77: Chỉ dùng một axit và một bazơ th ờng gặp hãy phân biệt 3 mẫu hợp kim sau: Cu - Ag; Cu - Al và Cu - Zn Bài 78: Không dùng thêm hoá chất khác, dựa vào tính chất hãy phân biệt các dung dịch K2SO4, Al(NO3)3, (NH4)2SO4, Ba(NO3) 2 và NaOH. Bài 79: Có một mẫu đồng bị lẫn Fe, Ag, S. Hãy tìm ra ph ơng pháp (trừ ph ơng pháp điện phân) để tách Cu tinh khiết từ mẫu đó. Bài 80: Một hỗn hợp gồm Al2O3, cuO, Fe2O3. Dùng ph ơng pháp hoá học tách riêng từng chất Bài 81: Hãy nêuph ơng pháp để nhận biết các dung dịch bị mất nhãn sau đây: AlCl3, NaCl, MgCl2, H2SO4. Đ ợc dùng thêm một trong các thuốc thử sau: quỳ tím, Cu, Zn, dung dịch NH3, HCl, NaOH, BaCl2, AgNO3, Pb(NO3)2. Bài 82: Bằng ph ơng pháp hoá học hãy phân biệt 4 kim loại Al, Zn, Fe, Cu. Bài 83: Từ hỗn hợp hai kim loại hãy tách riêng để thu đ ợc từng kim loại nguyên chất. Bài 84: Có 4 chất bột màu trắng NaCl, AlCl3, MgCO3 và BaCO3. Chỉ đ ợc dùng H2O và các thiết bị cần thiết nh lò nung, bình điện phân... Hãy tìm cách nhận biết từng chất trên. Bài 85: Chỉ dùng một hoá chất để phân biệt các dung dịch sau đây đựng trong 4 lọ riêng biệt CuSO4, Cr2(SO4)3, FeSO4, Fe2(SO4)3. Viết các ph ơng trình phản ứng. Bài 86: Cho dung dịch A chứa các ion Na+, NH4+, HCO3-, Co32- và SO42- (không kể ion H+ và H- của H2O). Chỉ dùng quỳ tím và các dung dịch HCl, Ba(OH)2 có thể nhận biết các ion nào trong dung dịch A. Bài 87: Quặng bôxit (Al2O3) dùng để sản xuất Al th ờng bị lẫn các tạp chất Fe2O3, SiO2. Làm thế nào để có Al2O3 gần nh nguyên chất. Bài 88: Có hỗn hợp 4 kim loại Al, Fe, cu, Ag. Nêu cách nhận biết sự có mặt đồng thời của 4 kim loại trong hỗn hợp. Bài 89: Có một hỗn hợp dạng bột gồm các kim loại: Al, Fe, Cu, Mg và Ag. Trình bày cách tách riêng từng kim loại ra khỏi hỗn hợp. Bài 90: Một hỗn hợp gồm KCl, MgCl2, BaCl2, AlCl3. Viết quá trình tách rồi điều chế thành các kim loại trên. Bài 91: Chỉ dùng HCl và H2O nhận biết các chất sau đây đựng riêng trong các dung dịch mất nhãn: Ag2O, BaO, MgO, MnCl2, Al2O3, FeO, Fe2O3 và CaCO3. Bài 92: Bằng ph ương pháp hoá học, hãy tách SO2 ra khỏi hỗn hợp gồm SO2, SO3 và O2. Bài 93: Trình bày ph ương pháp tách BaO, MgO, CuO l ợng các chất không đổi. Bài 94: Tìm cách nhận biết các ion trong dung dịch AlCl3 và FeCl3. Viết ph ơng trình phản ứng. Bài 95: Hoà tan hỗn hợp 3 chất rắn NaOH, NaHCO3 vào trong H2O đ ợc dung dịch A. Trình bày cách nhận biết từng ion có mặt trong dung dịch A. Bài 96: Dung dịch A chứa các ion Na+, SO42-, SO32-, CO32-, NO3-. Bằng những phản ứng hoá học nào có thể nhận biết từng loại anion có trong dungdịch.' Bài 97: Trình bày ph ương pháp hoá học để nhận biết các cặp chất sau (chỉ dùng một thuốc thử). a. MgCl2 và FeCl2 b. CO2 và SO2 Bài 98:Chỉ cú nước và khớ CO2 hóy nhận biết 5 chất bột màu trắng sau: NaCl; Na2CO3; Na2SO4; BaCO3; BaSO4 Bài 99: Cho 3 bỡnh:- Bỡnh 1 chứa Na2CO3 và K2SO4 - Bỡnh 2 chứa NaHCO3 và K2CO3 - Binh 3 chứa NaHCO3 và Na2SO4 Chỉ dựng HCl và dung dịch BaCl2 để phõn biệt ba bỡnh trờn. Bài 100: Tử hỗn hợp metanol , axeton và axitaxetic. Hóy tỏch ra axit axetic
Tài liệu đính kèm:
 Bang_nhan_biet_cac_chat_hoa_hoc.doc
Bang_nhan_biet_cac_chat_hoa_hoc.doc





