Tuyển tập Đề thi học sinh giỏi Hóa học lớp 9 - Đề 48
Bạn đang xem tài liệu "Tuyển tập Đề thi học sinh giỏi Hóa học lớp 9 - Đề 48", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
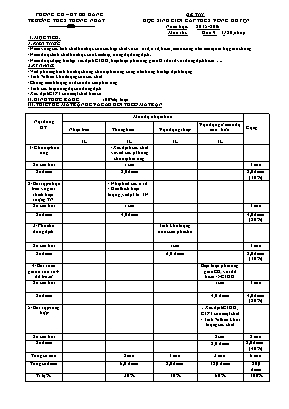
PHÒNG GD – ĐT BÙ ĐĂNG ĐỀ THI TRƯỜNG THCS THỐNG NHẤT HỌC SINH GIỎI CẤP THCS VÒNG HUYỆN ----------&------------ Năm học: 2015-2016 Môn thi: Hóa 9 (150 phút) I. MỤC TIÊU: 1. KIẾN THỨC: - Nắm vững các tính chất hóa học của các hợp chất vô cơ: axit, oxit, bazơ, muối cũng như mối quan hệ giữa chúng - Nắm được tính chất hóa học của kim loại, nồng độ dung dịch. - Nắm được dạng bài tập xác định CTHH, biện luận phản ứng giữa Oxit axit với dung dịch bazơ.. 2.KỸ NĂNG: - Viết phương trình hóa học trong chuỗi phản ứng cũng như trong bài tập định lượng - Tính % theo khối lượng của các chất - Chứng minh lượng axit còn dư sau phản ứng - Tính các loại nồng độ của dung dịch - Xác định CTPT của một chất hữu cơ II. HÌNH THỨC RA ĐỀ: 100% tự luận III. THIẾT KẾ MA TRẬN ĐỀ VÀ CÂU HỎI THEO MA TRẬN Nội dung KT Mức độ nhận thức Cộng Nhận biết Thông hiểu Vận dụng thấp Vận dụng ở mức độ cao hơn TL TL TL TL 1/ Chuỗi phản ứng - Xác định các chất và viết các pt trong chuỗi phản ứng Số câu hỏi 1 câu 1 câu Số điểm 2,0 điểm 2,0 điểm (10%) 2/ Bài tập nhận biết và giải thích hiện tượng TN - Nhận biết các oxit - Giải thích hiện tượng, viết pt từ TN Số câu hỏi 1 câu 1 câu Số điểm 4,0 điểm 4,0 điểm (20%) 3/ Pha chế dung dịch Tính khối lượng nước cần pha chế Số câu hỏi 1 câu 1 câu Số điểm 2,0 điểm 2,0 điểm (10%) 4/ Bài toán giữa oxit axit + dd bazơ Biện luận phản ứng giữa CO2 với dd bazơ -> CTHH Số câu hỏi 1 câu 1 câu Số điểm 4,0 điểm 4,0 điểm (20%) 5/ Bài tập tổng hợp - Xác định CTHH, CTPT của một chất - Tính % theo khối lượng các chất Số câu hỏi 2 câu 2 câu Số điểm 8,0 điểm 8,0 điểm (40%) Tổng số câu 2 câu 1 câu 3 câu 6 câu Tổng sốđiểm 6,0 điểm 2,0 điểm 12,0 điểm 20,0 điểm Tỉ lệ % 30% 10% 60% 100% PHÒNG GD – ĐT BÙ ĐĂNG ĐỀ THI TRƯỜNG THCS THỐNG NHẤT HỌC SINH GIỎI CẤP THCS VÒNG HUYỆN ----------&------------ Năm học: 2015-2016 Môn thi: Hóa 9 Thời gian: 150 phút Câu 1: (2,0đ) Xác định các chất X, Y, A, Z, K, L, M, D, P. Sau đó viết các phương trình trong sơ đồ phản ứng sau ? (Biết X là đơn chất phi kim). + A đpnc Y Z X + H2,to X + Fe, to K +A L to M +B Fe + H2O Y +D X +A Z + P + H2O Câu 2: (4,0đ) 1. Nêu hiện tượng và viết phương trình hóa học (nếu có) cho mỗi thí nghiệm sau: Cho kim loại Natri vào dung dịch CuCl2. Sục từ từ đến dư khí CO2 vào nước vôi trong. Nhỏ từ từ đến dư dung dịch KOH vào dung dịch AlCl3. Cho lá kim loại đồng vào dung dịch sắt (III) sunfat. 2. Có 4 chất bột màu trắng là: Na2O, P2O5, MgO, Al2O3 chỉ được dùng thêm nước và quỳ tím, hãy nêu cách để phân biệt từng chất ? Câu 3: (4,0đ) Hoà tan hoàn toàn 14,2 gam hỗn hợp C gồm MgCO3 và muối cacbonat của kim loại R vào axit HCl 7,3% vừa đủ, thu được dung dịch D và 3,36 lít khí CO2 (đktc). Nồng độ MgCl2 trong dung dịch D bằng 6,028%. Xác định kim loại R và thành phần phần % theo khối lượng của mỗi chất trong C. Cho dung dịch NaOH dư vào dung dịch D, lọc lấy kết tủa rồi nung ngoài không khí đến khi phản ứng hoàn toàn. Tính số gam chất rắn còn lại sau khi nung ? Câu 4: (2,0đ) Cho thêm H2O vào 180 g dung dịch 18% thu được dung dịch mới có nồng độ 15%. Tìm lượng nước đã thêm vào ? Câu 5: (4,0đ) Cho luồng khí CO đi qua một ống sứ chứa m gam bột ôxit sắt (Fe xOy) nung nóng cho đến khi phản ứng xảy ra hoàn toàn . Dẫn toàn bộ khí sinh ra đi thật chậm vào 1 lít dung dịch Ba(OH)2 0,1M thu được 9,85 gam kết tủa . Mặt khác khi hòa tan toàn bộ lượng kim loại sắt tạo thành ở trên bằng V lít dung dịch HCl 2M ( có dư ) thì thu được một dung dịch sau khi cô cạn thu được 12,7 gam muối khan . Xác định công thức của ôxit sắt ? Tính m ? Tính V ? Biết rằng dung dịch HCl là đã dùng dư 20% so với lượng cần thiết. Câu 6: (4,0đ) Hỗn hợp A gồm 3 hidrocacbon : CnH2n+2, CpH2p, CmH2m-2. Đốt cháy hoàn toàn 2,688 lít khí hỗn hợp A (đktc), sau đó cho toàn bộ sản phẩm qua bình 1 chứa H2SO4 đặc và bình 2 chứa KOH đặc, thì thấy khối lượng bình 1 tăng 5,04 g và bình 2 tăng 14,08 g a/ Biết trong A thể tích của CmH2m-2 gấp 3 lần thể tích của CnH2n+2 . Tính % theo thể tích của các chất trong A ? b/ Hãy xác định CTPT của 3 hidrocacbon trên, nếu biết trong hỗn hợp A có 2 hidrocacbon có số nguyên tử C bằng nhau và bằng ½ số nguyên tử của Hidrocacbon còn lại ? --------------------------------------Hết ------------------------------------ HƯỚNG DẪN CHẤM MÔN HÓA 9 Câu Nội dung Điểm 1 X: Cl2 , Y: HCl, Z: NaCl, A: NaOH, K: FeCl3, L: Fe(OH)3, M: Fe2O3, B: CO, D: MnO2, P: NaClO PT: Cl2 + H2 2HCl HCl + NaOH -> NaCl + H2O 2NaCl đpnc 2Na + Cl2 2Fe + 3Cl2 2FeCl3 FeCl3 + 3NaOH -> Fe(OH)3 + 3NaCl 2Fe(OH)3 Fe2O3 + 3H2O Fe2O3 + 3CO 2Fe + 3CO2 Cl2 + H2O -> HCl + HClO 4HCl + MnO2 MnCl2 + Cl2 + 2H2O Cl2 + 2NaOH -> NaCl + NaClO + H2O 2,0 Viết đúng mỗi pt được 0,2 đ 2 2.1 a. Kim loại Natri tan dần, có khí không màu bay ra, xuất hiện chất kết tủa màu xanh. 2Na + 2H2O → 2NaOH + H2↑ 2NaOH + CuCl2 → 2NaCl + Cu(OH)2↓ b.Ban đầu thấy nước vôi trong bị vẩn đục, sau đó dung dịch lại trở nên trong suốt. Ca(OH)2 + CO2 → CaCO3↓ + H2O CaCO3 + CO2 + H2O → Ca(HCO3)2 (tan) c. Ban đầu xuất hiện kết tủa trắng keo, sau đó kết tủa bị tan ra. 3KOH + AlCl3 → 3KCl + Al(OH)3 ↓ KOH + Al(OH)3 → KAlO2 + 2H2O d. Dung dịch sắt (III) sunfat màu vàng nâu nhạt màu dần, rồi chuyển dần thành dd màu xanh nhạt. Cu + Fe2(SO4)3 → 2FeSO4 + CuSO4 2.2 - Hòa tan 4 chất bột màu trắng vào nước + Chất nào tan tạo thành dung dịch là Na2O và P2O5 + Chất nào không tan là MgO và Al2O3 - Nhúng giấy quì tím vào 2 dd thu được + Nếu quì tím hóa xanh -> chất bột ban đầu đem hòa tan là Na2O + Nếu quì tím hóa đỏ -> chất bột ban đầu đem hòa tan là P2O5 - Cho dung dịch làm quì tím hóa xanh thu được ở trên vào 2 chất rắn không tan ở trên + Chất nào tan tạo thành dung dịch là Al2O3 + Chất nào không tan là MgO Các pt hóa học xảy ra: Na2O + H2O -> 2NaOH ; P2O5 + 3 H2O -> 2H3PO4 Al2O3 + 2NaOH -> 2NaAlO2 + H2O 2,0 0,5 0,5 0,5 0,5 2,0 0,5 0,5 0,5 0,5 3 a/ Gọi n là hóa trị của kim loại R MgCO3 + 2HCl -> MgCl2 + CO2 + H2O 0,1mol 0,1mol 0,1mol R2(CO3)n + 2nHCl -> 2RCln + nCO2 + nH2O 0,05/n mol 0,1/n mol 0,05mol nCO2 = 3,36 : 22,4 = 0,15 mol Ta thấy nHCl = 2nCO2 = 0,15 x 2 = 0,3 mol => mHCl = 0,3 x 36,5 = 10,95 g => mddHCl = (10,95 x100%) : 7,3 = 150 g Áp dụng ĐLBTKL ta có : mddD = (14,2 + 150) – mCO2 = 164,2 – (0,15 x 44) = 157,6 g => mMgCl2 = (157,6 x 6,028) : 100 = 9,5 g -> nMgCl2 = 9,5 : 95 = 0,1 mol -> mMgCO3 = 0,1 x 84 = 8,4 g => mR2(CO3)n = 14,2 – 8,4 = 5,8 g => M R2(CO3)n = 5,8 : 0,05/n = 116n ó 2R + 60 n = 116n R = 28 n n 1 2 3 MR 26 56 84 (loại) (Fe) (loại) Vậy R là kim loại Fe % MgCO3 = 59,2% ; % FeCO3 = 40,8 % b/ MgCl2 + 2NaOH -> Mg(OH)2 + 2NaCl 0,1mol 0,1 mol FeCl2 + 2NaOH -> Fe(OH)2 + 2NaCl 0,05mol 0,05mol Mg(OH)2 -t0> MgO + H2O 0,1mol 0,1mol 4 Fe(OH)2 + O2 + 2H2O -t0> 4Fe(OH)3 0,05mol 0,05mol 2Fe(OH)3 -t0> Fe2O3 + 3H2O 0,05mol 0,025mol -> mMgO = 0,1 x 40 = 4 gam => mFe2O3 = 0,025 x 160 = 4 gam 4,0 0,5 0,5 0,5 0,5 0,25 0,25 0,5 0,5 0,5 4 Gọi x là khối lượng nước cần tìm mct(bđ) = (180 .18) : 100 = 32,4 gam Do quá trình pha loãng nên khối lượng chất tan không thay đổi. -> mdd (sau pha loãng) = (180 + x) gam -> 15% = (32,4 . 100% ) : (180 + x) -> x = 36 . Vậy khối lượng nước cần thêm vào là 36 gam 2,0 0,5 0,5 1,0 5 Xác định công thức oxit sắt (Fe xOy) có a (mol) FexOy + yCO xFe + yCO2 (1) 1 (mol ) x (mol ) y (mol ) a (mol ) ax (mol) ay (mol ) Ba(OH)2 + CO2 → BaCO3 + H2O (2) 0,05(mol) 0,05(mol) 0,05(mol) Ba(OH)2 + 2 CO2 → Ba(HCO3)2 (3) 0,05(mol) 0,1(mol) Hoặc : BaCO3 + CO2 + H2O -> Ba(HCO3)2 Fe + 2HCl → FeCl2 + H2 (4) ax(mol) ax(mol) Ta có : nBaCO3 = 9,85 : 197 = 0,05 (mol) nFeCl2 = 12,7 : 127 = 0,1 mol nBa(OH)2 = 0,1 x 1 = 0,1 mol + Trường hợp 1: Ba(OH)2 dư -> tạo muối BaCO3 -> nFe = nFeCl2 = 0,1 mol và nCO2 = nBaCO3 = 0,05 mol -> ay = 0,05 và ax = 0,1 (mol) → x/y = 2 ( vô lý) + Trường hợp 2: CO2 dư -> tạo muối BaCO3 và muối Ba(HCO3)2 Từ (2) và (3) → ∑ nCO2 = 0,15 (mol) Ta có hệ : ax = 0,1 ay = 0,15 → x = 2 và y = 3 . Vậy công thức là : Fe2O3 b. Tính m : Fe2O3 + 3CO 2Fe + 3CO2 (5) 0,05 0,15 Từ (5) → nFe2O3 = 1 /3 nCO2 = 0,15/ 3 = 0.05 (mol) m = m Fe2O3 = n.M = 0,05 x 160 = 8 (gam) c. Tính V : Từ (4) → nHCl = ax.2 = 0,2 (mol) Vì HCl dư 20% so với lượng cần thiết nên : VddHCl = 0,2. 120% / 2 = 0,12 (lit) 4,0 Viết đầy đủ các pt được 1,0 0,5 0,25 0,25 0,25 0,5 0,25 0,25 0,25 0,5 6 a/ PT: CnH2n+2 + (3n +1) O2 -to> nCO2 + (n+1)H2O 2 x mol nx mol (n+1)x mol CpH2p + 3p O2 -to> pCO2 + pH2O 2 y mol py mol py mol CmH2m-2 + (3m -1) O2 -to> mCO2 + (m-1)H2O 2 z mol mz mol (m-1)z mol Ta có: nH2O = 5,04 :18 = 0,28 mol ó (n+1)x + py + (m-1)z = 0,28 mol (1) nCO2 = 14,08 : 44 = 0,32 mol ó nx + py + mz = 0,32 mol (2) nA = 2,688 : 22,4 = 0,12 mol ó x + y + z = 0,12 mol (3) Theo đề: z = 3x (4) Giải (1),(2),(3),(4) ta được: x = 0,02mol, y = 0,04 mol, z = 0,06 mol % CnH2n+2 = 16,67% ; % CpH2p =33,33%; % CmH2m-2 =50% b/ Xét TH1: n = p =1/2m (giải ra trường hợp này loại) Xét TH2: m = p =1/2n (giải ra trường hợp này loại) Xét TH3: n = m =1/2p (giải ra trường hợp này nhận : n=2, m=2, p=4) => CTPT của 3 Hidrocacbon là: C2H6 ; C4H8; C2H2 4,0 0,25 0,25 0,25 0,25 0,25 0,25 0,5 0,5 0,5 0,5 0,5 --------------------------------------Hết--------------------------------------------- LƯU Ý: Học sinh có những cách giải khác mà đúng kết quả vẫn cho điểm tối đa mỗi câu
Tài liệu đính kèm:
 ĐỀ TN.doc
ĐỀ TN.doc





