Tuyển tập Đề thi học sinh giỏi Hóa học lớp 9 - Đề 41
Bạn đang xem tài liệu "Tuyển tập Đề thi học sinh giỏi Hóa học lớp 9 - Đề 41", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
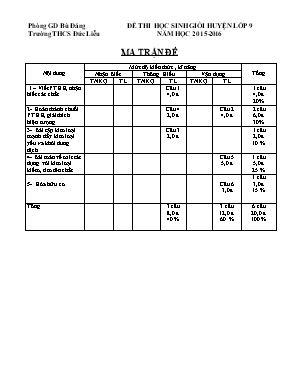
Phòng GD Bù Đăng ĐỀ THI HỌC SINH GIỎI HUYỆN LỚP 9 Trường THCS Đức Liễu NĂM HỌC 2015-2016 MA TRẬN ĐỀ Nội dung Mức độ kiến thức , kĩ năng Tổng Nhận Biết Thông Hiểu Vận dụng TNKQ TL TNKQ TL TNKQ TL 1 – Viết PTHH, nhận biết các chất Câu 1 4,0 đ 1 câu 4,0 đ 20% 2- Hoàn thành chuỗi PTHH, giải thích hiện tượng Câu 4 2,0 đ Câu 2 4,0 đ 2 câu 6,0 đ 30% 3- Bài tập kim loại mạnh đẩy kim loại yếu ra khỏi dung dịch Câu 3 2,0 đ 1 câu 2,0 đ 10 % 4- Bài toán về oxit tác dụng với kim loại kiềm, tìm tên chất Câu 5 5,0 đ 1 câu 5,0 đ 25 % 5- Hóa hữu cơ Câu 6 3,0đ 1 câu 3,0 đ 15 % Tổng 3 câu 8,0 đ 40 % 3 câu 12,0 đ 60 % 6 câu 20,0 đ 100 % TRƯỜNG THCS ĐỨC LIỄU ĐỀ THI HỌC SINH GIỎI CẤP HUYỆN MÔN : HÓA HỌC – LỚP 9 Năm học: 2015 – 2016 (Thời gian 150 phút không kể thời gian phát đề) Câu 1 (4,0 điểm). Tìm 8 chất rắn khác nhau mà khi cho 8 chất đó tác dụng với dung dịch HCl thì có 8 chất khí khác nhau thoát ra. Viết phương trình phản ứng minh họa. Cho 7 dung dịch NH4Cl; (NH4)2SO4; KCl; AlCl3; FeCl2; FeCl3; CuCl2 mỗi dung dịch đựng trong một lọ mất nhãn. Hãy nhận biết các dung dịch trên mà chỉ dùng một chất . Câu 2: (4,0 điểm) Chọn các chất A,B,C thích hợp và viết các phương trình phản ứng theo sơ đồ biến hoá sau: A B CuSO4 CuCl2 Cu(NO3)2 A B C C Gi¶i thÝch v× sao ®å dïng b»ng nh«m kh«ng dïng ®ùng dung dÞch kiÒm m¹nh. Câu 3: ( 2 đ ) Cho hỗn hợp gồm x (mol) Fe và y (mol) Al vào dung dịch chứa z (mol) AgNO3 thì thu được dung dịch A và rắn B. Xác định quan hệ giữa x,y,z thỏa mãn các điều kiện sau: a) Rắn B gồm 3 kim loại. b) Rắn B gồm 2 kim loại. c) Rắn B gồm 1 kim loại. C©u 4: (2 ®iÓm) §Æt hai cèc trªn ®Üa c©n. Rãt dung dÞch H2SO4 lo·ng vµo hai cèc, lîng axÝt ë hai cèc b»ng nhau, c©n ë vÞ trÝ th¨ng b»ng.Cho mÉu KÏm vµo mét cèc vµ mÉu S¾t vµo cèc kia. Khèi lîng cña hai mÉu nh nhau. C©n sÏ ë vÞ trÝ nµo sau khi kÕt thóc ph¶n øng ? Câu 5:( 5 điểm) 1) Cho 16,8 lít CO2 (ở đktc) hấp thụ hoàn toàn vào 600 ml dung dịch NaOH 2M thu được dung dịch A. Tính khối lượng các muối có trong dung dịch A. 2) Một hỗn hợp X gồm kim loại M (M có hóa trị II và III) và oxit MxOy của kim loại ấy. Khối lượng hỗn hợp X là 27,2 gam. Khi cho X tác dụng với 0,8 lít HCl 2M thì hỗn hợp X tan hết cho dung dịch A và 4,48 lít khí (đktc). Để trung hòa lượng axit dư trong dung dịch A cần 0,6 lít dung dịch NaOH 1M. Biết rằng số mol của M bằng 2 lần số mol của MxOy . Xác định M, MxOy . Tính nồng độ mol của dung dịch HCl Câu 6: (3,0 điểm) Người ta đốt cháy một hiđrôcacbon A bằng O2 dư rồi dẫn sản phẩm cháy lần lượt đi qua bình A đựng H2SO4 đặc thấy khối lượng bình A tăng thêm 5,4 gam, rồi qua bình B đựng 200ml dung dịch NaOH 2M. Khi thêm BaCl2 dư vào bình B thấy tạo ra 19,7gam kết tủa BaCO3 . Biết tỷ khối hơi của A so với H2 bằng 21 . Xác định CTPT của A. ( Biết Fe = 56; Ba = 137; Cl = 35,5; C = 12 ; O = 16 ; H = 1 ; Ag = 108 ) HƯỚNG DẪN CHẤM ĐỀ THI CHỌN HỌC SINH GIỎI CẤP TRƯỜNG NĂM HỌC 2015-2016 MÔN: HÓA HỌC Caâu Noäi dung Ñieåm 1 (4ñ) 1. Có thể chọn 8 chất trong các chất sau: Fe, FeS, CaCO3, KMnO4, Na2SO3, CaC2, KNO2, Al4C3, Na2O2, Na3N, Ca3P2 + Phản ứng xảy ra: Fe + 2HCl → FeCl2 + H2↑ FeS + 2HCl → FeCl2 + H2S↑ CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O Na2SO3 + 2HCl → 2NaCl + SO2↑ + H2O CaC2 + 2HCl → C2H2↑ + CaCl2 3KNO2 + 2HCl → 2KCl + KNO3 + 2NO↑ + H2O Al4C3 + 12HCl → 4AlCl3 + 3CH4↑ 2Na2O2 + 4HCl → 4NaCl + O2↑ + 2H2O Na3N + 3HCl → 3NaCl + NH3↑ Ca3P2 + 6HCl → 3CaCl2 + 2PH3↑ @ Ghi chú: Học sinh chọn các chất khác với các chất trên mà đúng vẫn cho điểm nhưng tối đa chỉ được 2,0 điểm 2. + Lấy mỗi dung dịch một lượng cần thiết để tiến hành nhận biết. + Tiến hành nhận biết ta được kết quả ở bảng sau: NH4Cl (NH4)2SO4 KCl AlCl3 FeCl2 FeCl3 CuCl2 dd Ba(OH)2 dư ↑ khai ↑ khai & ↓ trắng không hiện tượng ↓ trắng, tan hết ↓ trắng xanh ↓ nâu đỏ ↓ xanh + Phản ứng xảy ra: 2NH4Cl + Ba(OH)2 → BaCl2 + 2NH3↑ + 2H2O (NH4)2SO4 + Ba(OH)2 → BaSO4↓ + 2NH3↑ + 2H2O 2AlCl3 + 3Ba(OH)2 → 2Al(OH)3↓ + 3BaCl2 2Al(OH)3 + Ba(OH)2 → Ba(AlO2)2 + 4H2O hoặc: 2Al(OH)3 + Ba(OH)2 → Ba[Al(OH)4]2 FeCl2 + Ba(OH)2 → Fe(OH)2↓ + BaCl2 2FeCl3 + 3Ba(OH)2 → 2Fe(OH)3↓ + 3BaCl2 CuCl2 + Ba(OH)2 → Cu(OH)2↓ + BaCl2↓ @ Ghi chú: Học sinh làm cách khác đúng vẫn cho điểm tối đa; ( 2đ ) Mỗi PT đúng được 0,25 điẻm (2đ) 0,25 0,25 0,25 0,25 0,25 0,25 0,25 0,25 2 (4ñ)đđ A : Cu(OH)2 ; B : CuO ; C : Cu PT : Cu(OH)2 + H2SO4 CuSO4 + 2H2O CuO + H2SO4 ® CuSO4 + H2O CuO + H2SO4 ® CuSO4 + H2O CuCl2 + 2AgNO3 2AgCl + Cu(NO3)2 CuSO4 + BaCl2 BaSO4 + CuCl2 Cu(NO3)2+ 2NaOH ® Cu(OH)2 + NaNO3 Cu(OH)2 ® CuO + H2O CO + CuO ® Cu + CO2 - Kh«ng thÓ dïng ®å nh«m ®ùng dung dÞch kiÒm m¹nh, ch¼ng h¹n níc v«i trong lµ do: + Tríc hÕt líp Al2O3 bÞ ph¸ huû v× Al2O3 lµ mét hîp chÊt lìng tÝnh Al2O3 + Ca(OH)2 ® Ca(AlO2)2 + H2O + Sau khi líp Al2O3 bÞ hoµ tan, Al ph¶n øng víi níc m¹nh 2Al + 6H2O ® 2Al(OH)3 + 3H2 + Sù ph¸ huû Al x¶y ra liªn tôc bëi v× Al(OH)3sinh ra ®Õn ®©u lËp tøc bÞ hoµ tan ngay bëi Ca(OH)2, do Al(OH)3 lµ hîp chÊt lìng tÝnh 2Al(OH)3 + Ca(OH)2 ® Ca(AlO2)2 + 4H2O Ph¶n øng chØ dõng l¹i khi nµo hÕt nh«m hoÆc hÕt níc v«i trong ( 2đ ) 0, 25 0, 25 0,2 5 0, 25 0, 25 0,25 0, 25 0, 25 (2 đ ) 0,25 0,25 0,25 0,25 0,25 0,25 0,25 0,25 3. (2 ñ) Vì Al > Fe > Ag nên thứ tự các phản ứng như sau: Al + 3AgNO3 ® Al(NO3)3 + 3Ag ¯ (1) .y ® 3y (mol) Fe + 2AgNO3 ® Fe(NO3)2 + 2Ag ¯ (1) .x ® 2x (mol) a) Nếu rắn B gồm 3 kim loại : (Al,Fe,Ag ) thì pư ở (1) Al dư : z < 3y b) Nếu rắn B gồm 2 kim loại : (Fe, Ag) thì Fe còn dư hoặc chưa phản ứng : 3y £ z < 3y + 2x c) Nếu rắn B gồm 1 kim loại : Fe hết ® z ³ 3y + 2x 0, 25 0, 25 0, 5 0, 5 0,5 4 (2ñ) * Trêng hîp axÝt ®ñ hoÆc d C©n sÏ nghiªng vÒ cèc cho kÏm vµo nÕu a xÝt ®ñ hoÆc d Ph¬ng tr×nh ph¶n øng ho¸ häc lµ: Zn + H2SO4 ® ZnSO4 + H2 65g 2g ag Fe + H2SO4 ® FeSO4 + H2 56g 2g ag V× > cho nªn c©n sÏ nghiªng vÒ cèc cho miÕng s¾t. * NÕu a xÝt thiÕu th× lîng H2 ®îc tÝnh theo lîng axit. Do lîng axit b»ng nhau nªn lîng H2 tho¸t ra ë hai cèc b»ng nhau. C©n vÉn ë vÞ trÝ c©n b»ng sau khi kÕt thóc ph¶n øng 0, 5 0, 5 0, 5 0, 5 5 (5ñ) 1. ( 2 điểm) Ta có: nCO = mol nNaOH = 0,6.2 = 1,2 mol Vì nCO < nNaOH < 2nCO do đó thu được hỗn hợp hai muối. PTHH: CO2 + 2NaOH ® Na2CO3 + H2O mol x 2x x CO2 + NaOH ® NaHCO3 mol y y y Đặt x, y lần lượt là số mol của Na2CO3 và NaHCO3 . Ta có hệ phương trình sau: Þ x = 0,45 ; y = 0,3 mNaHCO = 0,3.84 = 25,2 gam; mNaCO = 0,45.106 = 47,7 gam 2. (3 điểm) Theo đề: nH= = 0,2 mol; nHCl = 0,8 . 2 = 1,6mol; nNaOH = 0,6mol M có hai hóa trị II và III, nhưng khi tác dụng với dung dịch HCl chỉ thể hiện hóa trị II. M + 2HCl ® MCl2 + H2 (1) mol 0,2 0,4 0,2 HCl + NaOH ® NaCl + H2O (2) mol 0,6 0,6 nHCl phản ứng với MxOy = 1,6 - 0,6 - 0,4 = 0,6 mol MxOy + 2yHCl ® xMCl2y/x + yH2 O (3) mol 1 2y mol 0,6 nMO = = nM = 0,1 mol = 0,1 ® y = 3; x y vậy chỉ có thể x = 2 ( theo đầu bài, M có hóa trị II và III). Vậy CTPT của oxit là M2O3 nM = 0,2 ® 0,2M + 0,1. ( 2M + 3 . 16) = 27,2 Giải ra ta có M = 56 (Fe) 0,5 0,25 0, 25 0, 25 0,5 025 0,5 0,25 0,25 0,25 0,5 0,25 0,25 0,25 0,5 6 (3đ) - Sản phẩm cháy khi đốt Hiđrô cac bon bằng khí O2 là CO2; H2O; O2 dư. Khi dẫn sản phẩm cháy đi qua H2SO4 đặc thì toàn bộ H2O bị giữ lại (do H2SO4 đặc hút nước mạnh), do vậy lượng H2SO4 tăng 10,8gam, chính bằng lượng nước tạo thành ( = 5,4 gam), khí còn lại là CO2, O2 dư tiếp tục qua dung dịch NaOH, xảy ra phản ứng giữa CO2 và NaOH CO2 + 2NaOH ® Na2CO3 + H2O (1) CO2 + NaOH ® NaHCO3 (2) Tuỳ thuộc vào số mol của CO2 và NaOH mà có thể tạo ra muối trung hoà Na2CO3 lẫn muối axit NaHCO3) * Trường hợp 1: NaOH dư, sản phẩm của phản ứng giữa CO 2 và NaOH chỉ là muối trung hoà. Dung dịch A gồm Na2CO3 + H2O Khi phản ứng với dung dịch BaCl 2, toàn bộ muối gốc cacbonat bị chuyển thành kết tủa BaCO3. Na2CO3 + BaCl2 ® BaCO3 + 2NaCl (3) Ta có: = Vì: = ® = 0,1 (mol) => mC = 0,1 . 12 = 1,2 g Trong khi:mH = Gọi CTPT của A là CxHy x : y = : = 0,1 : 0,6 = 1 : 6 ( loại ) * Trường hợp 2: - Như vậy NaOH không dư. Nghĩa là NaOH phản ứng hết. Đồng thời tạo ra cả muối axít và muối trung hoà (cả phản ứng (1) và (2) đều xảy ra, lượng CO2 phản ứng hoàn toàn, lượng CO2 bị giữ lại hoàn toàn) - Theo phương trình (1) n NaOH ban đầu = 0,2 . 2 = 0.4 (mol) nNaOH = 2. = 2 . = 2 . 0,1 = 0,2 (mol) ® ở (1) = 0,1 (mol) (*) Lượng NaOH còn lại: 0,4 - 0,2 = 0,2 (mol). Tham gia phản ứng (2) - Theo phương trình (2): = n NaOH = 0,2 (mol) (**) - Vậy từ (*), (**) lượng khí CO2 tạo thành trong phản ứng cháy là = 0,1 + 0,2 = 0,3 (mol) mC = 0,3 . 12 = 3,6 g Gọi CTPT của A là CxHy x : y = : = 0,3 : 0,6 = 1 : 2 vậy CTĐG của A là CH2 CTPT của A là ( CH2)n MA = 21. 2 = 42 14n = 42 => n = 3 CTPT của A là C3H6 0,25 0,5 0,25 0,25 0,25 0,25 0,25 0,25 0,25 0,25 0,25
Tài liệu đính kèm:
 ĐỀ ĐL.docx
ĐỀ ĐL.docx





