Tự học Hóa học 9 - Chương 2: Kim loại
Bạn đang xem tài liệu "Tự học Hóa học 9 - Chương 2: Kim loại", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
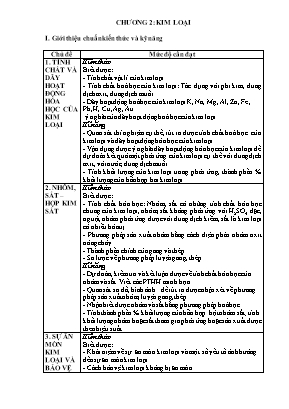
CHƯƠNG 2: KIM LOẠI I. Giới thiệu chuẩn kiến thức và kỹ năng Chủ đề Mức độ cần đạt 1. TÍNH CHẤT VÀ DÃY HOẠT ĐỘNG HểA HỌC CỦA KIM LOẠI Kiến thức Biết được: - Tớnh chất vật lớ của kim loại. - Tớnh chất hoỏ học của kim loại: Tỏc dụng với phi kim, dung dịch axit, dung dịch muối. - Dóy hoạt động hoỏ học của kim loại K, Na, Mg, Al, Zn, Fe , Pb, H, Cu, Ag, Au. ý nghĩa của dóy hoạt động hoỏ học của kim loại. Kĩ năng - Quan sỏt thớ nghiệm cụ thể, rỳt ra được tớnh chất hoỏ học của kim loại và dóy hoạt động húa học của kim loại. - Vận dụng được ý nghĩa dóy hoạt động húa học của kim loại để dự đoỏn kết quả một phản ứng của kim loại cụ thể với dung dịch axit, với nước, dung dịch muối. - Tớnh khối lượng của kim loại trong phản ứng, thành phần % khối lượng của hỗn hợp hai kim loại. 2. NHễM, SẮT – HỢP KIM SẮT Kiến thức Biết được: - Tớnh chất húa học: Nhụm, sắt cú những tớnh chất húa học chung của kim loại, nhụm, sắt khụng phản ứng với H2SO4 đặc, nguội, nhụm phản ứng được với dung dịch kiềm, sắt là kim loại cú nhiều húa trị. - Phương phỏp sản xuất nhụm bằng cỏch điện phõn nhụm oxit núng chảy. - Thành phần chớnh của gang và thộp. - Sơ lược về phương phỏp luyện gang, thộp. Kĩ năng - Dự đoỏn, kiểm tra và kết luận được về tớnh chất húa học của nhụm và sắt. Viết cỏc PTHH minh họa. - Quan sỏt sơ đồ, hỡnh ảnh... để rỳt ra được nhận xột về phương phỏp sản xuất nhụm, luyện gang, thộp. - Nhận biết được nhụm và sắt bằng phương phỏp hoỏ học. - Tớnh thành phần % khối lượng của hỗn hợp bột nhụm sắt; tớnh khối lượng nhụm hoặc sắt tham gia phản ứng hoặc sản xuất được theo hiệu suất. 3. SỰ ĂN MềN KIM LOẠI VÀ BẢO VỆ KIM LOẠI KHễNG BỊ ĂN MềN Kiến thức Biết được: - Khỏi niệm về sự ăn mũn kim loại và một số yếu tố ảnh hưởng đến sự ăn mũn kim loại. - Cỏch bảo vệ kim loại khụng bị ăn mũn. Kĩ năng - Quan sỏt một số thớ nghiệm, rỳt ra được nhận xột về một số yếu tố ảnh hưởng đến sự ăn mũn kim loại. - Nhận biết được hiện tượng ăn mũn kim loại trong thực tế. - Vận dụng để bảo vệ được một số đồ vật kim loại trong gia đỡnh. II. Cõu hỏi và bài tập theo chuẩn kiến thức, kỹ năng 2.1. Dự đoán hiện tượng xảy ra và viết phương trình phản ứng hoá học khi: a) Đốt dây sắt trong khí clo b) Cho một đinh sắt vào dd CuCl2 c) Cho một viên kẽm vào dd CuSO4 2.2. A, B, C là các hợp chất vô cơ của một kim loại. Khi đốt nóng ở t0 cao cho ngọn lửa màu vàng. Biết A + B C B C + H2O + D (D là hợp chất của cacbon) D + A B hoặc C - Hỏi A, B, C là các chất gì? Viết phương trình hoá học giải thích quá trình trên ? - Cho A, B, C tác dụng với CaCl2 viết các phương trình hoá học. 2.3. Bột kim loại sắt có lẫn nhôm. Hãy nêu phương pháp làm sạch sắt. 2.4. Bạc dạng bột có lẫn tạp chất đồng, nhôm. Bằng phương pháp hoá học, làm thế nào thu được bạc tinh khiết. Các hoá chất coi như có đủ. 2.5. Có 3 kim loại riêng biệt là nhôm, sắt, bạc. Hãy nêu phương pháp hoá học để nhận biết từng kim loại. Các dụng cụ hoá chất coi như có đủ. Viết các phương trình hoá học. 2.6. Cho sơ đồ chuyển hóa sau: Xác định các chất X; A; B; D; G; E và F và viết các phương trình hoá học minh hoạ. 2.7. Viết phương trình phản ứng của những biến đổi sau: - Sản xuất vôi sống bằng cách nung đá vôi. - Cho vôi sống tác dụng với nước (tôi vôi). 2.8. Hoàn thành các PTHH biểu diễn dãy biến hoá sau : a) Mg MgCl2 Mg(NO3)2 MgSO4 MgCO3 MgO b) AlAl2O3Al2(SO4)3AlCl3Al(NO3)3 Al(OH)3 Al2O3 2.9. Viết các PTHH biểu diễn dãy biến hoá sau : CaCa(OH)2 CaO CaCO3 Ca(HCO3)2 CaCO3 2.10. c) Hoàn thành các PTHH của dãy biến hoá sau : Na Na2O NaOH NaHCO3 Na2CO3 NaOH 2.11. Viết các PTHH biểu diễn dãy biến hoá sau : Fe Fe3O4FeOFeFe(NO3)33Fe(NO3)2Fe(OH)2 Fe2O3. 2.12. Điền công thức hoá học và chỗ trống, hệ số, trạng thái và điều kiện phản ứng phù hợp trong các sơ đồ phản ứng sau để hoàn thành phương trình phản ứng hoá học hoàn chỉnh : a) Fe + ... Fe3O4 b) Al + O2 ... c) Fe + ... FeCl3 d) Fe + ... FeCl2 + ... e) ... + ... Cu + MgSO4 f) ... + ... NaOH + H2 2.13. Hãy tìm các chất X1, X2, X3, ... thích hợp và hoàn thành các phản ứng sau a) X1+ X2 đ Fe2(SO4)3 + SO2 + H2O b) X1 + X3 đ FeSO4 + X4 c) X5 + X6 đ Mg(OH)2 + NaCl d) X7 + X8 + X9 đ Fe(OH)3 e) X10 X11 + H2O 2.14. Cho một miếng Na kim loại tác dụng với dung dịch là hỗn hợp MgSO4 và CuSO4, khuấy đều hỗn hợp. Lọc, rửa kết tủa mới tạo thành, sấy khô rồi nung nóng đến khối lượng không đổi, thu được chất rắn gồm 2 oxit. Viết các PTHH của các phản ứng đã xảy ra. 2.15. Có một miếng Na kim loại để ngoài không khí sau một thời gian ngắn, nó bị biến thành hỗn hợp A, hoà tan hết A vào nước, thu được dung dịch B. Cho vào B dung dịch BaCl2 và một giọt chất chỉ thị phenolphtalein. Hãy mô tả hiện tượng hoá học xảy ra và viết các PTHH của các phản ứng đó. 2.16. Có 4 lọ hoá chất mất nhãn trong mỗi lọ đựng một trong những kim loại sau đây ở dạng bột Ag, Fe, Zn và Mg. Hãy trình bày bằng phương pháp hoá học để nhận biết các kim loại đó chỉ được dùng các ống nghiệm, 2 thuốc thử là các hoá chất thông dụng. Viết các PTHH minh hoạ. 2.17. Cho các lọ hoá chất mất nhãn trong mỗi lọ đựng 1 trong các dung dịch sau : (NH4)2CO3, NH4Cl, Na2SO4, AlCl3, FeCl2, FeCl3, KNO3. Hãy trình bày phương pháp hoá học, chỉ dùng các ống nghiệm, đèn cồn và một dung dịch thuốc thử nhận biết từng dung dịch. Viết các PTHH của các phản ứng cần dùng. 2.18. Một mẫu hợp kim ở dạng phoi bào gồm các kim loại sau : Ag, Cu, Mg, Al và Fe. Hãy trình bày phương pháp hoá học đi từ hợp kim đó có thể điều chế được: a) Ag tinh khiết b) CuO tinh khiết ; c) Al2O3 tinh khiết. Viết các PTHH của các phản ứng xảy khi thực hiện phương pháp điều chế. 2.19. Cho bột Al tác dụng hết với dung dịch NaOH dư, đun nóng giải phóng ra khí B không màu, không mùi. Cho 1 dòng khí CO2 đi qua dung dịch thấy kết tủa trắng xuất hiện. Thêm dung dịch HCl vào khuấy đều lại thấy kết tủa đó tan hết. Viết các PTHH của các phản ứng đã xảy ra. 2.20. Đốt cháy bột kim loại M trong không khí, thu được oxit của nó, trong đó oxi chiếm 20% khối lượng. Hãy xác định kim loại đó. 2.21. Đốt cháy hoàn toàn 1 g bột kim loại M trong oxi dư, thu được chất rắn có khối lượng 1,667 g. Xác định M là kim loại nào ? 2.22. Hoà tan 0,56 gam sắt bằng dung dịch H2SO4 loãng vừa đủ. a) Viết phương trình hoá học của phản ứng xảy ra. b) Tính khối lượng muối tạo thành và thể tích khí H2 sinh ra (đktc). 2.23. Cho 10,52 g hỗn hợp ba kim loại ở dạng bột Mg, Al và Cu tác dụng hoàn toàn với oxi, thu được 17,4 g hỗn hợp oxit. Hỏi để hoà tan vừa hết lượng hỗn hợp oxit đó cần dùng ít nhất bao nhiêu ml dung dịch HCl 1,25M. 2.24. Ngâm bột magie dư trong 10 ml dung dịch AgNO 3 1M. Sau khi phản ứng kết thúc, lọc được chất rắn A và dung dịch B. a) Cho A tác dụng hoàn toàn với dung dịch HCl dư. Tính khối lượng chất rắn còn lại sau phản ứng. b) Tính thể tích dung dịch NaOH 1M vừa đủ để kết tủa hoàn toàn dung dịch B. 2.25. Cho hỗn hợp có thành phần đồng nhất gồm Fe và Cu ở dạng bột. Chia hỗn hợp thành 2 phần hoàn toàn đều nhau. Cho phần 1 tác dụng hết với dung dịch H2SO4 đặc, đun nóng thu được dung dịch chứa Fe2(SO4)3, CuSO4 và giải phóng ra 1,568 lit khí SO2 (ĐKTC). Cho phần 2 tác dụng với lượng dư dung dịch H2SO4 loãng, phản ứng hoàn toàn thấy giải phóng ra 0,448 lit khí H2 (ĐKTC). Viết các PTHH xảy ra và tính % theo khối lượng của mỗi kim loại trong hỗn hợp. 2.26. Cho 12,5 g hỗn hợp bột các kim loại nhôm, đồng và magie tác dụng với HCl (dư). Phản ứng xong thu được 10,08 lít khí (đktc) và 3,5 g chất rắn không tan. a) Viết các phương trình hoá học của phản ứng xảy ra. b) Tính thành phần % khối lượng mỗi kim loại có trong hỗn hợp. 2.27. Cho 4,06 g hỗn hợp Al và Zn tác dụng với 200 ml dung dịch HCl 2,3M. a) Nếu phản ứng xảy ra hoàn toàn thì các kim loại có tan hết không ? b) Nếu trong thí nghiệm trên có 2,128 lit khí H2 (ĐKTC) thoát ra thì sau khi cô cạn cẩn thận dung dịch thì thu được bao nhiêu g muối khan. 2.28. Cho 19,73 g hỗn hợp 3 kim loại Mg, Al và Cu. Đun nóng hỗn hợp trong không khí dư oxi để phản ứng xảy ra hoàn toàn thu được 28,45 g chất rắn. Hỏi để hoà tan hết lượng chất rắn đó cần dùng ít nhất bao nhiêu ml dung dịch HCl 5M. 2.29. Cho 0,552 g kim loại M tác dụng hết với nước (ở nhiệt độ thường), thu được dung dịch A và V1 lit khí H2 (ĐKTC). Trung hoà cẩn thận dung dịch A bằng lượng vùa đủ dung dịch HCl rồi cô cạn cẩn thận dung dịch sau khi trung hoà, thu được 1,4040 g muối khan. Hãy xác định kim loại M và tính V1. 2.30. Ngâm một lá đồng vào dung dịch AgNO3. Sau phản ứng khối lượng lá đồng tăng thêm 1,52 gam. Tính số gam đồng bị hoà tan và số gam AgNO3 đã tham gia phản ứng (giả thiết toàn bộ lượng bạc được thoát ra bám vào lá đồng). 2.31. Cho 3,68 g hỗn hợp Mg và Fe tác dụng hết với dung dịch HCl, thu được dung dịch A và 2,24 lit khí H2 (ĐKTC). Thêm vào A lượng dư dung dịch NaOH rồi đem lọc, rửa kết tủa mới tạo thành, nung trong không khí ở nhiệt độ cao đến khi thu được chất rắn có khối lượng không đổi là m1 g. a) Viết các PTHH của các phản ứng xảy ra, b) Tính hàm lượng % theo khối lượng của mỗi kim loại trong hỗn hợp và tính m1. 2.32. Cho hỗn hợp A gồm Mg và Cu ở dạng bột, khối lượng a g tác dụng hoàn toàn với oxi thu được chất rắn có khối lượng 1,4a g. a) Tính thành phần % theo khối lượng của mỗi kim loại trong hỗn hợp A. b) Giả sử lấy 10 g hỗn hợp A tác dụng với lượng dư dung dịch AgNO3 khuấy đều để phản ứng xảy ra hoàn toàn. Tính khối lượng kim loại đã kết tủa trong phản ứng đó. 2.33. 1) Biết rằng 300 ml dung dịch HCl 1M đủ để hoà tan 5,1 gam oxit của kim loại R hoá trị (III). Hãy xác định tên kim loại. 2) Cũng lấy thể tích dung dịch HCl 1M như trên để hoà tan 3,9 gam kim loại R xác định được. Tính thể tích khí hiđro thoát ra (ở điều kiện tiêu chuẩn). 2.34. Để xác định công thức của tinh thể ngậm nước MgCO3.nH2O người ta lấy một lượng muối đó đem nung ở nhiệt độ cao để phản ứng nhiệt phân xảy ra hoàn toàn, đồng thời cho toàn bộ lượng khí và hơi nước thoát ra đi chậm qua bình 1 đựng lượng dư dung dịch axit H2SO4 đặc và bình 2 đựng lượng dư dung dịch NaOH đặc. Nhận thấy khối lượng bình 1 tăng lên 1,8 g, khối lượng bình 2 tăng lên 0,88 g. Hãy xác định công thức phân tử của muối kết tinh ngậm nước đó. 2.35. Cho hỗn hợp A gồm Mg và MgCO3 tác dụng hoàn toàn với dung dịch HCl, thu được dung dịch A1 và 2,688 lit ( ĐKTC ) hỗn hợp khí A2. Cho toàn bộ lượng khí A2 đi chậm qua bình đựng lượng dư dung dịch NaOH, thì còn lại 1,792 lit khí (ĐKTC) đi ra khỏi bình. Sau đó đem cô cạn cẩn thận dung dịch A1 thì được dung dịch m1 g muối khan. a) Viết các PTHH của các phản ứng đã xảy ra. b) Tính hàm lượng % theo khối lượng của Mg trong hỗn hợp. c) Tính khối lượng m1 2.36. Cho 13 g Zn hạt nhỏ tác dụng hoàn toàn với dung dịch H2SO4 loãng. Cho toàn bộ lượng khí hiđro được tạo thành đi chậm qua ống sứ đựng 20 g bột CuO nung nóng, thu được hỗn hợp rắn A trong ống. Hỏi để hoà tan hết A cần dùng bao nhiêu ml dung dịch H2SO4 đặc, nồng độ 85% và đun nóng ? Biết rằng dung dịch axit đó có D = 1,28 g/ml. Câu hỏi trắc nghiệm khách quan nhiều lựa chọn 2.37. Dãy kim loại được xếp theo chiều tính kim loại tăng dần là : A. K , Na , Al , Fe B. Cu , Zn, Fe , Mg C. Fe , Mg, Na, K D. Ag, Cu, Al , Fe 2.38. Cặp kim loại đều phản ứng với nước ở nhiệt độ thường : A. Na, Al B. K, Na C. Al, Cu D. Mg, K 2.39. Dãy gồm các kim loại đều phản ứng với dung dịch CuSO4 : A. Na, Al, Cu B. Al, Fe, Mg, Cu C. Na, Al, Fe, K D. K, Mg, Ag, Fe 2.40. Dãy gồm các kim loại đều tác dụng với dung dịch H2SO4 loãng : A. Na, Al, Cu, Mg B. Zn, Mg, Na, Al C. Na, Fe, Cu, K, Mg D. K, Na, Al, Ag 2.41. Điều chế nhôm theo cách : A. Dùng than chì để khử Al2O3 ở nhiệt độ cao. B. Điện phân dung dịch muối nhôm. C. Điện phân Al2O3 nóng chảy. D. Dùng kim loại Na đẩy Al ra khỏi dung dịch muối nhôm. 2.42. Cho một mẩu kim loại Na vào dung dịch CuSO4. Hiện tượng quan sát được là : A. Kim loại Na đẩy Cu ra khỏi dung dịch. B. Na tan tạo dung dịch kiềm. C. Na tan giải phóng khí H2. Sau phản ứng dung dịch mất màu, thu được kết tủa màu xanh. D. Na tan, sau phản ứng thu được Cu và khí SO2. 2.43. Cho hỗn hợp Al và Fe dạng bột tác dụng với dung dịch CuSO4 khi khuấy kĩ để phản úng xảy ra hoàn toàn, thu được dung dịch của 3 muối tan và chất kết tủa. Thành phần dung dịch và kết tủa gồm các chất A. Al2(SO4)3, FeSO4 và CuSO4 và Cu, Fe B. Al2(SO4)3, FeSO4 và CuSO4 và Cu C. Al2(SO4)3, FeSO4 và CuSO4 và Cu, Al D. Al2(SO4)3, FeSO4 và CuSO4 và Al, Fe 2.44. Cho hỗn hợp gồm Mg và Fe ở dạng bột tác dụng với dung dịch CuCl2 khi khuấy đều để phản ứng xảy ra hoàn toàn, thu được dung dịch và kết tủa gồm 2 kim loại. Thành phần của dung dịch thu được gồm các chất A. MgCl2 B. MgCl2, CuCl2 C. MgCl2, FeCl2 D. FeCl2 2.45. Đốt cháy kim loại M trong lượng dư oxi, thu được oxit trong đó M chiếm 70% về khối lượng. Kim loại M là A. MgO B. Fe2O3 C. Fe3O4 D. CuO 2.46. Đốt cháy hết 0,36 g bột Mg trong không khí, thu được chất rắn A. Hoà tan hết A trong lượng vừa đủ là 100 ml dung dịch HCl loãng, thu được dung dịch A1. Nồng độ mol của dung dịch HCl đã dùng và nồng độ muối trong dung dịch A1 lần lượt là A. 0,3M và 0,6M B. 0,15M và 0,3M C. 0,3M và 0,15M D. 0,6M và 0,3M 2.47. Cho 2,016 g kim loại M tác dụng vừa hết với oxi trong không khí, thu được 2,52 g oxit của nó. Oxit của kim loại M là A. MgO B. Fe2O3 C. Fe3O4 D. CuO 2.48. Cho 23,676 g hỗn hợp 3 kim loại Mg, Al, Cu tác dụng hết với O2, thu được 34,14 g hỗn hợp gồm 3 oxit. Hỏi để hoà tan hết lượng hỗn hợp oxit đó cần ít nhất bao nhiêu ml dung dịch hỗn hợp 2 axit HCl 3M và H2SO41,5M. A. 218ml B. 109ml C. 300ml D. 200ml 2.49. Đốt cháy một ít bột đồng trong không khí trong một thời gian ngắn. Sau khi kết thúc phản ứng thấy khối lượng chất rắn thu được tăng 16,67% so với khối lượng của bột Cu ban đầu. Thành phần % theo khối lượng của Cu trong chất rắn thu được sau khi đun nóng là A. 71,43% B. 20% C. 28,57% D. 16,67% 2.50. Cho hỗn hợp Cu và Mg cùng số mol. Đốt nóng m1 g hỗn hợp trong không khí cho đến khi phản ứng xảy ra hoàn toàn, thu được chất rắn có khối lượng 14,4 g. Xác định m1. A. 10,56 g B. 5,28 g C. 10,65 g D. 21,12 g 2.51. Cho 2,016 g kim loại M có hoá trị không đổi tác dụng hết với oxi, thu được 2,784 g chất rắn. Hãy xác định kim loại đó. A. Mg B. Mn C. Pb D. Fe 2.52. Cho 6,93 g hỗn hợp gồm Mg và Al dạng bột tác dụng hết với dung dịch HCl, thu được dung dịch A. Cô cạn cẩn thận dung dịch A thì thu được 31,425 g muối khan. Thành phần % theo khối lượng của Mg và Al trong hỗn hợp là A. 58,44% và 41,56% B. 41,56% và 58,44% C. 41,65% và 58,35% D. 58,35% và 41,65% 2.53. Cho 2,88 g hỗn hợp A gồm kim loại M hoá trị II không đổi và oxit của nó tác dụng hết với dung dịch HCl, thấy giải phóng ra 1,008 lit khí hiđro (đktc) và thu được dung dịch A1. Cô cẩn thận dung dịch A1 thu được 8,55 g muối khan. M là A. Mg B. Zn C. Ca D. Ni 2.54. Cho 3,6 g hỗn hợp Mg và Al tác dụng hết với oxi khi đun nóng, thì thu được chất rắn có khối lượng 6,48 g. Hỏi để hoà tan vừa hết lượng chất rắn đó thì cần phải dùng ít nhất bao nhiêu ml dung dịch HCl 4M. A. 200ml B. 60ml C. 90ml D. 100ml 2.55. Để hoà tan hết 4 g oxit kim loại có hoá trị không đổi cần dùng vừa đủ 25 g dung dịch HCl 29,2%. Xác định oxit của kim loại đã làm thí nghiệm. A. Al2O3 B. MgO C. ZnO D. CuO 2.56. Nung nóng 1,97 g muối cacbonat kim loại M có hoá trị không đổi trong mọi hợp chất, thu được chất màu trắng. Cho chất rắn đó tác dụng hết với nước, phản ứng xảy ra mãnh liệt. Thêm vào dung dịch lượng dư H2SO4 loãng, thấy tạo thành 2,33 g kết tủa trắng. Hãy xác định công thức của muối cacbonat đó. A. CaCO3 B. MgCO3 C. ZnCO3 D. BaCO3 2.57. Cho 9 g hỗn hợp gồm Al và oxit của nó tác dụng hoàn toàn với một dung dịch NaOH 25% ( D = 1,28 g/ml ), thấy giải phóng ra 3,36 lit H2 (đktc ). Số mol NaOH đã phản ứng là A. 0,220 B. 0,224 C. 0,112 D. 0,336 2.58. Đốt cháy hoàn toàn một kim loại trong khí oxi dư thu được oxit, trong đó % khối lượng kim loại : 80% > % Khối lượng kim loại > 70%. Kim loại là : A. Mg B. Fe C. Al D. Cu
Tài liệu đính kèm:
 Tu hoc 9-2.doc
Tu hoc 9-2.doc HDG Tu hoc 9-2.doc
HDG Tu hoc 9-2.doc





