Tài liệu 36 Chuyên đề bồi dưỡng học sinh giỏi Hóa học Lớp 9 và ôn thi vào Lớp 10 chuyên - Chuyên đề 29: Bài tập thực nghiệm và thực tiễn, điều chế, làm khô chất
Bạn đang xem tài liệu "Tài liệu 36 Chuyên đề bồi dưỡng học sinh giỏi Hóa học Lớp 9 và ôn thi vào Lớp 10 chuyên - Chuyên đề 29: Bài tập thực nghiệm và thực tiễn, điều chế, làm khô chất", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
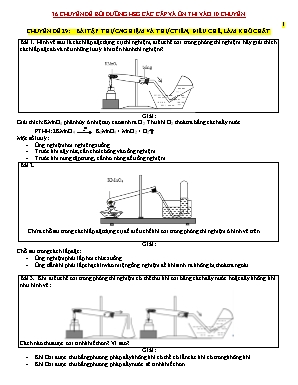
CHUYÊN ĐỀ 29: BÀI TẬP THỰC NGHIỆM VÀ THỰC TIỄN, ĐIỀU CHẾ, LÀM KHÔ CHẤT Bài 1. Hình vẽ sau là cách lắp đặt dụng cụ thí nghiệm, điều chế oxi trong phòng thí nghiệm. hãy giải thích cách lắp đặt đó và nêu những lưu ý khi tiến hành thí nghiệm? Giải: Giải thích: KMnO4 phân hủy ở nhiệt đọ cao sinh ra O2. Thu khí O2 thoát ra bằng cách đẩy nước. PTHH: 2KMnO4 K2MnO4 + MnO2 + O2 Một số lưu ý: Ống nghiệm hơi nghiêng xuống. Trước khi đậy nút, cần cho ít bông vào ống nghiệm. Trước khi nung tập trung, cần hơ nóng đều ống nghiệm. Bài 2. Chỉ ra chỗ sai trong cách lắp đặt dụng cụ đề điều chế khí oxi trong phòng thí nghiệm ở hình vẽ trên. Giải: Chỗ sai trong cách lắp đặt: Ống nghiệm phải lắp hơi chúc xuống. Ống dẫn khí phải lắp chạt kín vào miệng ống nghiệm để khí sinh ra không bị thoát ra ngoài. Bài 3. Khi điều chế oxi trong phòng thí nghiệm có thể thu khí oxi bằng cách đẩy nước hoặc đẩy không khí như hình vẽ: Cách nào thu được oxi tinh khiết hơn? Vì sao? Giải: Khí Oxi được thu bằng phương pháp đẩy không khí có thể có lẫn các khí có trong không khí. Khí Oxi được thu bằng phương pháp đẩy nước sẽ tinh khiết hơn. Bài 4. Cho hình vẽ biểu diễn thí nghiệm của oxi với Sắt như sau: Hãy điền tên đúng của các kí hiệu 1,2,3 và cho biết vai trò của kí hiệu 3? Giải: Dây sắt. Oxi. Nước. PTHH: 3Fe + 2O2 Fe3O4 Phản ứng trên tỏa nhiều nhiệt, sản phẩm sinh ra rơi xuống bình có thể làm vỡ bình. (3) Nước làm cho hạ nhiệt độ của sản phẩm và bình, tránh gây vỡ bình. Bài 5. Hình vẽ sau là cách lắp đặt dụng cụ thí nghiệm dùng để điều chế khí C (là 1 trong các khí: CO2, CH4, H2, SO2, NH3, Cl2, CO) từ chất rắn A và dung dịch B: Hỏi A, B, C có thể là những chất nào? Biết C nặng hơn không khí và không tác dụng với không khí. Giải: Có thể có các trường hợp sau: TH1 TH2 TH3 TH4 C Cl2 CO2 SO2 SO2 B Dd HCl Axit axit H2SO4 đặc nóng A MnO2 Muối cacbonat Muối sunfit Kim loại, S TH1: MnO2 + 4HCl MnCl2 + 2H2O + Cl2 TH2: CaCO3 + 2HCl CaCl2 + H2O + CO2 TH3: Na2SO3 + 2HCl 2NaCl + H2O + SO2 TH4: Cu + 2H2SO4(đặc nóng) CuSO4 + H2O + SO2 Bài 6. Cho hình vẽ sau là cách lắp đặt 1 thí nghiệm: Thí nghiệm trên dùng để điều chế chất gì? Và nước dưới đáy bình dùng để làm gì? Giải: Thí nghiệm trên dùng để điều chế Na2O. PTHH: 4Na + O2 2Na2O Na cháy tỏa nhiệt rất lớn, nước dưới đáy bình dùng để hấp thụ nhiệt tránh làm vỡ bình. Bài 7. Có hai thùng xăng, một thùng xăng đựng đầy tới nắp còn thùng kia thì đựng không đầy lắm. Nếu bị cháy thì hai trường hợp trên, trường hợp nào nguy hiểm hơn? Vì sao? Giải: Trong thùng xăng còn vơi, phía trên phần còn trống tạo ra một hỗn hợp hơi xăng với không khí có thể tạo ra phản ứng nổ ngay khi có tia lửa. Vì vậy nó nguy hiểm hơn thùng xăng đầy tới nắp, vì hơi xăng dễ gây cháy nổ hơn xăng lỏng. Bài 8. Vì sao than đá chất thành đống lớn có thể tự bốc cháy? Giải: Do than tác dụng với oxi trong không khí tạo thành CO2, phản ứng tỏa nhiệt, nhiệt tỏa ra tích góp dần, khi đạt tới nhiệt độ cháy của than thì than sẽ tự bốc cháy. PTHH: C + O2 CO2 Bài 9. Muốn dập tắt ngọn lửa do xăng dầu cháy, người ta thường trùm vải dày hoặc phủ cát lên ngọn lửa, mà không dùng nước. Giải thích vì sao? Giải: Không dùng nước vì xăng dầu không tan trong nước, nhẹ hơn nước, nổi lên trên mặt nước nên không những không dập tắt được đám cháy mà còn làm đám cháy lan rộng hơn. Để dập tắt đám cháy do xăng dầu, thường trùm vải dày hoặc phủ cát lên ngọn lửa để cách li ngọn lửa với oxi trong không khí. Bài 10. Các vận động viên khi leo lên các đỉnh núi cao thường mang theo các bình dưỡng khí Oxi. Em hãy giải thích tại sao như thế? Giải: Khí Oxi nặng hơn không khí: nên có xu hướng chìm xuống dưới. vì vậy càng lên cao oxi càng loãng. Để đảm bảo an toàn, các vận động viên khi leo lên các đỉnh núi cao thường mang theo các bình dưỡng khí. Bài 11. Sự việc đau lòng diễn ra vào khoảng 20h ngày 22/10/2019, tại ngõ 172 Đại Từ, phường Đại Kim, quận Hoàng Mai, Hà Nội, hai bố con xuống thau rửa bể nước ngầm của gia đình bị tử vong. Bằng kiến thức hóa học hãy nêu nghuyên nhân và cách phòng tránh những tai nạn đáng tiếc tương tự như trên. Giải: Khí cacbon đioxit trong không khí không có màu, không có mùi, không duy trì sự cháy và sự sống của con Người và động vật. Mặt khác tỉ khối của khí cacbon đioxit đối với không khí là: = 44/29 = 1,52. Khí cacbon đioxit nặng hơn không khí 1,52 lần. Vì vậy khí cacbon đioxit thường tích tụ trong đáy giếng khơi, trên nền hang sâu. Trong lòng đất luôn xảy ra sự phân hủy một số hợp chất vô cơ và hữu cơ, sinh ra khí độc như CO, SO2, H2S... Người và động vật xuống những nơi này sẽ bị chết ngạt. Để an toàn khi xuống những nơi như vậy cần quạt gió cho thông thoáng, hoặc quạt thông gió, hoặc đem theo bình dưỡng khí. Bài 12. Vào tháng 09/2019, 3 cầu thủ U14 của Sông Lam Nghệ An bị bóng bay phát nổ đến nỗi bị bỏng nặng phải nhập viện. bằng kiến thức hóa học hãy cho biết vì sao bóng bay phát nổ lại gây sát thương? Giải: Khí được bơm vào bóng bay thường là khí Hiđro, khí này dễ phát nổ khi gặp nguồn nhiệt. Hiđro khi nổ sẽ gây ra áp lực rất mianhj và nhiệt độ có thể lên tới 30000C. Do đó những vụ nổ thường gây nguy hiểm, làm bỏng da đối với những người đứng gần. Bài 13. Trong công nghiệp, khí NH3 mới điều chế bị lẫn hơi nước. Để làm khô khí NH3 người ta có thể dùng chất nào trong số các chất sau đây : H2SO4 đặc , P2O5, Na , CaO, KOH rắn ? Giải thích? Giải: Dùng CaO hoặc KOH để làm khô khí NH3 vì các chất này có khả năng hút ẩm mà không tác dụng với NH3. Không dùng các chất còn lại vì chúng tác dụng với NH3 hoặc tác dụng với H2O. H2SO4 + NH3 (NH4)2SO4 P2O5 + 3H2O + 6NH3 2(NH4)3PO4 2Na + 2H2O 2NaOH + H2 Bài 14. Khí hiđroclorua HCl bị lẫn hơi nước, chọn chất nào để loại nước ra khỏi hiđroclorua trong các chất sau: NaOH rắn, P2O5, CaCl2 khan , H2SO4 đặc. Giải thích? Giải: Dùng P2O5 hoặc H2SO4 đặc để làm khô khí HCl vì hai chất này có khả năng hút ẩm mà không tác dụng với HCl. Không dùng NaOH (vì NaOH tác dụng với HCl) và CaCl2 (vì CaCl2 hấp thụ HCl). NaOH + HCl NaCl + H2O Bài 15. Các khí CO, CO2, HCl đều lẫn nước. Hãy chọn chất để làm khô mỗi khí trên trong các chất sau: CaO, H2SO4 đặc, KOH rắn , P2O5. Giải thích sự lựa chọn? Giải: Có thể dùng 1 trong 4 chất trên để làm khô khí CO vì chúng đều có khả năng hút ẩm mà không tác dụng với CO. Dùng P2O5 hoặc H2SO4 đặc để làm khô CO2 và HCl. Vì chúng có khả năng hút ẩm mạnh mà không tác dụng với CO2 và HCl. Không dùng CaO và KOH rắn để làm khô CO2 và HCl vì chúng đều tác dụng với 2 khí trên. CaO + CO2 CaCO3 CaO + 2HCl CaCl2 + H2O 2KOH + CO2 K2CO3 + H2O KOH + HCl KCl + H2O Bài 16. Trong PTN điều chế Cl2 từ MnO2 và HCl đặc, nên khí Cl2 thường lẫn khí HCl và hơi nước. Để thu được Cl2 tinh khiết người ta dẫn hỗn hợp đi qua 2 bình mắc nối tiếp nhau, mỗi bình đựng một chất lỏng. Hãy xác định chất đựng trong mỗi bình. Giải thích bằng PTHH Giải: PTHH điều chế Cl2 trong phòng thí nghiệm từ MnO2 và HCl đặc: MnO2 + 4HCl MnCl2 + 2H2O + Cl2 Khí Cl2 sinh ra được dẫn qua bình 1 đựng dung dịch NaCl bão hào để hấp thụ khí HCl, sau đó khí thoát ra cho đi qua bình 2 đựng H2SO4 đặc để làm khô khí Cl2 (H2SO4 có khả năng hút ẩm tốt mà không tác dung với Cl2. Bài 17. Cho các chất khí sau bị lẫn hơi nước: N2, O2, CO2, SO2, NH3. Biết NH3 có tính chất hóa học của 1 bazơ tan. Khí nào được làm khô bằng: CaO H2SO4 (đặc) Giải: CaO hút âm tốt và không tác dụng với N2, O2, NH3. Nên có thể làm khô 3 khí này. CaO tác dụng với CO2 và SO2 nên không làm khô được 2 khí này: CaO + CO2 CaCO3 CaO + SO2 CaSO3 H2SO4 đặc hút ẩm tốt và không tác dụng với N2, O2, CO2 nên có thể làm khô 3 khí này. H2SO4 đặc tác dụng với NH3, SO2 nên không làm khô được 2 khí này. H2SO4 + NH3 (NH4)2SO4 Bài 18. Những khí nào sau đây có thể làm khô bằng H2SO4 đặc: CO, H2, CO2,SO2,O2 và NH3 (khi nó có lẫn hơi nước)? Giải thích? Giải: Có thể dùng H2SO4 đặc để làm khô các khí: SO2, CO2 Và O2 vì H2SO4 hút ẩm tốt mà không tác dụng với 3 chất này. Không dùng H2SO4 để làm khô CO, H2, SO2 vì H2SO4 tác dụng với cả 2 khí này: H2SO4 + CO CO2 + SO2 + H2O H2SO4 + H2 2H2O + SO2 Bài 19. Một hỗn hợp CuO và Fe2O3 . Chỉ được dùng Al và dung dịch HCl. Hãy nêu 2 cách để điều chế Cu nguyên chất. Giải: Cách 1: Nung nóng hỗn hợp với Al dư: Al + CuO Al2O3 + Cu Al + Fe2O3 Al2O3 + Fe Chất rắn thu được sau phản ứng: Fe, Cu, Al2O3, Al dư. Chất rắn thu được hòa tan trong HCl dư: Fe + HCl FeCl2 + H2 Al + HCl AlCl3 + H2 Al2O3 + HCl AlCl3 + H2O Chất rắn còn lại là Cu. Cách 2: điều chế H2 từ Al và HCl: Al + HCl AlCl3 + H2 Cho H2 dư đi qua hỗn hợp oxit nung nóng: H2 + CuO H2O + Cu H2 + Fe2O3 H2O + Fe Chất rắn thu được sau phản ứng: Cu, Fe được hòa tan trong HCl dư: Fe + HCl FeCl2 + H2 Chất rắn còn lại là Cu. Bài 20. Trong công nghiệp để điều chế CuSO4 người ta ngâm Cu kim loại trong H2SO4 loãng, sục O2 liên tục, cách làm này có lợi hơn hòa tan Cu trong dung dịch H2SO4 đặc nóng hay không? Tại sao? Nêu một số ứng dụng quan trọng của CuSO4 trong thực tế đời sống, sản xuất. Giải: PTHH: Cu + H2SO4(loãng) + O2 CuSO4 + 2H2O x x x mol Cu + 2H2SO4(đặc nóng) CuSO4 + H2O + SO2 x 2x x mol Điều chế CuSO4 bằng cách ngâm Cu trong dd H2SO4 loãng, sục O2 liên tục vào (PTHH: 1) thì không giải phóng SO2 (gây ô nhiễm môi trường) và tiết kiệm H2SO4 hơn so với cách hòa tan Cu trong dung dịch H2SO4 đặc. Bài 21. Bằng các phản ứng hóa học hãy điều chế : Na từ Na2SO4 ; Mg từ MgCO3, Cu từ CuS (các chất trung gian tự chọn ). Giải: Điều chế Na từ Na2SO4: Na2SO4 + BaCl2 BaSO4 + 2NaCl 2NaCl 2Na + Cl2 Điều chế Mg từ MgCO3: MgCO3 + HCl MgCl2 + H2O + CO2 MgCl2 Mg + Cl2 Điều chế Cu từ CuS: CuS + O2 CuO + SO2 CuO + H2 Cu + H2O. Bài 22. Từ không khí, nước, đá vôi, quặng Pirit sắt, nước biển. Hãy điều chế : Fe(OH)3, phân đạm 2 lá NH4NO3, phân đạm urê : (NH2)2CO. Giải: Điều chế Fe(OH)3: 4FeS2 + 11O2 2Fe2O3 + 8SO2 NaCl + H2O NaOH + H2 + Cl2 H2 + Cl2 2HCl Fe2O3 + 6HCl 2FeCl3 + 3H2O FeCl3 + 3NaOH Fe(OH)3 + 3NaCl Điều chế URE: CaCO3 CaO + CO2 N2 + H2 NH3 NH3 + CO2 (NH2)2CO + H2O Điều chế đạm 2 lá: 4NH3 + 5O2 4NO + 6H2O 2NO + O2 2NO2 4NO2 + O2 + 2H2O 4HNO3 HNO3 + NH3 NH4NO3 Bài 23. Từ mỗi chất: Cu, C, S, O2, H2S, FeS2, H2SO4, Na2SO3, hãy viết các PTHH điều chế trực tiếp SO2. Giải: PTHH: Cu + 2H2SO4(đặc nóng) CuSO4 + 2H2O + SO2 C + 2H2SO4(đặc nóng) CO2 + 2SO2 + 2H2O S + O2 SO2 7O2 + 4FeS 2Fe2O3 + 4SO2 2H2S + 3O2 2H2O + 2SO2 4FeS2 + 11O2 2Fe2O3 + 8SO2 3H2SO4 + 2Fe Fe2(SO4)3 + H2O + 3SO2 Na2SO3 + 2HCl 2NaCl + H2O + SO2 Bài 24. Từ các chất : Na2O, CuO, Fe2O3, H2O, H2SO4 . Hãy viết phương trình hóa học điều chế : NaOH, Fe(OH)3, Cu(OH)2. Giải: PTHH: CuO + H2SO4 CuSO4 + H2O Fe2O3 + 3H2SO4 Fe2(SO4)3 + 3H2O Na2O + H2O 2NaOH NaOH + Fe2(SO4)3 Na2SO4 + Fe(OH)3 NaOH + CuSO4 Na2SO4 + Cu(OH)2 Bài 25. Từ các dung dịch : CuSO4, NaOH , HCl, AgNO3 có thể điều chế được những muối nào ? những oxit bazơ nào ? Viết các phương trình hóa học để minh họa. Giải: Từ các dung dịch CuSO4, NaOH, HCl, AgNO3 có thể điều chế: CuO, Ag2O, CuCl2, Cu(NO3)2, Na2SO4, NaCl, NaNO3, AgCl, Ag2SO4: PTHH: CuSO4 + NaOH Cu(OH)2 + Na2SO4 Cu(OH)2 CuO + H2O AgNO3 + NaOH NaNO3 + H2O + Ag2O NaOH + HCl NaCl + H2O CuSO4 + AgNO3 Cu(NO3)2 + Ag2SO4 AgNO3 + HCl AgCl + HNO3 Bài 26. Từ Cu và các chất tuỳ chọn, em hãy nêu 2 phương pháp trực tiếp và 2 phương pháp gián tiếp điều chế CuCl2? Viết các phương trình phản ứng xảy ra? Giải: Điều chế trực tiếp CuCl2 từ Cu: Cu + Cl2 CuCl2 Cu + 2FeCl3 CuCl2 + 2FeCl2 Điều chế gián tiếp CuCl2 từ Cu: C1: 2Cu + O2 2CuO CuO + 2HCl CuCl2 + H2O C2: Cu + 2H2SO4(đặc nóng) CuSO4 + 2H2O + SO2 CuSO4 + BaCl2 CuCl2 + BaSO4 . Hết .
Tài liệu đính kèm:
 tai_lieu_36_chuyen_de_boi_duong_hoc_sinh_gioi_hoa_hoc_lop_9.docx
tai_lieu_36_chuyen_de_boi_duong_hoc_sinh_gioi_hoa_hoc_lop_9.docx





