Tài liệu 36 Chuyên đề bồi dưỡng học sinh giỏi Hóa học Lớp 9 và ôn thi vào Lớp 10 chuyên - Chuyên đề 24: Chuỗi phản ứng vô cơ
Bạn đang xem 20 trang mẫu của tài liệu "Tài liệu 36 Chuyên đề bồi dưỡng học sinh giỏi Hóa học Lớp 9 và ôn thi vào Lớp 10 chuyên - Chuyên đề 24: Chuỗi phản ứng vô cơ", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
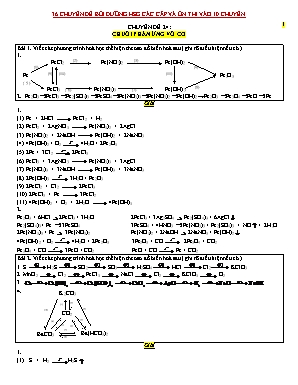
CHUYÊN ĐỀ 24: CHUỖI PHẢN ỨNG VÔ CƠ Bài 1. Viết các ph ương trình hoá học thể hiện theo sơ đồ biến hoá sau ( ghi rõ điều kiện nếu có ). 1. FeCl2 (2) Fe(NO3)2 (3) Fe(OH)2 (1) (4) Fe (9) (10) (11) Fe2O3 ( 5 ) FeCl3 ( 6) Fe(NO3)3 (7) Fe(OH)3 (8) 2. Fe2O3FeCl3Fe2(SO4)3FeSO4Fe(NO3)3Fe(NO3)2Fe(OH)2 ®Fe2O3 Fe3O4FeO Fe Giải 1. (1) Fe + 2HCl FeCl2 + H2 (2) FeCl2 + 2AgNO3 Fe(NO3)2 + 2AgCl (3) Fe(NO3)2 + 2NaOH Fe(OH)2 + 2NaNO3 (4) 4Fe(OH)2 + O2 4H2O + 2Fe2O3 (5) 2Fe + 3Cl2 2FeCl3 (6) FeCl3 + 3AgNO3 Fe(NO3)3 + 3AgCl (7) Fe(NO3)3 + 3NaOH Fe(OH)3 + 3NaNO3 (8) 2Fe(OH)3 3H2O + Fe2O3 (9) 2FeCl2 + Cl2 2FeCl3 (10) 2FeCl3 + Fe 3FeCl2 (11) 4Fe(OH)2 + O2 + 2H2O 4Fe(OH)3 2. Fe2O3 + 6HCl 2FeCl3 + 3H2O 2FeCl3 + 3Ag2SO4 Fe2(SO4)3 + 6AgCl Fe2(SO4)3 + Fe 3FeSO4 3FeSO4 + 4HNO3 Fe(NO3)3 + Fe2(SO4)3 + NO + 2H2O 2Fe(NO3)3 + Fe 3Fe(NO3)2 Fe(NO3)2 + 2NaOH 2NaNO3 + Fe(OH)2 4Fe(OH)2 + O2 4H2O + 2Fe2O3 3Fe2O3 + CO 2Fe3O4 + CO2 Fe3O4 + CO 3FeO + CO2 FeO + CO Fe + CO2 Bài 2. Viết các ph ương trình hoá học thể hiện theo sơ đồ biến hoá sau ( ghi rõ điều kiện nếu có ) 1. S H2S SO2 SO3 H2SO4 HCl Cl2 KClO3 2. MnO2 Cl2 FeCl3 NaCl Cl2 KClO3 O2 3. (1) (2) K2CO3 Ba(HCO3)2 BaCO3 CO2 (10) (9) (6) (5) (4) (3) (7) (8) 4. Giải 1. (1) S + H2 H2S (2) 2H2S + 3O2( dư) 2SO2 + 2 H2O (3) 2SO2 + O2 2SO3 (4) SO3 + H 2O ® H2SO4 (5) H2SO4 ( đặc) + NaCl ( rắn) NaHSO4 + HCl Có thể thay NaHSO4 bằng Na2SO4 ( tùy nhiệt độ) (6) MnO2 + 4HCl ( đặc) MnCl2 + Cl2 + 2H2O Có thể thay MnO2 bằng KMnO4 hay KClO3 (7) 3Cl2 + 6KOH 5KCl + KClO3 + 3 H2O 2. 1) MnO2 + 4HCl(đặc) MnCl2 + Cl2↑ + 2H2O 2) 3Cl2 + 2Fe 2FeCl3 3) FeCl3 + 3NaOH ® Fe(OH)3 + 3NaCl 4) 2NaCl + 2H2O H2 ↑ + Cl2↑ + 2NaOH 5) 3Cl2 + 6 KOH 5KCl + KClO3 + H2O 6) 2KClO3 2KCl + 3O2↑ 3. 1) Ca + 2H2O → Ca(OH)2 + H2↑ 2) Ca(OH)2 + 2CO2 → Ca(HCO3)2 3) Ca(HCO3)2 + 2HCl → CaCl2 + 2CO2↑ + 2H2O 4) CaCl2 + 2AgNO3 → Ca(NO3)2 + 2AgCl↓ 5) 2AgCl 2Ag + Cl2 6) Cl2+ 2NaOH → NaCl + NaClO + H2O 7) 2NaCl + 2H2O 2 NaOH + H2↑ +Cl2↑ 4. 1) CO2 + 2KOH K2CO3 + H2O 2) K2CO3 + 2HCl 2KCl + CO2 + H2O 3) 2CO2 + Ba(OH)2 Ba(HCO3)2 4) Ba(HCO3)2 + 2HCl BaCl2 + CO2 + H2O 5) CO2 + Ba(OH)2 BaCO3 + H2O 6) BaCO3 + 2HCl BaCl2 + CO2 + H2O 7) BaCO3 + CO2 + H2O Ba(HCO3)2 8) Ba(HCO3)2 BaCO3 + CO2 + H2O 9) Ba(HCO3)2 + 2KOH BaCO3 + K2CO3 + 2H2O 10) K2CO3 + BaCl2 BaCO3 + 2KCl Bài 3. Hãy xác định các chất X1, X2, X3, X4, X5, X6, X7, X8, X9, X10, X11 và viết phương trình hóa học của các phản ứng theo sơ đồ sau đây (ghi rõ điều kiện xảy ra, nếu có): a. X1 + X2 " MnCl2 + X3 + H2O b. X3 + H2 " X2 c. Na2SO3 + X2 " X4 +X5 + H2O d. NH4HCO3 + NaOH " Na2CO3 + X6 + H2O e. X3 + NaOH " X4 + X7 + H2O f. X6 + H2O + Al2(SO4)3 " X8 + (NH4)2SO4 g. FeSO4 + X9 " X10 + SO2 + H2O h. X3 + FeSO4 " X10 + X11 Hướng dẫn giải X1, X2, X3, X4, X5, X6, X7, X8, X9, X10, X11 lần lượt là: MnO2, HCl, Cl2, NaCl, SO2, NH3, NaClO, Al(OH)3, H2SO4,đ, Fe2(SO4)3, FeCl3 a) MnO2 + 4HCl MnCl2 + Cl2 + 2H2O b) Cl2 + H2 → 2HCl c) Na2SO3 + 2HCl → 2NaCl + SO2 + H2O d) NH4HCO3 + 2NaOH → Na2CO3 + NH3 + 2H2O e) Cl2 + 2NaOH → NaCl + NaClO + H2O f) 6NH3 + 6H2O + Al2(SO4)3 → 2Al(OH)3 + 3(NH4)2SO4 g) 2FeSO4 + 2H2SO4,đ Fe2(SO4)3 + SO2 + 2H2O h) 3Cl2 + 6FeSO4 → 2Fe2(SO4)3 + 2FeCl3 Bài 4. Chọn các chất X1, X2, X3, X4, X5, X6 thích hợp và hoàn thành các phương trình hoá học sau: (1) X1 + X2 ® Na2SO4 + BaSO4 + CO2 + H2O. (2) X1 + X3 ® Na2SO4 + BaSO4 + CO2 + H2O. (3) FeSO4 + X4 ® Fe2(SO4)3 + SO2 + H2O. (4) X2 + X5 ® BaCO3 + H2O. (5) X2 + X6 ® BaCO3 + CaCO3 + H2O. (6) X1 + X5 (dư) ® BaSO4 + NaOH + H2O. Hướng dẫn giải X1: NaHSO4; X2: Ba(HCO3)2; X3: BaCO3; X4: H2SO4 đặc; X5: Ba(OH)2; X6: Ca(OH)2 (1) 2NaHSO4 + Ba(HCO3)2 ® Na2SO4 + BaSO4↓ + 2CO2 + 2H2O (2) 2NaHSO4 + BaCO3 ® Na2SO4 + BaSO4↓ + CO2↑ + H2O (3) 2FeSO4 + 4H2SO4 đặc ® Fe2(SO4)3 + SO2↑ + 4H2O (4) Ba(HCO3)2 + Ba(OH)2 ® 2BaCO3↓ + 2H2O (5) Ba(HCO3)2 + Ca(OH)2 ® BaCO3↓ + CaCO3↓ + H2O (6) NaHSO4 + Ba(OH)2 (dư) ® BaSO4 + NaOH + H2O Bài 5. Viết PTHH của các phản ứng thực hiện sơ đồ biến hóa sau: Hướng dẫn giải A: NH3; B: CO2; X: CO(NH2)2; Y: (NH4)2CO3. PTHH: 2NH3 + CO2 CO(NH2)2 + H2O CO(NH2)2 + 2H2O ® (NH4)2CO3 (NH4)2CO3 + 2NaOH ® Na2CO3 + 2NH3↑ + H2O (NH4)2CO3 + H2SO4 ® (NH4)2SO4 + CO2 + H2O Bài 6. Cho các sơ đồ phản ứng: Oxit (X1) + dung dịch axit (X2) → (X3↑) + ... Oxit (Y1) + dung dịch bazơ (Y2) → (Y3↓) + ... Muối (Z1) (X1) + (Z2↑) + ... Muối (Z1) + dung dịch axit (X2) (X3↑) + ... Biết khí X3 có màu vàng lục, muối Z1 có màu tím. Xác định các chất X1, X2, X3, Y1, Y2, Y3, Z1, Z2. Viết PTHH minh họa. Hướng dẫn giải X1: MnO2; X2: HCl; X3: Cl2; Y1: CO2 ; Y2: Ca(OH)2 ; Y3: CaCO3 ; Z1: KMnO4; Z2: O2. PTHH: MnO2 + 4HCl đặc MnCl2 + Cl2↑ + 2H2O (X1) (X2) (X3) CO2 + Ca(OH)2 ® CaCO3↓ + H2O (Y1) (Y2) (Y3) 2KMnO4 K2MnO4 + MnO2 + O2↑ (Z1) (X1) (Z2) 2KMnO4 + 16HCl đặc 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O (Z1) (X2) (X3) Bài 7. Xác định các chất A, B, C, D, E, F và hoàn thành sơ đồ biến hóa sau (mỗi mũi tên là một phản ứng hóa học): A B C D E F A Biết A là đơn chất kim loại, B, C, D, E, F là một trong các loại hợp chất vô cơ đã học và chúng đều là hợp chất của kim loại A. Hướng dẫn giải Chọn A là Na và các chất B, C, D, E và F tương ứng lần lượng là: NaOH, NaHCO3, Na2CO3, Na2SO4 và NaCl Các phương trình phản ứng hóa học là: Bài 8. Xác định các chất và viết phương trình phản ứng xảy ra trong các sơ đồ sau: a) X1 + X2 + X3 HCl + H2SO4 b) A1 + A2 SO2 + H2O c) B1 + B2 NH3 + Ca(NO3)2 + H2O d) D1 + D2 + D3 Cl2 + MnSO4 + K2SO4 + Na2SO4 + H2O e) Y1 + Y2 Fe2(SO4)3 + FeCl3 g) Y3 + Y4 Na2SO4 + (NH4)2SO4 + H2O + CO2 Hướng dẫn giải Chất X1, X2, X3 lần lượt là SO2, H2O, Cl2: SO2 + 2H2O + Cl2 ® 2HCl + H2SO4 Chất A1, A2 lần lượt H2S và O2 (hoặc S và H2SO4 đặc ) 2H2S + 3O2 ® 2SO2 + 2H2O hoặc S + 2H2SO4 đặc 3SO2 + 2H2O Chất B1, B2 lần lượt NH4NO3 và Ca(OH)2. 2NH4NO3 + Ca(OH)2 ® 2NH3 + Ca(NO3)2 + 2H2O Chất D1, D2, D3 lần lượt là KMnO4, NaCl, H2SO4 đặc 2KMnO4 + 10NaCl + 8H2SO4 đặc ® 5Cl2 + 2MnSO4 + K2SO4 + 5Na2SO4 + 8H2O Chất Y1 , Y2 lần lượt là FeSO4 và Cl2 6FeSO4 + 3Cl2 ® 2Fe2(SO4)3 + 2FeCl3 Chất Y3 , Y4 lần lượt là (NH4)2CO3, NaHSO4 (NH4)2CO3 + 2NaHSO4 Na2SO4 + (NH4)2SO4 + H2O + CO2 Bài 9. Xác định các chất A1, A2, A3... A10 và hoàn thành các phương trình hóa học sau (ghi rõ điều kiện nếu có) (1) A1 + NaOH A2 + A3 ; (2) A3 + A4 A5 + NaOH (3) A3 + A6 A7 + NaCl ; (4) A7 + A4 A5 + NaOH + H2O (5) A1 + A6 A8 + NaCl ; (6) A9 + O2 A8 + H2O (7) A8 + Na A1 + A10 ; (8) A10 + O2 H2O. Hướng dẫn giải Xác định chất: A1 là CH3COONa ; A2 là CH4 ; A3 là Na2CO3 ; A4 là Ca(OH)2 ; A5 là CaCO3 ; A6 là HCl; A7 là NaHCO3; A8 là CH3COOH ; A9 là C2H5OH; A10 là H2 PTHH: (1) CH3COONa + NaOH CH4 + Na2CO3 (2) Na2CO3 + Ca(OH)2 CaCO3 + 2NaOH (3) Na2CO3 + HCl NaHCO3 + NaCl (4) NaHCO3 + Ca(OH)2 CaCO3 + NaOH + H2O (5) CH3COONa + HCl CH3COOH + NaCl (6) C2H5OH + O2 CH3COOH + H2O (7) 2CH3COOH + 2Na 2CH3COONa + H2 (8) 2H2 + O2 2H2O Bài 10. Xác định các chất vô cơ từ X1 đến X11 và viết phương trình hóa học của các phản ứng sau: (1) X1 + X2 ® X3 + X4; (2) X3 + X5 ® X6 + X7; (3) X6 + X8 + X9 ® X10; (4) X10 ® X11 + X8; (5) X11 + X4 ® X1 + X8. Biết X3 là muối sắt clorua và nếu lấy 1,27 gam X3 tác dụng hết với dung dịch AgNO3 dư, thu được 3,95 gam kết tủa. Hướng dẫn giải Nếu X3: FeCl3Þmol FeCl2 = 1,27: 162,5 = 0,0078 mol FeCl3 + 3AgNO3 ® Fe(NO3)3 + 3AgCl 0,0078 mol 0,0078 mol Þ m kết tủa = mAgCl = 0,0078.3. 143,5 = 3,3579 gam (không phù hợp) Nếu X3: FeCl2Þmol FeCl2 = 1,27: 127 = 0,01 mol FeCl2 + AgNO3 ® Fe(NO3)3 + Ag + 2AgCl 0,01 mol 0,01 mol 0,02 mol Þ m kết tủa = mAg + mAgCl = 0,01. 108 + 0,02.(143,5) = 3,95 gam (hợp lí) X1 X2 X3 X4 X5 X6 X7 X8 X9 X10 X11 Fe HCl FeCl2 H2 NaOH Fe(OH)2 NaCl H2O O2 Fe(OH)3 Fe2O3 * Phản ứng: (1) Fe +2HCl ® FeCl2 + H2 (2) FeCl2 + 2NaOH®Fe(OH)2 + 2NaCl (3) 4Fe(OH)2 + 2H2O + O2 ®4Fe(OH)3 (4) 2Fe(OH)3 Fe2O3+3H2O (5) Fe2O3 + 3H2 2Fe + H2O Bài 11. Có những chất: Fe2O3, Al2O3, FeCl3, Fe, Fe(OH)3, Al. a. Dựa vào mối quan hệ giữa các chất, hãy sắp xếp các chất trên thành một dãy chuyển đổi hoá học (không phân nhánh), mỗi chất chỉ được xuất hiện một lần. b. Viết phương trình hoá học cho dãy chuyển đổi hoá học trên. Hướng dẫn giải a. Có nhiều cách sắp xếp, dưới đây là một cách: Al2O3 Al Fe FeCl3 Fe(OH)3 Fe2O3 b. Phương trình hoá học cho dãy chuyển đổi hoá học trên. (1) 2Al2O34Al + 3O2 (2) 2Al + 3CuCl2 ® 2AlCl3 + 3Cu (3) 2Fe + 3Cl2 2FeCl3 (4) FeCl3 + 3NaOH ® Fe(OH)3 + 3NaCl (5) 2Fe(OH)3 Fe2O3 + 3H2O Bài 12. 1. Chọn các chất phù hợp và viết phương trình hóa học thực hiện sơ đồ chuyển hóa sau: Cho biết khối lượng mol phân tử của các chất thỏa mãn: ; ; . 2. Chọn các chất phù hợp và hoàn thành các phương trình hóa học sau: a) KMnO4 A1 + A2 + O2 (1) A1 + HCl (đặc) Cl2 + + + (2) A2 + HCl (đặc) Cl2+ + (3) b) B1 + B2 BaSO4 + CO2 + + (1) B1 + BaCl2 BaSO4 + + (2) B2 + H2SO4 BaSO4 + ... + (3) B2 + NaOH B3 + CO2 + (4) Hướng dẫn giải 1. Khí X1 có màu vàng lục X1 là Cl2. Từ màu sắc của các chất Y, Y1, Y2, Y3 Y3 là Cu; Y là CuO; các dung dịch Y1, Y2 là muối đồng (II) Y4 là CuSO4. Ta có: Mặt khác: X phản ứng trực tiếp với HCl tạo Cl2 X là MnO2. X3 có X3 là hợp chất của clo X3 là FeCl3 X2 là BaCl2 M là BaSO4 Y2 là Cu(NO3)2 Y1 là CuCl2 Như vậy, ta có sơ đồ chuyển hóa sau: Các PTHH: MnO2 + 4HCl (đặc) MnCl2 + Cl2 + 2H2O (1) Cl2 + Ba BaCl2 (2) 3BaCl2 + Fe2(SO4)3 3BaSO4 + 2FeCl3 (3) 2FeCl3 + 3Ba(OH)2 2Fe(OH)3 + 3BaCl2 (4) CuO + 2HCl CuCl2 + H2O (5) CuCl2 + 2AgNO3 Cu(NO3)2 + 2AgCl (6) Cu(NO3)2 + Fe Cu + Fe(NO3)2 (7) Cu + 2H2SO4 đặc CuSO4 + SO2 + 2H2O (8) CuSO4 + BaCl2 CuCl2 + BaSO4 (9) 2. a) 2KMnO4 K2MnO4 + MnO2 + O2 (A1) (A2) (1) K2MnO4 + 8HCl (đặc) 2Cl2 + MnCl2 + 2KCl + 4H2O (A1) (2) MnO2 + 4HCl (đặc) Cl2+ H2O + MnCl2 (A2) (3) b) 2NaHSO4 + Ba(HCO3)2 BaSO4 + 2CO2 + Na2SO4 + 2H2O (B1) (B2) (1) NaHSO4 + BaCl2 BaSO4 + NaCl + HCl (B1) (2) Ba(HCO3)2 + H2SO4 BaSO4 + 2CO2 + 2H2O (B2) (3) Ba(HCO3)2 + 2NaOH BaCO3 + Na2CO3 + 2H2O (B2) (4) Bài 13. Xác định các chất vô cơ A, B, C, D, E, F, G, H, I, L, M, N, O và viết phương trình hóa học phù hợp với các phản ứng sau: Biết muối (C) khi đốt phát ra ánh sáng màu vàng, (F) lưỡng tính, (O) có màu nâu. Hướng dẫn giải Muối (A) + axit (B) →muối (C) + muối (D) + nước (1) 2NaAlO2 + 3H2SO4 →Na2SO4 + Al2(SO4)3 + 3H2O Muối (D) + muối (E) + nước → muối (C) + hidroxit(F) + oxit(G) (2) Al2(SO4)3 + 3Na2CO3 + 3H2O → 3Na2SO4 + 2Al(OH)3 + 3CO2 Muối (A) + oxit (G) + nước → hidroxit (F) + muối (H) (3) NaAlO2 + CO2 + 2H2O → Al(OH)3 + NaHCO3 Muối (H) + muối (I) → muối (C) + oxit (G) + nước (4) NaHCO3 + NaHSO4 → Na2SO4 + CO2 + H2O Muối (L) + axit (B) muối (M) + oxit (G) + oxit (N) + nước (5) 2FeCO3 + 4H2SO4 Fe2(SO4)3 + 2CO2 + SO2+4H2O Muối (A) + muối (D) + nước →hidroxit (F) + muối (C) (6) 6NaAlO2 + Al2(SO4)3 + 12H2O → 8Al(OH)3 + 3Na2SO4 Muối (M) + muối (E) + nước → muối (C) + hidroxit(O) + oxit (G) (7) Fe2(SO4)3 + 3Na2CO3 + 3H2O → 3Na2SO4 + 2Fe(OH)3 + 3CO2 Hidroxit (O) + muối (I) → muối (C) + muối (M) + nước (8) 2Fe(OH)3 + 6NaHSO4 → 3Na2SO 4 + Fe2(SO4)3 + 6H2O CHUỖI PHẢN ỨNG HỮU CƠ Bài 14. Viết các phương trình phản ứng theo sơ đồ chuyển hóa sau và ghi điều kiện (nếu có). CH3COOH CH3COONa CH4 HCl (8) (4) CH3COONa NaOH NaCl MgCl2 Hướng dẫn giải 2CH3COOH +2Na → 2CH3COONa + H2 (1) CH3COONa(r) + NaOH(r) CH4 + Na2CO3 (2) CH4 + HCl CH3Cl + HCl (3) 2HCl + Mg → MgCl2 + H2 (4) MgCl2 + Na2CO3 → 2NaCl + MgCO3 (5) 2NaCl + 2H2O 2NaOH + Cl2 + H2 (6) NaOH + CH3COOH → CH3COONa + H2O (7) 2CH3COONa + H2SO4 → 2CH3COOH + Na2SO4 (8) Bài 15. Viết các phương trình hóa học để thực hiện dãy chuyển hóa sau (ghi điều kiện nếu có): Hướng dẫn giải CH3COONa + NaOH CH4 + Na2CO3 Al4C3 + H2O Al(OH)3 + CH4 2CH4C2H2 + 3H2 C2H2 + H2 C2H4 nCH2=CH2 (-CH2-CH2-)n 3C2H2 C6H6 C2H2 + HCl C2H3Cl Bài 16. Viết các phương trình hóa học biểu diễn chuyển đổi hóa học sau: Hướng dẫn giải C2H4 + H2O C2H5OH C6H12O6C2H5OH + H2O C2H5OH + O2CH3COOH + H2O 2 CH3COOH + 2Na2CH3COONa + H2 2 C4H10 + 5O2 4 CH3COOH + 2H2O CH3COONa + NaOHCH4 + Na2CO3 Al4C3 + 12 HCl 4 AlCl3+ 3 CH4 2 CH4C2H2 + 2 H2 C2H2 + H2C2H4 (10) CaC2 + 2H2O C2H2 + Ca(OH)2 Bài 17. Hoàn thành sơ đồ biến hóa sau (ghi rõ điều kiện nếu có) G ABCCao su Buna Dancol etylic EF G Biết G là thành phần chính của khí thiên nhiên. Hướng dẫn giải G là thành phần chính của khí thiên nhiên: CH4 PTHH: (1) 2CH4 C2H2 + 3H2 (2) 2C2H2 CH C ─CH = CH2 (3) CH C ─CH = CH2 + H2 CH2 = CH ─ CH = CH2 (4) CH2 = CH ─ CH = CH2 ( CH2 ─ CH = CH ─CH2 )n (5) C2H2 + H2 CH2= CH2 (6) C2H4 + H2O C2H5OH (7) C2H5OH + O2 CH3COOH + H2O (8) CH3COOH + NaOH CH3COONa + H2O (9) CH3COONa + NaOH CH4 + Na2CO3 Bài 18. Cho các chất: CH4, C2H4, C2H2, PE, C2H5OH, CH3COONa. Dựa vào mối quan hệ giữa các chất, hãy sắp xếp các chất đã cho thành một dãy chuyển hóa sao cho mỗi chất chỉ xuất hiện một lần và viết phương trình hóa học theo dãy chuyển hóa đó. Hướng dẫn giải Dãy chuyển hóa: PTHH: CH3COONa + NaOH CH4 + Na2CO3 2CH4 C2H2 + 3H2 C2H2 + H2 C2H4 C2H4 + H2O CH3CH2OH C2H5OH C2H4 + H2O nCH2=CH2 Bài 19. Tìm các chất tương ứng với các kí hiệu: A, B, C, D, E, F (A là thành phần chính của khí thiên nhiên) và viết phương trình phản ứng hóa học thực hiện các chuyển đổi theo sơ đồ sau: (ghi rõ điều kiện nếu có) (6) F Poli (vinyl clorua) A B C D E Etyl axetat (8) Polietilen Hướng dẫn giải A là thành phần chính của khí thiên nhiên Þ A là CH4 Þ B: C2H2, C: C2H4, D: C2H5OH, E: CH3COOH, F: CH2=CH-Cl Các PTHH: 2CH4 C2H2 +3H2 C2H2 + H2 C2H4 C2H4 + H2O C2H5OH C2H5OH + O2 CH3COOH + H2O CH3COOH + C2H5OH CH3COOC2H5 + H2O (6) CH≡CH + HCl CH2=CHCl (7) nCH2=CHCl (-CH2-CH(Cl)-)n (8) nCH2=CH2 (-CH2-CH2-)n NHẬN BIẾT Bài 20. Trình bày phương pháp hóa học để nhận biết sự có mặt của các khí trong hỗn hợp khí gồm: CO2, SO2, CO, H2. Hướng dẫn giải - Cho hỗn hợp khí gồm: CO2, SO2, CO, H2 qua dung dịch Brom dư, thấy dung dịch brom bị mất màu chứng tỏ trong hỗn hợp có chứa khí SO2. SO2 + Br2 + 2H2O ® 2HBr + H2SO4 - Cho hỗn hợp khí thoát ra gồm CO2, CO, H2 qua dung dịch Ca(OH)2 dư, thấy xuất hiện kết tủa trắng. trong hỗn hợp có chứa khí CO2 CO2 + Ca(OH)2 ® CaCO3↓ + H2O - Hỗn hợp khí thoát ra (CO, H2) dẫn qua CuO dư, nung nóng. Làm lạnh hỗn hợp khí sau phản ứng thấy có hơi nước sinh ra chứng tỏ hỗn hợp ban đầu chứa khí H2. Khí còn lại dẫn qua dung dịch nước vôi trong thấy nước vôi trong bị vẫn đục, chứng tỏ khí ban đầu có CO. PTHH: CO + CuO Cu + CO2 H2 + CuO Cu + H2O CO2 + Ca(OH)2 ® CaCO3↓ + H2O Bài 21. Một hỗn hợp gồm các oxit: CO, CO2, SO2, SO3. Cần dùng các phản ứng hóa học nào để nhận ra từng oxit trong hỗn hợp? Hướng dẫn giải - Dẫn hỗn hợp khí đi qua dung dịch BaCl2 có kết tủa màu trắng trong hỗn hợp có chứa khí SO3 SO3 + BaCl2 + H2O → BaSO4 + HCl - Cho hỗn hợp khí gồm: CO2, SO2, CO qua dung dịch Brom dư, thấy dung dịch brom bị mất màu chứng tỏ trong hỗn hợp có chứa khí SO2. SO2 + Br2 + 2H2O ® 2HBr + H2SO4 - Cho hỗn hợp khí thoát ra gồm CO2, CO qua dung dịch Ca(OH)2 dư, thấy xuất hiện kết tủa trắng. trong hỗn hợp có chứa khí CO2 CO2 + Ca(OH)2 ® CaCO3↓ + H2O - Khí thoát ra (CO) dẫn qua CuO dư, nung nóng rồi dẫn khí sinh ra qua dung dịch nước vôi trong thấy nước vôi trong bị vẫn đục, chứng tỏ khí ban đầu có CO. PTHH: CO + CuO Cu + CO2 CO2 + Ca(OH)2 ® CaCO3↓ + H2O Bài 22. Dùng phương pháp hóa học nhận biết các bình khí mất nhãn chứa hỗn hợp các khí sau: (CH4, C2H4, CO2) ; (CH4, C2H4, SO2) ; (CH4, C2H4, C2H2) và (N2, H2, CO2). Viết các phương trình phản ứng xảy ra. Hướng dẫn giải - Lấy các mẫu thử làm thí nghiệm - Dẫn các hỗn hợp khí trên qua bình đựng nước vôi trong dư. + Hỗn hợp khí không xuất hiện kết tủa trắng là (CH4, C2H4, C2H2). + Hỗn hợp kết tủa trắng xuất hiện là (CH4, C2H4, CO2) ; (CH4, C2H4, SO2); (N2, H2, CO2) CO2 + Ca(OH)2 ® CaCO3¯ + H2O SO2 + Ca(OH)2 ® CaSO3¯ + H2O - Dẫn 3 mẫu hỗn hợp khí còn lại lần lượt qua bình đựng nước Br2 dư. + Hỗn hợp khí làm nhạt màu nước Br2 dư là (CH4, C2H4, CO2) và (CH4, C2H4, SO2) (Nhóm I) C2H4 + Br2 ® C2H4Br2 C2H2 + 2Br2 ® C2H2Br4 + Hỗn hợp khí không làm nhạt màu nước Br2 dư là (N2, H2, CO2). - Hai hỗn hợp khí trong nhóm I dẫn lần lượt dẫn qua bình thứ nhất đựng nước Br2 dư, sau đó dẫn sản phẩm khí thoát ra vào các bình đựng nước vôi trong dư + Hỗn hợp khí xuất hiện kết tủa trắng là chứa (CH4, C2H4, CO2) + Hỗn hợp khí không xuất hiện kết tủa trắng là chứa (CH4, C2H4, SO2) SO2 + Br2 + H2O ® 2HBr + H2SO4 CO2 + Ca(OH)2 ® CaCO3¯ + H2O Bài 23. Chỉ được dung thêm hai thuốc thử (tự chọn) để phân biệt các chất bột sau: magie oxit, điphotpho pentaoxxit, bari oxit, natri sunfat, nhôm oxit. Viết phương trình hóa học của các phản ứng xảy ra (nếu có). Hướng dẫn giải Sơ đồ: - Trích lấy mẫu thử vào các ống nghiệm và đánh số thứ tự. - Nhỏ H2O dư vào lần lượt các mẫu thử: + Ống nghiệm chứa chất rắn tan trong nước là chứa: P2O5, BaO, Na2SO4 (Nhóm 1) P2O5 + H2O H3PO4 BaO + H2O Ba(OH)2 + Ống nghiệm chứa chất rắn không tan trong nước là chứa: MgO, Al2O3 (Nhóm 2) - Nhỏ lần lượt các dung dịch thu được trong nhóm 1 lên mẩu giấy quỳ tím. + Dung dịch làm quỳ tím chuyển sang màu đỏ là chứa H3PO4 chất ban đầu là P2O5 + Dung dịch làm quỳ tím chuyển sang màu xanh là chứa Ba(OH)2 chất ban đầu là BaO + Dung dịch không làm quỳ tím đổi màu là chứa Na2SO4. - Lấy dung dịch Ba(OH)2 thu được ở trên nhỏ vào lần lượt 2 mẫu thử trong nhóm 2. + Chất rắn tan trong dung dịch Ba(OH)2 là Al2O3 Ba(OH)2 + Al2O3 Ba(AlO2)2 + H2O + Chất rắn không tan trong dung dịch Ba(OH)2 là MgO Bài 24. Cho 4 chất khí: CO2, C2H4, Cl2, CH4 đựng trong 4 bình riêng biệt mất nhãn. Trình bày phương pháp hóa học để phân biệt mỗi bình trên và viết các phương trình phản ứng xảy ra. Các dụng cụ thí nghiệm có đủ. Hướng dẫn giải - Cho mẩu quỳ ẩm vào miệng các bình khí + Khí làm quỳ ẩm chuyển thành màu đỏ sau đó mất màu là Cl2. Cl2 + H2O HCl + HClO + Khí còn lại là CO2, C2H4, CH4 (Nhóm I) - Dẫn 3 khí trong nhóm (I) vào dung dịch nước vôi trong dư + Khí làm đục nước vôi trong là CO2. CO2 + Ca(OH)2 → CaCO3 + H2O + Không có hiện tượng gì là chứa C2H4, CH4 (Nhóm II) - Dẫn 2 khí trong nhóm II qua dung dịch Br2 C2H4 + Br2 → C2H4Br2 + Khí làm mất (hoặc nhạt màu dung dịch Br2) là C2H4. + Khí còn lại không có hiện tượng gì là CH4 Bài 25. Cho các hóa chất: Na, MgCl2, FeCl2, FeCl3, AlCl3. Chỉ dùng thêm H2O trình bày cách phân biệt mỗi chất và viết phương trình hóa học xảy ra Hướng dẫn giải - Trích các chất làm mẫu thử và đánh số thứ tự, cho nước lần lượt vào các mẫu thử và lắc đều: + Mẫu thử tan và sủi bọt khí là Na + Các mẫu thử còn lại tan và không có hiện tượng gì: MgCl2, FeCl2, FeCl3, AlCl3 - Dùng dung dịch NaOH vừa thu được ở trên làm thuốc thử lần lượt cho vào các dung dịch thu được: + Mẩu thử của dung dịch nào xuất hiện kết tủa trắng là MgCl2 MgCl2 + 2NaOH Mg(OH)2 + 2NaCl + Mẫu thử của dung dịch nào xuất hiện kết tủa trắng xanh, bị hóa nâu trong không khí là FeCl2 FeCl2 + 2NaOH Fe(OH)2 + 2NaCl Fe(OH)2 + H2O + O2 Fe(OH)3 + Mẩu thử của dung dịch nào xuất hiện kết tủa nâu đỏ là FeCl3 FeCl3 + 3NaOH Fe(OH)3 + 3NaCl + Mẫu thử của dung dịch nào ban đầu xuất hiện kết tủa trắng keo, sau tan dần trong NaOH dư tạo dung dịch trong suốt là AlCl3 AlCl3 + 3NaOH Al(OH)3 + 3NaCl Al(OH)3 + NaOH NaAlO2 + H2O Bài 26. Chỉ dùng thêm nước và các điều kiện thí nghiệm cần thiết, hãy nêu phương pháp nhận biết 5 gói bột màu trắng của 5 chất sau; KCl, Ba(HCO 3)2, K2CO3, MgCl2, K2SO4 Hướng dẫn giải - Trích mỗi lọ ít làm mẫu thử - Cho thêm nước vào các mẫu thử - Đun nóng nhẹ các mẫu thử. + Mẫu thử xuất hiện kết tủa trắng đồng thời sủi bọt khí thì đó là Ba(HCO3)2 Ba(HCO3)2 BaCO3 + CO2 + H2O - Dùng Ba(HCO3)2 vừa nhận được nhỏ vào lần lượt các mẫu thử trên ta thu được kết quả sau: + Nhóm 1: Tạo kết tủa trắng với Ba(HCO3)2 là K2CO3 và K2SO4 Ba(HCO3)2 + K2CO3 BaCO3 + 2KHCO3 Ba(HCO3)2 + K2SO4 BaSO4 + 2KHCO3 + Nhóm 2: Không hiện tượng gì bao gồm KCl, MgCl2 - Trích từng mẫu thử ở nhóm 1 cho vào nhóm 2. + Mẫu xuất hiện kết tủa trắng thì mẫu thử trong nhóm 1 là K2CO3 và mẫu thử nhóm 2 là MgCl2 + Mẫu còn lại trong nhóm 1 là K2SO4 và nhóm 2 là KCl MgCl2 + K2CO3 MgCO3 + 2KCl Bài 27. Có 3 dung dịch: NaOH, HCl, H2SO4 có cùng nồng độ mol. Chỉ dùng thêm quỳ tím có thể nhận biết được ba dung dịch trên hay không? Viết các phương trình phản ứng hóa học xảy ra. Hướng dẫn giải - Lấy cùng thể tích 3 mẫu thử. Cho quỳ tím vào 3 mẫu. + Mẫu làm quỳ đổi màu xanh là NaOH. + Mẫu không làm quỳ đổi màu là HCl, H2SO4 - Lấy 2 mẫu dd NaOH có cùng thể tích (như trên) cho vào 2 mẫu axit HCl, H2SO4 có cùng thể tích. + Dung dịch sản phẩm nào làm quỳ không đổi màu là dung dịch HCl vì NaOH và HCl phản ứng vừa đủ tạo dung dịch trung hoà. HCl + NaOH ® NaCl + H2O + Dung dịch sản phẩm nào làm quỳ hoá đỏ là dung dịch H2SO4 H2SO4 + 2NaOH ® Na2SO4 + 2H2O (do sau phản ứng axit dư) Bài 28. Có 4 gói phân bón có công thức hóa học như sau: KCl, NH4NO3, Ca(H 2PO4)2, CO(NH2) 2. Chỉ dùng vôi sống và nước, hãy nhận biết 4 gói phân bón trên. Hướng dẫn giải - Trích mẫu thử và đánh số thứ tự - Hòa tan các mẫu thử vào nước - Cho vôi sống vào nước đến khi phản ứng xảy ra hoàn toàn, lọc lấy phần dung dịch trong suốt Ca(OH)2 CaO + H 2O Ca(OH)2 - Cho dung dịch Ca(OH)2 lần lượt vào các ống nghiệm chứa các dung dịch mẫu thử + Mẫu thử xuất hiện kết tủa trắng là: Ca(H2PO4)2 Ca(H2PO4 )2 + 2Ca(OH)2 Ca3(PO4)2 + 2H2O + Mẫu thử xuất hiện chất khí có mùi khai thì đó là NH4NO3: 2NH4NO3 + Ca(OH)2 Ca(NO3)2 + 2NH3 + 2H2O + Mẫu thử vừa có kết tủa trắng vừa có mùi khai thóat ra là CO(NH2)2 CO(NH2)2 + 2H2O (NH4 )2CO3 (NH4)2 CO3 + Ca(OH)2 CaCO3 + 2NH3 + 2H2O Bài 29. Có 6 chất rắn đựng trong 6 lọ riêng biệt, mất nhãn là: Na2CO3, Na2SO4, MgCO3, BaCO3, BaSO4, CuSO4. Chỉ dùng thêm một thuốc thử, hãy nhận biết các chất rắn trên bằng phương pháp hóa học (viết các phương trình hóa học của phản ứng xảy ra). Hướng dẫn giải - Đánh số thứ tự, trích mẫu thử: - Nhỏ dung dịch H2SO4 dư lần lượt vào các mẫu thử. + Mẫu thử tan và có sủi bọt khí là chứa Na2CO3, MgCO3 (Nhóm 1) Na2CO3 + H2SO4 Na2SO4 + CO2 + H2O MgCO3 + H2SO4 MgSO4 + CO2 + H2O + Mẫu thử tan nhưng không có khí bay lên là: Na2SO4 + Mẫu thử không tan là BaSO4 + Mẫu thử tan, có khí bay lên và xuất hiện kết tủa trắng là BaCO3 BaCO3 + H2SO4 BaSO4 + CO2 + H2O - Nung nóng các mẫu chất trong nhóm 1 đến khối lượng không đổi thu được sản phẩm tương ứng là Na2CO3 và MgO (Nhóm 2) MgCO3 MgO + CO2 - Cho H2SO4 vào các mẫu thử của nhóm 2, nếu: + Mẫu thử tan và có khí bay lên là Na2CO3 Na2CO3 + H2SO4 Na2SO4 + CO2 + H2O + Mẫu thử tan là MgO, từ đó xác định chất ban đầu tương ứng là MgCO3 MgO + H2SO4 MgSO4 + H2O Bài 30. Cho 5 dung dịch không màu gồm: NaCl, Na2CO3, BaCl2, HCl và Na2SO4 chứa trong các lọ riêng biệt bị mất nhãn. Không dùng thêm hóa chất nào khác, bằng phương pháp hóa học hãy phân biệt các dung dịch trên. Viết phương trình hóa học của các phản ứng. Hướng dẫn giải Trích các chất làm mẫu thử cho vào 5 ống nghiệm đánh số thứ tự. Cho các mẫu thử lần lượt tác dụng với nhau ta được kết quả sau: NaCl Na2CO3 BaCl2 HCl Na2SO4 NaCl Na2CO3 Kết tủa trắng Sủi bọt khí BaCl2 Kết tủa trắng Kết tủa trắng HCl Sủi bọt khí Na2SO4 Kết tủa trắng Qua bảng tổng hợp ta nhận biết được: + Mẫu không có hiện tượng xảy ra là chứa dung dịch NaCl. + Mẫu có xuất hiện 1 kết tủa trắng và 1 sủi bọt khí là chứa dung dịch Na2CO3 Na2CO3 + BaCl2 → 2NaCl + BaCO3 Na2CO3 + 2HCl → 2NaCl + CO2 + H2O + Mẫu xuất hiện 2 kết tủa trắng là chứa dung dịch BaCl2 Na2CO3 + BaCl2 → 2NaCl + BaCO3 Na2SO4 + BaCl2 → 2NaCl + BaSO4 + Mẫu nào có 1 sủi bọt khí làchứa dung dịch HCl: Na2CO3 + 2HCl → 2NaCl + CO2 + H2O + Mẫu nào xuất hiện 1 kết tủa trắng là chứa dung dịch Na2SO4: Na2SO4 + BaCl2 → 2NaCl + BaSO4 Bài 31. Có 6 lọ dung dịch được đánh số ngẫu nhiên từ 1 đến 6. Mỗi dung dịch chứa một chất tan trong các chất: BaCl2, H2SO4, NaOH, MgCl2, Na2CO3, HCl. Người ta tiến hành các thí nghiệm và thu được kết quả như sau: - Thí nghiệm 1: Dung dịch 2 cho kết tủa khi tác dụng với các dung dịch 3 và 4. - Thí nghiệm 2: Dung dịch 6 cho kết tủa khi tác dụng với các dung dịch 1 và 4. - Thí nghiệm 3: Dung dịch 4 cho khí bay lên khi tác dụng với các dung dịch 3 và 5. Hướng dẫn giải - Từ thí nghiệm 3: dung dịch 4 cho khí bay lên khi tác dụng với các dung dịch 3 và 5. Dung dịch 4 phải là Na2CO3; dung dịch 3, 5 là H2SO4 hoặc HCl - Mà từ thí nghiệm 1, dung dịch 2 cho kết tủa khi tác dụng với các dung dịch 3 và 4. Dung dịch 2 là BaCl2, dung dịch 3 là H2SO4 còn dung dịch 5 là HCl - Từ thí nghiệm 2, dung dịch 6 cho kết tủa khi tác dụng với các dung dịch 1 và 4. Dung dịch 6 là MgCl2 còn dung dịch 1 là NaOH Vậy dung dịch 1 là: NaOH dung dịch 4 là: Na2CO3 dung dịch 2 là: BaCl2 dung dịch 5 là: HCl dung dịch 3 là: H2SO4 dung dịch 6 là: MgCl2 Các phương trình phản ứng hóa học xảy ra: - Thí nghiệm 1: BaCl2 + H2SO4 → BaSO4 ↓ + 2HCl BaCl2 + Na2CO3 → BaCO3 ↓ + 2NaCl - Thí nghiệm 2: MgCl2 + 2NaOH → Mg(OH)2↓ + 2NaCl MgCl2 + Na2CO3 → MgCO3↓ + 2NaCl - Thí nghiệm 3: Na2CO3 + H2SO4 ↓ → Na2SO4 + CO2↑ + H2O Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O Bài 32. Có các chất A, B, C, D, E. Chất nào là: benzen, rượu etylic, axit axetic, etilen, nước? Biết kết quả của những thí nghiệm như sau: (bảng tác dụng của các chất với: natri kim loại, canxi cacbonat, dung dịch brom và đốt trong không khí)Viết các phương trình hóa học theo kết quả của các thí nghiệm. Chất Na CaCO3 Br2 Đốt trong không khí A Khí bay ra Không phản ứng Không phản ứng Dễ cháy B Không phản ứng Không phản ứng Dung dịch Br2 mất màu Có cháy C Khí bay ra Không phản ứng Không phản ứng Không cháy D Khí bay ra Khí bay ra Không phản ứng Có cháy E Không phản ứng Không phản ứng Không phản ứng Dễ cháy Hướng dẫn giải - A tác dụng với Na tạo ra khí, không phản ứng với CaCO3, không phản với Br2 và dễ cháy trong không khí A là: C2H5OH (rượu etylic) - B không phản ứng với Na, không phản ứng với CaCO3, làm dung dịch Br2 mất màu và có cháy trong không khí B là: Etilen (C2H4) - C tác dụng với Na tạo khí bay ra, không phản ứng với CaCO3, không phản ứng với dd Br2 và không cháy trong không khí C là: Nước (H2O) - D tác dung với Na tạo khí bay ra, phản ứng với CaCO3 tạo khí bay ra, không phản ứng với dung dịch Br2 và dễ cháy trong không khí D là: Axit axetic (CH3COOH) - E không phản ứng với Na, không phản ứng với CaCO3, không phản với dung dịch Br2 và dễ cháy trong không khí E là: Benzen (C6H6) Các phương trình hóa học: 2C2H5OH + 2Na → 2C2H5ONa + H2 (1) C2H6O + 3O2 2CO2 + 3H2O (2) CH2=CH2 + Br-Br → CH2Br-CH2Br (3) C2H4 + O2 2CO2 + H2O (4) 2Na + 2H2O → 2NaOH + H2 (5) 2CH3COOH + 2Na → 2CH3COONa + H2 (6) CH3COOH + CaCO3 → (CH3COO)2Ca + H2O + CO2 (7) C2H4O2 + 2O2 2CO2 + 2H2O (8) 2C6H6 + 15 O2 12CO2 + 6H2O (9) Bài 33. Có 04 lọ hóa chất khác nhau: benzen, rượu etylic, axit axetic, etyl axetat. Trình bày phương pháp phân biệt các chất lỏng trên và viết các phương trình hóa học xảy ra. Hướng dẫn giải Benzen Rượu etylic Axit axetic Etyl axetat Quỳ tím - - đỏ - Na - có bọt khí - dd NaOH, t0 chất lỏng phân lớp chất lỏng đồng nhất Đánh số thứ tự cho từng lọ. - Trích mỗi mẫu một ít thuốc thử rồi thử lần lượt với quỳ tím: + Chất lỏng làm quỳ tím hóa đỏ là chứa axit axetic + Chất lỏng không hiện tượng là chứa benzen, rượu etylic, etyl axetat (Nhóm 1) - Cho một mẩu Na vào từng ống nghiệm trong nhóm 1: + Mẫu thử có mẩu Na tan dần, có khí thoát ra là chứa rượu etylic: 2C2H5OH + 2Na → 2C2H5ONa + H2 + Mẫu thử không hiện tượng là chứa đựng benzen, etyl axetat (Nhóm 2 ) - Cho 1ml dung dịch NaOH vào các ống nghiệm nhóm 2 đun nóng + Mẫu thử tạo chất lỏng đồng nhất nhận ra etyl axetat: CH3COOC2H5 + NaOH CH3COONa + C2H5OH + Mẫu thử có chất lỏng phân nấc nhận ra benzen. Bài 34: Trong phòng thí nghiệm có 7 bình thủy tinh không màu bị mất nhãn, mỗi bình đựng một chất khí hoặc một chất lỏng sau đây: metan, etilen, benzen, khí cacbonic, khí sunfurơ, ancol etylic, axit axetic. Chỉ được dùng thêm nước, nước vôi trong, nước brôm, đá vôi; hãy cho biết phương pháp nhận ra từng chất. Viết các phương trình phản ứng (nếu có). Hướng dẫn giải - Trích mỗi mẫu một ít thuốc thử rồi đánh STT. - Quan sát các mẫu thử: + Mẫu thử dạng khí là chứa metan, etilen, khí cacbonic, khí sunfurơ (Nhóm I) + Mẫu thử dạng lỏng là chứa benzen, ancol etylic, axit axetic (Nhóm II) - Cho vào các mẫu thử nhóm II một mẩu CaCO3: + Chất lỏng làm CaCO3 tan đồng thời sủi bọt khí là chứa CH3COOH CaCO3 + 2CH3COOH (CH3COO)2Ca + H2O + CO2 + Chất lỏng không có hiện tượng gì là chứa benzen, ancol etylic - Cho vào các mẫu thử benzen, ancol etylic 1ml nước + Mẫu thử tạo hỗn hợp lỏng đồng nhất là chứa ancol etylic + Mẫu thử xuất hiện hiện tượng phân lớp là chứa benzen - Cho các mẫu thử trong nhóm 1 qua dung dịch nước vôi trong dư + Mẫu thử xuất hiện kết tủa trắng là chứa SO2 và CO2 CO2 + Ca(OH)2 CaCO3↓ + H2O SO2 + Ca(OH)2 CaSO3↓ + H2O + Mẫu thử không hiện gì là chứa C2H4. - Cho các mẫu thử chứa SO2 và CO2 qua dung dịch brom + Mẫu thử làm mất màu dung dịch brom là chứa SO2 Br2 + SO2 + H2O H2SO4 + 2HBr + Mẫu thử không hiện gì là chứa CO2 TINH CHẾ - TÁCH CHẤT Bài 35. Có hỗn hợp gồm Fe, Cu. Dùng phương pháp hoá học để tách riêng từng chất ra khỏi hỗn hợp. Hướng dẫn giải - Nhỏ dung dịch HCl dư vào hỗn hợp 2 kim loại (Cu, Fe) lắc đều cho phản ứng xảy ra hoàn toàn. Fe + 2HCl FeCl2 + H2 Cu + HCl Không phản ứng - Lọc hỗn hợp thu được, tách riêng được phần dung dịch gồm FeCl2 và dd HCl dư và phần rắn chỉ gồm Cu. Rửa sạch, làm khô thu được Cu. - Phần dung dịch đem cho tác dụng với dung dịch NaOH dư. Sau phản ứng, lọc để tách lấy phần không tan gồm Fe(OH)2 NaOH + HCl NaCl + H2O FeCl2 + NaOH Fe(OH)2 + NaCl - Đem nung phần chất rắn không tan đến khối lượng không đổi thu được chất rắn
Tài liệu đính kèm:
 tai_lieu_36_chuyen_de_boi_duong_hoc_sinh_gioi_hoa_hoc_lop_9.docx
tai_lieu_36_chuyen_de_boi_duong_hoc_sinh_gioi_hoa_hoc_lop_9.docx





