Ôn thi HK II - Môn Hoá học 9
Bạn đang xem tài liệu "Ôn thi HK II - Môn Hoá học 9", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
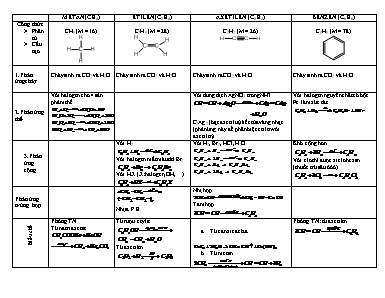
METAN (CH4) ETILEN (C2H4) AXETILEN (C2H2) BENZEN (C6H6) Công thức Phân tử Cấu tạo CH4 (M = 16) C2H4 (M = 28) C2H2 (M = 26) C6H6 (M = 78) 1.Phản ứngcháy Cháy sinh ra CO2 và H2O Cháy sinh ra CO2 và H2O Cháy sinh ra CO2 và H2O Cháy sinh ra CO2 và H2O 2.Phản ứng thế Với halogen cho 4 sản phảm thế Với dung dịch AgNO3 trong NH3 C2Ag2 (bạc axetilua) kết tủa vàng nhạt. (phản ứng này để phân biệt etilen với axetilen) Với halogen nguyên chất có bột Fe làm xúc tác 3.Phản ứng cộng Với H2 Với halogen mất màu dd Br2 Với HX (X:halogen, OH,) Với H2, Br2, HCl, H2O Khó cộng hơn Với clo thì được xiclohexan (thuốc trừ sâu 666) Phản ứng trùng hợp Nhựa P.E Nhị hợp Tam hợp Điều chế Phòng TN Từ natri axetat Từ rượu etylic Từ axetilen Từ canxicacbua Từ metan Phòng TN: từ axetilen RƯỢU ETYLIC (C2H5OH) AXIT AXETIC (CH3COOH) CHẤT BÉO (LIPIT) GLUCOZO SACCAROZO Công thức Phân tử Cấu tạo C2H6O CH3-CH2-OH C2H4O2 R gốc hidrocacbon của axit béo C6H12O6 C12H22O11 Lý tính Chất lỏng không màu, mùi đặc trung, dễ chịu, vị nồng Sôi ở 78,30C Nhẹ hơn nước (d=0,8) và tan trong nước bất kì tỷ lệ nào Chất lỏng không màu, mùi cay xốc Sôi ở 1180C, dưới p thường Tan vô hạn trong nước Nhẹ hơn nước Không tan trong nước tan nhiều trong dung môi hữu cơ Chất rắn không màu khi nguyên chất Vị ngọt Dễ tan trong nước Chất rắn không màu khi nguyên chất Vị ngọt Tan nhiều trong nước nóng Hóa tính Tác dụng với Na Phản ứng cháy Phản ứng với axit axetic Axit axetic là 1 axit hữu cơ, tính axit yếu Làm tím hóa đỏ Tác dụng với KL Tác dụng với oxit KL Tác dụng với muối Tác dung với baz Phản ứng với rượu etylic Phản ứng thủy phân chất béo tạo thành glixerol và axit beo Phàn ứng xà phòng hóa Phản ứng oxi hóa glucozo (tráng gương) Glucozo bị oxi hóa thành axit gluconic Lên men Thủy phân saccarozo thu được glucozo và fructozo Fructoz cấu tạo khác glucozo, vị ngọt hơn glucozo Có thể thủy phân saccarozo nhờ tác dụng của enzim ờ nhiệt độ thường Điều chế Sản xuất Công nghiệp Lấy từ mỡ động vật, thực vật Từ tinh bột Ép lấy từ mía Ứng dụng Rượu bia Dược phẩm Cao su tổng hợp Axit axetic Pha vecni, nước hoa Tơ nhân tạo Dược phẩm Phẩm nhuộm Thuốc diệt côn trùng Pha giấm ăn Chất dẻo Làm chất dinh dưỡng cho người và gia súc Điều chế xà phòng, glixerol Pha huyết thanh Tráng gương, ruột phích Sản xuất vitamin C Điều chế rượu etylic, axit lactic Thức ăn cho người Nguyên liệu cho công nghiệp thực phẩm Nguyên liệu pha chế thuốc Thêm vào rượu vang để làm tăng độ mạnh của rượu ÔN THI HKII - MÔN HOÁ HỌC 9 DẠNG 1. Viết PTHH theo chuỗi phản ứng (lưu ý ghi rõ điều kiện xảy ra phản ứng) 1/ SO2 SH2S 2/ (3) Na2S FeCl3 (4) CaCO3 (5) (3) HClOCl2HCl 3/ C COCO2 (4) (6) CO2 3) Na2CO3 NaHCO3 NaClO 4/ CaC2C2H2C2H4C2H6C2H5Cl C2H5OH CH3COOHCH3COOC2H5 P.E 5/ CO2tinh bộtglucozơrượu etylicaxit axeticđồng(II)axetat DẠNG 2. Nêu hiện tượng và viết PTHH hoá xảy ra cho mỗi thí nghiệm sau: 1/ Đổ một ít nước vào cốc đựng đất đèn 2/ cho mẫu natri vào cốc đựng rượu etylic 3/ Nhúng 1 cây đinh sắt vào cốc đựng giấm ăn 4/ Nhỏ một ít giấm vào cục đá vôi 5/ Nhỏ 1 vài giọt iot vào ống nghiệm đựng hồ tinh bột 6/ Dẫn khí clo vào ống nghiệm đựng giấy quì tím 7/ Đốt 1 đoạn dây đồng trong lọ đựng khí clo DẠNG 3. Phân biệt, nhận biết, tách chất: 1/ Nhận biết chất: khí CO2, C2H4, CH4 khí C2H2, SO2, CO khí Cl2, CO2, CH4, HCl các chất lỏng: benzen, rượu etylic, axit axetic các dd :glucozơ, sacarozơ, axit axetic các chất lỏng: benzen, axit axetic, dd glucozơ, rượu etylic các dd: rượu etylic, saccarozơ, glucozơ, axit axetic 2/ Tách chất: a/ Tinh chế CH4 có lẫn khí C2H4, C2H2 b/ Tinh chế CH4 có lẫn CO2, C2H4 DẠNG 4. Lập CTPT chất hữu cơ 1/ Đốt cháy hoàn toàn 1 lít chất hữu cơ A cần 3 lít oxi, thu được 2 lít CO2 và 2 lít hơi nước. Xác định CTPT và CTCT của A, biết các khí đo ở cùng điều kiện nhiệt độ và áp suất. 2/ Lập CTPT của các chất hữu cơ sau: a/ Thành phần 54,5%C ; 9,1%H; 36,4%O và M=88 b/ Thành phần 85,8%H và 14,2% H và chất này có tỉ khối so với khí H2 là 28. 3/ Đốt cháy hoàn toàn 3g chất hữu cơ A chứa C, H, O thu được 6,6g CO2 và 3,6g H2O, tỉ khối của đối với 1.875. Lập CTPT của A và viết CTCT của A, biết rằng A có thể phản ứng với Na. Xác định nguyên tố hoá học chất vô cơ 1/ Cho 1,1g kim loại kiềm tác dụng với nước thu được 1,792 lít H2 (đktc). Xác định tên kim loại 2/ Nguyên tố R tạo thành hợp chất khí với Hiđrô có công thức chung là RH3. Trong hợp chất này H chiếm 25% khối lượng. Xác định tên kim loại R. DẠNG 5. Dạng bài toán hỗn hợp: Trường hợp: cả 2 chất ban đầu cùng phản ứng với 1 chất khác sinh ra sản phẩm tương tự nhau 1/ Cho dd H2SO4 50% tác dụng với 9,1g hỗn hợp gồm Na2CO3 và NaHCO3 thì thu được 2,016 lít khí (đktc). Xác định khối lượng mỗi muối trong hỗn hợp và khối lượng dd axit cần dùng. 2/ Đốt cháy hoàn hoàn hỗn hợp gồm etilen và axetilen rồi dẫn roàn bộ sản phẩm cháy qua bình 1 đựng H2SO4 đặc, bình 2 đựng nước vôi trong dư. Kết thúc thí nghiệm thấy khối lượng 1 tăng 3,6g và bình 2 tăng 13,2g. Tính % khối lượng các khí tronh hỗn hợp. 3/ Cho 5,6 lít (đktc) hỗn hợp C2H4 và C2H2 tác dụng hết với dd brom dư, thì thấy lượng brom đã phản ứng là 56g. Tính thành phần % thể tích mỗi chất của hỗn hợp. Trường hợp: chỉ có 1 trong 2 chất phản ứng với chất khác hoặc cả 2 chất đều có phản ứng với 1 chất khác nhưng sản phẩm khác nhau. 4/ Dẫn 2,8 lít (đktc) hỗn hợp gồm metan và etilen đi qua dd brôm dư thì thấy có 4g brôm đã phản ứng, Tính khối lượng mỗi khí và thành phần % mỗi khí có trong hỗn hợp Tính thể tích không khí cần dùng(đktc) để đốt cháy hoàn toàn hỗn hợp trên. 5/ Hỗn hợp X gồm CH3COOH và C2H5OH. Chia A làm 3 phần bằng nhau: -Phần 1: cho tác dụng với Na dư thu được 5,6 lít khí(đktc) -Phần 2. cho tác dụng với CaCO3 dư thu được 2,24 lít khí (đktc) -Phần 3: đun nóng với H2SO4 đặc để điều chế este. a. Tính khối lượng mỗi chất có trong hỗn hợp A b. tính khối lượng este thu được, biết hiệu suất phản ứng là 60%. 6/ Cho m gam hỗn hợp gồm CH3COOH và CH3COOC2H5 tác dụng với dd NaOH 2M thì vừa hết 225ml. Tách lấy toàn bộ lượng rượu thu được cho tác dụng với Na dư thì thu được 3,36 lít H2 (đktc). Tính m. DẠNG 6. Bài toán có liên quan độ rượu 1/ Cho 90ml rượu etylic 900 (d=0,8g/cm3) tác dụng với Na dư. Tính k.l muối và bazơ sinh ra? Tính VH2? 2/ Đốt cháy hoàn toàn 30ml rượu etylic chưa rõ độ rượu, cho toàn bộ sản phẩm cháy đi vào dd Ca(OH)2 dư thu được 100g kết tủa. Tính Vkk cần dùng để đốt cháy hết lượng rượu đó? Xác định độ rượu? (d=0,8g/cm3) 3/ Cho 4,5kg glucozơ chứa 25% tạp chất lên men thành rượu etylic, trong quá trình chế biến, rượu hao hụt mất 12%. a. Tính k.l rượu etyic thu được? b. Nếu pha loãng rượu đó thành rượu 500 thì sẽ được bao nhiêu ml, biết Drượu = 0,8g/ml? DẠNG 7. Bài toán có liên đến hiệu suất 1/ Tính khối lượng benzen cần dùng để điều chế 39,25g brombenzen. Biết hiệu suất phản ứng đạt 85%. 2/ Hấp thụ 8,96 lít khí C2H4(đktc) vào nước có axit H2SO4 loãng làm xúc tác thu được 13,8 g rượu etylic. Tính hiệu suất phản ứng 3/ Tính thể tích C2H4 (đktc) cần để diều chế được 6,9g rượu etylic. Biết hiệu suất pư là 5%? 4/ Đun nóng hh gồm 3,68g rượu etylic và 3g axit axetic trong điều kiện có H2SO4 đặc làm xúc tác. Tính k.l các chất thu được sau pư biết. Hiệu suất pư este hóa là 60%? 5/ Tính k.l dd axit axetic thu được khi lên men 5 lít rượu 400. Biết drượu = 0,8g/ml và hiệu suất pư là 92%? 6/ Đun nóng hh gồm 8,05g rượu etylic và 5,4g axit axetic có axit làm xúc tác thu được 3,69g etyl axetat. Tính hiệu suất của pư este hóa? 7/ Cho lên men glucozơ thành rượu etylic rồi dẫn toàn bộ lượng khí sinh ra qua dd nước vôi trong dư thu được 100g kết tủa. Tính k.l rượu thu được và k.l glucozơ đã lên men. Biết hiệu suất của p/ư lên men đạt 85%. DẠNG 8. Bài tập có liên quan đến nồng độ dung dịch 1/ Cho 250ml dd axit axetic tác dụng hoàn toàn với kim loại Mg. Cô cạn dd sau pư thu được 14,2g muối khan. a. Tính nồng độ mol của dd axit axetic và thể tích khí H2 sinh ra? b. Để trung hòa 250 ml dd axit axetic nói trên cần bao nhiêu ml dd NaOH 0,5M? 2/ Cho 10,6g Na2CO3 vào dd CH3COOH 0,5M. Phản ứng xảy ra hoàn toàn. Lượng khí thoát ra dẫn vào bình đựng nước vôi trong dư. Tính nồng độ mol của dd axit axetic. Tính khối lượng kết tủa thu được. 3/ Tính khối lượng Na2CO3 cần dùng để phản ứng hết với 50g dd axit axetic 30%. 4/ Để trung hoà 30 ml dd axit cần 40ml dd NaOH 0,3M. Tính nồng độ mol của dd axit Trung hoà hết 125ml dd axit trên bằng NaOH thì thu được 4,8g muối. Xác định CTPT của axit. 5/ Cho 69,6g MnO2 tác dụng với HCl đặc dư, dẫn khí thoát ra đi vào 500ml dd NaOH 4M. Xác định nồng độ mol các chất trong dd sau phản ứng.
Tài liệu đính kèm:
 on_thi_HKIItu_luan_ly_thuyet.doc
on_thi_HKIItu_luan_ly_thuyet.doc





