Nhận biết các cation
Bạn đang xem tài liệu "Nhận biết các cation", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
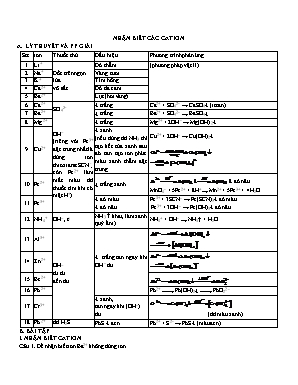
NHẬN BIẾT CÁC CATION A. LÝ THUYẾT VÀ PP GIẢI Stt ion Thuốc thử Dấu hiệu Phương trình phản ứng 1 Li+ Đốt trên ngọn lửa vô sắc Đỏ thẫm (phương pháp vật lí) 2 Na+ Vàng tươi 3 K+ Tím hồng 4 Ca2+ Đỏ da cam 5 Ba2+ Lục (hơi vàng) 6 Ca2+ SO42- ¯ trắng Ca2+ + SO42- ® CaSO4¯ (it tan) 7 Ba2+ ¯ trắng Ba2+ + SO42- ® BaSO4¯ 8 Mg2+ OH- (riêng với Fe3+ đặc trưng nhất là dùng ion thioxianat SCN-; còn Fe2+ làm mất màu dd thuốc tím khi có mặt H+). ¯ trắng Mg2+ + 2OH- ® Mg(OH)2¯ 9 Cu2+ ¯ xanh (nếu dùng dd NH3 thì tạo kết tủa xanh sau đó tan tạo ion phức màu xanh thẫm đặc trưng. Cu2+ + 2OH- ® Cu(OH)2¯ 10 Fe2+ ¯ trắng xanh đỏ nâu MnO4- + 5Fe2+ + 8H+ ® Mn2+ + 5Fe3+ + 4H2O 11 Fe3+ ¯ đỏ máu ¯ đỏ nâu Fe3+ + 3SCN- ® Fe(SCN)3¯ đỏ máu Fe3+ + 3OH- ® Fe(OH)3¯ đỏ nâu 12 NH4+ OH-, to NH3 khai, làm xanh quỳ ẩm) NH4+ + OH- ® NH3 + H2O 13 Al3+ OH- từ từ đến dư ¯ trắng tan ngay khi OH– dư 14 Zn2+ 15 Be2+ 16 Pb2+ Pb2+ ¾® Pb(OH)2¯ ¾® PbO22- 17 Cr3+ ¯ xanh, tan ngay khi (OH–) dư (dd màu xanh) 18 Pb2+ dd H2S PbS ¯ đen Pb2+ + S2- ® PbS¯ (màu đen) B. BÀI TẬP I. NHẬN BIẾT CATION Câu 1. Để nhận biết ion Ba2+ không dùng ion A. SO42-. B. S2-. C. CrO42-. D. Cr2O72-. Câu 2. Để phận biệt Al3+ và Zn2+ không dùng thuốc thử A. NH3. B. NaOH. C. Na2CO3. D. Na2S. Câu 3. Để nhận biết sự có mặt của các ion Al3+, Cu2+, Fe3+, Zn2+ trong dung dịch bằng phương pháp hóa học, cần dùng ít nhất mấy phản ứng? A. 6 B. 5 C. 4 D. 3 Câu 4. Cho các ion Na+, K+, NH4+, Ba2+, Al3+, Ca2+. Số ion có thể nhận biết bằng thử màu ngọn lửa là A. 2 B. 3 C. 4 D. 5 Câu 5. Có thể phân biệt hai dd FeSO4 và Fe2(SO4)3 bằng thuốc thử nào sau đây ? A.dd NaOH. B. dd KMnO4. C. dd K2Cr2O7/ H2SO4. D. tất cả. Câu 6. Cho các ion sau: Fe 2+, Mn2+, Cu2+, Mg2+, K+ chứa trong các dung dịch riêng biệt mất nhãn. Có thể dùng chất nào để phân biệt các dung dịch trên (Không được sử dụng các chất khác kể cả không khí)? A. NaOH. B. Na2S. C. Ca(OH)2. D. H2S. Câu 7. Có 5 dd riêng rẽ, mỗi dd chứa một cation sau đây: NH4+, Mg2+, Fe2+, Fe3+, Al3+ (nồng độ khoảng 0,1M). Dùng dd NaOH cho lần lượt vào từng dd trên, có thể nhận biết tối đa được mấy dd? A. 2 dung dịch B. 3 dung dịch C. 1 dung dịch D. 5 dung dịch Câu 8. Có 5 lọ chứa hoá chất mất nhãn, mỗi lọ đựng một trong các dd chứa cation sau (nồng độ mỗi dd khoảng 0,01M): Fe2+, Cu2+, Ag+, Al3+, Fe3+. Chỉ dùng một dd thuốc thử KOH có thể nhận biết được tối đa mấy dung dịch? A. 2 dung dịch B. 3 dung dịch C. 1 dung dịch D. 5 dung dịch Câu 9. Cho 5 dung dịch riêng rẽ, mỗi dung dịch chứa 1 cation trong số: Al3, Fe3+, Zn2+, Cu2+. Có thể nhận ra cation Zn2+ bằng 1 dung dịch với hiện tượng quan sát được là A. tạo kết tủa, sau đó kết tủa tan trong thuốc thử dư. B. tạo kết tủa màu trắng. C. tạo kết tủa, kết tủa tan trong thuốc thử dư thành dung dịch không màu. D. tạo kết tủa, kết tủa tan trong thuốc thử dư thành dung dịch không màu. Câu 10. Thuốc thử duy nhất dùng để nhận biết NH4NO3, NaNO3, Al(NO3)3, Mg(NO3)2, Fe(NO3)3, Fe(NO3)3 và Cu(NO3)2 là A. NaAlO2. B. Na2CO3. C. NaCl. D. NaOH. Câu 11. Để nhận biết các dung dịch riêng biệt NaCl, CaCl2, AlCl3 người ta có thể dùng những hoá chất nào trong các chất sau? A. dd NaOH dư và AgNO3. B. dd NaOH dư và dd Na2CO3. C. dd H2SO4 và dd AgNO3. D. A và B đúng. Câu 12. Có 4 dd chứa riêng rẽ từng chất: AlCl3, CrCl3, ZnCl2, MgCl2. Để nhận ra từng dd làm các thí nghiệm : (1) Cho tác dụng với dung dịch nước brom. (2) Cho tác dụng với dung dịch NaOH tới dư. (3) Cho tác dụng với dung dịch NH3 từ từ đến dư. Thứ tự thí nghiệm để xác định được dung dịch CrCl3 là A. 1, 2. 3. B. 2, 1. C. 2, 3, 1. D. 3, 2, 1.
Tài liệu đính kèm:
 Nhan_biet_cationion_duong.doc
Nhan_biet_cationion_duong.doc





