Ma trận, bản đặc tả và đề kiểm tra giữa kỳ I môn Hóa học 9 - Năm học 2022-2023
Bạn đang xem tài liệu "Ma trận, bản đặc tả và đề kiểm tra giữa kỳ I môn Hóa học 9 - Năm học 2022-2023", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
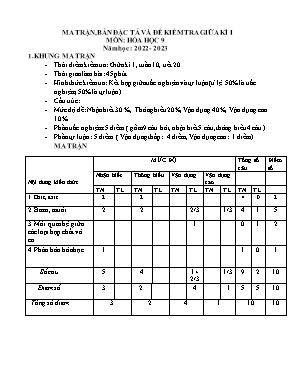
MA TRẬN, BẢN ĐẶC TẢ VÀ ĐỀ KIỂM TRA GIỮA KÌ I MÔN: HÓA HỌC 9 Năm học : 2022 - 2023 1. KHUNG MA TRẬN Thời điểm kiểm tra: Giữa kì 1, tuần 10, tiết 20. Thời gian làm bài: 45 phút Hình thức kiểm tra: Kết hợp giữa trắc nghiệm và tự luận( tỉ lệ 50% là trắc nghiệm, 50% là tự luận) Cấu trúc: Mức độ đề: Nhận biết 30 %, Thông hiểu 20%, Vận dụng 40%, Vận dụng cao 10%. Phần trắc nghiệm: 5 điểm ( gồm 9 câu hỏi, nhận biết 5 câu, thông hiểu 4 câu ) Phần tự luận : 5 điểm ( Vận dụng thấp: 4 diểm, Vận dụng cao: 1 điểm) MA TRẬN Nội dung kiến thức MỨC ĐỘ Tổng số câu Điểm số Nhận biết Thông hiểu Vận dụng Vận dụng cao TN TL TN TL TN TL TN TL TN TL 1. Oxit, axit 2 2 4 0 2 2. Bazơ, muối 2 2 2/3 1/3 4 1 5 3. Mối quan hệ giữa các loại hợp chất vô cơ 1 0 1 2 4. Phân bón hóa học. 1 1 0 1 Số câu 5 4 1+ 2/3 1/3 9 2 10 Điểm số 3 2 4 1 5 5 10 Tổng số điểm 3 2 4 1 10 10 2. ĐẶC TẢ Đơn vị kiến thức Mức độ kiến thức cần kiểm tra, đánh giá Số câu hỏi theo mức độ kiến thức Nhận biết Thông hiểu Vận dụng thấp Vận dụng cao 1. Chủ đề: oxit, axit - Nhận biết: Tính chất hóa học của oxit. Nhận biết muối sunphat - Thông hiểu: Tính chất hóa học của oxit, axit 2 2 2. Chủ đề : Bazơ, muối - Nhận biết: Tính chất hóa học của bazơ, muối. Điều kiện để phản ứng trao đổi xảy ra. - Thông hiểu: Tính chất hóa học của bazơ, muối - Vận dụng: - Tính C M của các chất dựa vào phản ứng. - Vận dụng cao: - Xác định khối lượng của chất liên quan đến nhiều PƯHH. 2 2 2/3 1/3 3. Mối quan hệ giữa các loại hợp chất vô cơ - Vận dụng thấp: Hoàn thành sơ đồ chuyển hóa dựa vào mối quan hệ giữa các loại hợp chất vô cơ 1 1. Phân bón hóa học - Nhận biết: Tên của một số loại phân bón hóa học 1 Đề kiểm tra Trường: Họ tên: Lớp: KIỂM TRA ĐÁNH GIÁ GIỮA KÌ I MÔN: HÓA HỌC 9 Thời gian làm bài:45 phút (Học sinh làm trực tiếp vào tờ đề bài này) Lời phê của thầy cô giáo Ý kiến của phụ huynh HS Điểm ĐỀ BÀI I. PHẦN TRẮC NGHIỆM (5 điểm) Hãy khoanh tròn vào chữ cái đứng trước câu trả lời đúng: Câu 1. Sản phẩm của phản ứng phân huỷ Fe(OH)3 bởi nhiệt là : A. FeO và H2O B. Fe2O3 và H2O C. Fe2O3 và H2 D. FeO và H2 Câu 2. Dãy các chất phản ứng với nước ở điều kiện thường là A. SO2, CuO, Na2O, P2O5. B. NO, CaO, SO3, N2O5 C. SO2, K2O, BaO, SO3 D. N2O5, Fe2O3, CuO, P2O5 Câu 3. Cho dung dịch BaCl2 tác dụng với dung dịch Na2SO4 có hiện tượng gì ? A. Xuất hiện kết tủa màu trắng B. Không có hiện tượng gì C. Xuất hiện kết tủa màu xanh D. Có kết tủa màu đỏ Câu 4. Điều kiện để muối tác dụng với muối là: A. Không có điều kiện gì. B. Tạo muối mới và axit mới không tan. C. Tạo muối mới và bazơ mới không tan D. Ít nhất một muối tạo thành không tan Câu 5. Muối nào sau đây tác dụng được với dung dịch NaOH ? A. BaCO3 B. K2CO3 C. CuSO4 D. CaCO3 Câu 6: Dãy gồm các chất đều phản ứng với dung dịch NaOH là A. SO2 ; CO2; SO3. B. Fe2O3; Al2O3; CO2. C. CO2; N2O5; CO. D. N2O5; BaO; CuO. Câu 7: Cặp chất nào sau đây phản ứng với nhau tạo ra sản phẩm khí ? Dung dịch Na2SO4 và dung dịch BaCl2. B. Dung dịch Na2CO3 và dung dịch HCl. C. Dung dịch KOH và dung dịch MgCl2. D. Dung dịch KCl và dung dịch AgNO3. Câu 8: Dãy chất nào sau đây chỉ có muối? A. NaCl, CuSO4, BaO, KMnO4 B. KMnO4, Na2SO4, CuCl2, Ba(NO3)2 C. FeCl3, NaOH, AgNO3, Na2S D. MgSO4, BaCl2, Cu(NO3)2, Al2O3 Câu 9: Hãy chọn công thức hoá học ở cột II ghép với tên phân bón hoá học ở cột I cho phù hợp Cột I Cột II Trả lời a. Urê b. Đạm amoni sunfat c. Đạm kali nitrat d.Đạm amoni nitrat 1. (NH4)2SO4 2. KNO3 3. NH4NO3 4. (NH2)2CO 1 - 2 - 3 - 4 - II. PHẦN TỰ LUẬN (5 điểm) Câu 1: (2,0 điểm) Hãy thực hiện chuyển đổi hoá học sau bằng cách viết các PTPƯ (ghi điều kiện nếu có): FeCl3 Fe(OH)3 Fe2O3 Fe2(SO4)3 FeCl3 Câu 2: ( 3,0 điểm):Trộn 400ml dd FeCl3 2M với 200ml dd NaOH phản ứng vừa đủ. Sau phản ứng lọc kết tủa nung đến khối lượng không đổi được a gam chất rắn: a. Viết PTPƯ xảy ra b. Tính CM của các chất có trong dung dịch sau khi lọc kết tủa (coi V không đổi). c. Tính a ( khối lượng chất rắn) ( Biết Fe = 56; Cl = 35,5; Na = 23; O = 16; H = 1) Bài làm ĐÁP ÁN VÀ BIỂU ĐIỂM Phần I: Trắc nghiệm (5,0 điểm) Từ C1 → C8 Mỗi câu trả lời đúng được 0,5 điểm Câu 1 2 3 4 5 6 7 8 Đáp án B C A D C A B B Câu 9. (1,0điểm) mỗi ý đúng được 0,25 điểm b 2. c 3. d 4. a Phần II: Tự luận (5 điểm) Câu Đáp án Biểu điểm 1 (2,0 điểm ) (1) FeCl3 + 3NaOH Fe(OH)3 + 3NaCl (2) 2Fe(OH)3 Fe2O3 + 3H2O (3) Fe2O3 + 3H2SO4 Fe2(SO4)3 + 3H2O (4) Fe2(SO4)3 + 3BaCl2 3BaSO4 + 2FeCl3 0,5đ 0,5đ 0,5đ 0,5đ Câu 2 (3,0 điểm) a. FeCl3 + 3NaOH ® Fe(OH)3 + 3NaCl (1) 2Fe(OH)3 t0 Fe2O3 + 3H2O (2) b. nFeCl = 0,4 . 2 = 0,8(mol) nNaCl = 3nFeCl = 3. 0,8 = 2,4(mol) Vdd = 0,4 + 0,2 = 0,6 (l) CM(NaCl)= = 4 M c. Theo PT (1): nFe(OH) = nFeCl = 0,8(mol) (2): nFeO = nFe(OH) = 0,4 (mol) ® mFeO = 0,4 . 160 = 64 (g) 0,5đ 0,5đ 0,25đ 0,25đ 0,25 đ 0,25đ 0,25đ 0,25đ 0,5đ
Tài liệu đính kèm:
 ma_tran_ban_dac_ta_va_de_kiem_tra_giua_ky_i_mon_hoa_hoc_9_na.doc
ma_tran_ban_dac_ta_va_de_kiem_tra_giua_ky_i_mon_hoa_hoc_9_na.doc





