Lý thuyết và bài tập trắc nghiệm Hóa học Lớp 11 - Chuyên đề 2: Nhóm nitơ
Bạn đang xem 20 trang mẫu của tài liệu "Lý thuyết và bài tập trắc nghiệm Hóa học Lớp 11 - Chuyên đề 2: Nhóm nitơ", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
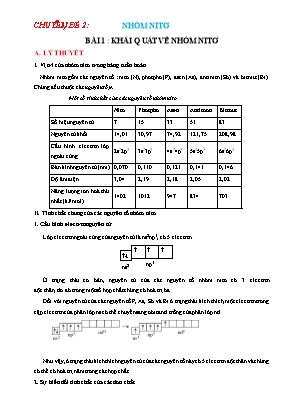
CHUYÊN ĐỀ 2 : NHÓM NITƠ BÀI 1 : KHÁI QUÁT VỀ NHÓM NITƠ A. LÝ THUYẾT I. Vị trí của nhóm nitơ trong bảng tuần hoàn Nhóm nitơ gồm các nguyên tố : nitơ (N), photpho (P), asen (As), antimon (Sb) và bitmut (Bi). Chúng đều thuộc các nguyên tố p. Một số tính chất của các nguyên tố nhóm nitơ Nitơ Photpho Asen Antimon Bitmut Số hiệu nguyên tử 7 15 33 51 83 Nguyên tử khối 14,01 30,97 74,92 121,75 208,98 Cấu hình electron lớp ngoài cùng 2s22p3 3s23p3 4s24p3 5s25p3 6s26p3 Bán kính nguyên tử (nm) 0,070 0,110 0,121 0,141 0,146 Độ âm điện 3,04 2,19 2,18 2,05 2,02 Năng lượng ion hoá thứ nhất (kJ/mol) 1402 1012 947 834 703 II. Tính chất chung của các nguyên tố nhóm nitơ 1. Cấu hình electron nguyên tử Lớp electron ngoài cùng của nguyên tử là ns2np3, có 5 electron. ¯ ns2 np3 Ở trạng thái cơ bản, nguyên tử của các nguyên tố nhóm nitơ có 3 electron độc thân, do đó trong một số hợp chất chúng có hoá trị ba. Đối với nguyên tử của các nguyên tố P, As, Sb và Bi ở trạng thái kích thích, một electron trong cặp electron của phân lớp ns có thể chuyển sang obitan d trống của phân lớp nd. Như vậy, ở trạng thái kích thích nguyên tử của các nguyên tố này có 5 electron độc thân và chúng có thể có hoá trị năm trong các hợp chất. 2. Sự biến đổi tính chất của các đơn chất a. Tính oxi hoá - khử Trong các hợp chất, các nguyên tố nhóm nitơ có số oxi hoá cao nhất là +5. Ngoài ra, chúng còn có các số oxi hoá +3 và -3. Riêng nguyên tử nitơ còn có thêm các số oxi hoá +1, +2, +4. Do có khả năng giảm và tăng số oxi hoá trong các phản ứng hoá học, nên nguyên tử các nguyên tố nhóm nitơ thể hiện tính oxi hoá và tính khử. Khả năng oxi hoá giảm dần từ nitơ đến bitmut, phù hợp với chiều giảm độ âm điện của các nguyên tử nguyên tố trong nhóm. b. Tính kim loại - phi kim Đi từ nitơ đến bitmut, tính phi kim của các nguyên tố giảm dần, đồng thời tính kim loại tăng dần. Nitơ, photpho là các phi kim. Asen thể hiện tính phi kim trội hơn tính kim loại. Antimon thể hiện tính kim loại và tính phi kim ở mức độ gần như nhau, còn ở bitmut tính kim loại trội hơn tính phi kim. 3. Sự biến đổi tính chất của các hợp chất a. Hợp chất với hiđro Tất cả các nguyên tố nhóm nitơ đều tạo được các hợp chất khí với hiđro (hiđrua), có công thức chung là RH3. Độ bền nhiệt của các hiđrua giảm dần từ NH3 đến BiH3. Dung dịch của chúng không có tính axit. b. Oxit và hiđroxit Từ nitơ đến bitmut, tính axit của các oxit và hiđroxit tương ứng giảm dần đồng thời tính bazơ của chúng tăng dần. Độ bền của các hợp chất với số oxi hoá +3 tăng, còn độ bền của các hợp chất với số oxi hoá +5 nói chung giảm. Các oxit của nitơ và photpho với số oxi hoá +5 (N2O5, P2O5) là oxit axit, hiđroxit của chúng là các axit (HNO3, H3PO4). Trong các oxit với số oxi hoá +3 thì As2O3 là oxit lưỡng tính, tính axit trội hơn tính bazơ ; Sb2O3 là oxit lưỡng tính, tính bazơ trội hơn tính axit ; còn Bi2O3 là oxit bazơ, tan dễ dàng trong dung dịch axit và hầu như không tan trong dung dịch kiềm. BÀI 2 : NITƠ A. LÝ THUYẾT I. Cấu tạo phân tử - Cấu hình electron : 1s22s22p3 - CTCT : N º N CTPT : N2 II. Tính chất vật lí - Là chất khí không màu, không mùi, không vị, hơi nhẹ hơn không khí, hóa lỏng ở -196oC. - Nitơ ít tan trong nước, hoá lỏng và hoá rắn ở nhiệt độ rất thấp. - Không duy trì sự cháy và sự hô hấp. III. Tính chất hóa học 1. Tính oxi hoá Phân tử nitơ có liên kết ba rất bền (ở 3000oC nó chưa bị phân hủy), nên nitơ khá trơ về mặt hóa học ở nhiệt độ thường. a. Tác dụng với hiđro : Ở nhiệt độ cao, áp suất cao và có xúc tác. Nitơ phản ứng với hiđro tạo amoniac. Đây là phản ứng thuận nghịch và toả nhiệt : DH = -92KJ b. Tác dụng với kim loại - Ở nhiệt độ thường nitơ chỉ tác dụng với liti tạo liti nitrua. 6Li + N2 2Li3N - Ở nhiệt độ cao, nitơ tác dụng với nhiều kim loại. 3Mg + N2 Mg3N2 magie nitrua ● Nhận xét : Nitơ thể hiện tính oxi hoá khi tác dụng với nguyên tố có độ âm điện nhỏ hơn. 2. Tính khử - Ở nhiệt độ cao (3000oC) Nitơ phản ứng với oxi tạo nitơ monoxit. N2 + O2 2NO (không màu) - Ở điều kiện thường, nitơ monoxit tác dụng với oxi không khí tạo nitơ đioxit màu nâu đỏ. 2NO + O2 2NO2 ● Nhận xét : Nitơ thể hiện tính khử khi tác dụng với nguyên tố có độ âm điện lớn hơn. Chú ý : Các oxit khác của nitơ : N2O , N2O3, N2O5 không điều chế được trực tiếp từ niơ và oxi. IV. Điều chế a. Trong công nghiệp Nitơ được sản xuất bằng cách chưng cất phân đoạn không khí lỏng. b. Trong phòng thí nghiệm Nhiệt phân muối nitrit NH4NO2 N2 + 2H2O NH4Cl + NaNO2 N2 + NaCl +2H2O BÀI 3 : AMONIAC VÀ MUỐI AMONI A. LÝ THUYẾT ● PHẦN 1 : AMONIAC Trong phân tử NH3, N liên kết với ba nguyên tử hiđro bằng ba liên kết cộng hóa trị có cực. NH3 có cấu tạo hình chóp với nguyên tử Nitơ ở đỉnh. Nitơ còn một cặp electron hóa trị là nguyên nhân tính bazơ của NH3. I. Tính chất vật lí - Là chất khí không màu, có mùi khai xốc, nhẹ hơn không khí. - Tan rất nhiều trong nước (1 lít nước hòa tan được 800 lít khí NH3) - Amoniac hòa tan vào nước thu được dung dịch amoniac. II. Tính chất hóa học 1. Tính bazơ yếu a. Tác dụng với nước NH3 + H2O NH4+ + OH- - Thành phần dung dịch amoniac gồm: NH3, NH4+, OH-. - Dung dịch NH3 là một dung dịch bazơ yếu làm quỳ tím hóa xanh. b. Tác dụng với dung dịch muối AlCl3 + 3NH3 + 3H2O Al(OH)3↓ + 3NH4Cl Al3+ + 3NH3 + 3H2O Al(OH)3↓ + 3NH4+ c. Tác dụng với axit tạo muối amoni NH3 + HCl NH4Cl (amoni clorua) 2NH3 + H2SO4 (NH4)2SO4 (amoni sunfat) 2. Tính khử a. Tác dụng với oxi 4NH3 + 3O2 2N2 + 6H2O - Nếu có Pt là xúc tác, ta thu được khí NO. 4NH3 + 5O2 4NO + 6H2O b. Tác dụng với clo 2NH3 + 3Cl2 N2 + 6HCl - NH3 kết hợp ngay với HCl vừa sinh ra tạo “ khói trắng” NH4Cl c. Tác dụng với oxit kim loại 2NH3 + 3CuO 3Cu + N2 + 3H2O 3. Khả năng tạo phức của dung dịch NH3 Dung dịch NH3 có khả năng hòa tan hiđroxit, oxit hay muối ít tan của 1 số kim loại, tạo thành dung dịch phức chất. Ví dụ với Cu(OH)2 Cu(OH)2 +4NH3 [Cu(NH3)4](OH)2 Cu(OH)2 + 4NH3 [Cu(NH3)4]2++ 2OH- Màu xanh thẫm Ví dụ với Với AgCl AgCl + 2NH3 [Ag(NH3)2] Cl AgCl + 2NH3 [Ag(NH3)2]+ + Cl- Sự tạo thành các ion phức là do các phân tử NH3 kết hợp với các ion Cu2+, Zn2+, Ni2+, Ag+ bằng các liên kết cho – nhận giữa cặp electron chưa sử dụng của nguyên tử nitơ với obitan trống của ion kim loại. III. Điều chế 1. Trong phòng thí nghiệm Bằng cách đun nóng muối amoni với Ca(OH)2 2NH4Cl + Ca(OH)2 CaCl2 + 2NH3↑ + 2H2O 2. Trong công nghiệp Tổng hợp từ nitơ và hiđro : DH = -92KJ - Nhiệt độ: 450 – 5000C - Áp suất cao từ 200 – 300 atm - Chất xúc tác: sắt kim loại được trộn thêm Al2O3, K2O,... Làm lạnh hỗn hợp khí bay ra, NH3 hóa lỏng được tách riêng. ● PHẦN 2 : MUỐI AMONI Là tinh thể ion gồm cation NH4+ và anion gốc axit. Ví dụ : NH4Cl, (NH4)2SO4 I. Tính chất vật lí Tan nhiều trong nước, điện li hòan toàn thành các ion, ion NH4+ không màu. II. Tính chất hóa học: 1. Tác dụng với dung dịch kiềm (NH4)2SO4 + 2NaOH 2NH3 + 2H2O + Na2SO4 NH4+ + OH– NH3 + H2O Phản ứng này dùng để nhận biết ion amoni và điều chế amoniac trong phòng thí nghiệm. 2. Phản ứng nhiệt phân - Muối amoni chứa gốc của axit không có tính oxi hóa khi đun nóng bị phân hủy thành NH3. Ví dụ : NH4Cl (r) NH3 (k) + HCl (k) (NH4)2CO3 (r) NH3 (k) + NH4HCO3 (r) NH4HCO3 NH3 + CO2 + H2O NH4HCO3 được dùng làm xốp bánh. - Muối amoni chứa gốc của axit có tính oxi hóa như axit nitrơ, axit nitric khi bị nhiệt phân cho ra N2, N2O ( đinitơ oxit). Ví dụ : NH4NO2 N2 + 2H2O NH4NO3 N2O + 2H2O Nhiệt độ lên tới 500oC , ta có phản ứng : 2NH4NO3 2 N2 + O2 + 4H2O BÀI 4 : AXIT NITRIC VÀ MUỐI NITRAT A. LÝ THUYẾT PHẦN 1 : AXIT NITRIC I. Cấu tạo phân tử : - CTPT : HNO3 - CTCT : - Nitơ có số oxi hoá cao nhất là +5 II. Tính chất vật lý - Là chất lỏng không màu, bốc khói mạnh trong không khí ẩm ; D = 1.53g/cm3 - Axit nitric không bền, khi có ánh sáng , phân huỷ 1 phần : 4HNO3 4NO2 + O2 + 2H2O Do đó axit HNO3 cất giữ lâu ngày có màu vàng do NO2 phân huỷ tan vào axit. - Axit nitric tan vô hạn trong nước (HNO3 đặc có nồng độ 68%, D = 1,40 g/cm3 ). III. Tính chất hoá học 1. Tính axit : Là một trong số cc axit mạnh nhất, trong dung dịch phân li hoàn toàn ra các ion : HNO3 H + + NO3– - Dung dịch axit HNO3 có đầy đủ tính chất của môt dung dịch axit. - làm đỏ quỳ tím, tác dụng với oxit bazơ, bazơ, muối của axit yếu hơn. CuO + 2HNO3 Cu(NO3)2 + H2O Ba(OH)2 + 2HNO3 Ba(NO3)2 + 2H2O CaCO3 + 2HNO3 Ca(NO3)2 + CO2 + H2O 2. Tính oxi hoá Tuỳ vào nồng độ của axit và bản chất của chất khử mà HNO3 có thể bị khử đến NO, NO2, N2O, N2, NH4NO3. a. Với kim loại : HNO3 oxi hoá hầu hết các kim loại (trừ vàng và paltin ) không giải phóng khí H2, do ion NO3- có khả năng oxi hoá mạnh hơn H+. Khi đó kim loại bị oxi hóa đến mức oxi hóa cao nhất. - Với những kim loại có tính khử yếu như : Cu, Agthì HNO3 đặc bị khử đến NO2 ; HNO3 loãng bị khử đến NO. Ví dụ : Cu + 4HNO3 đặc Cu(NO3)2 + 2NO2 + 2H 2O 3Cu + 8HNO3 loãng 3Cu(NO3)2 + 2NO + 4H 2O - Khi tác dụng với những kim loại có tính khử mạnh hơn như : Mg, Zn, Al.thì HNO3 đặc bị khử yếu đến NO2 ; HNO3 loãng có thể bị kim loại khử mạnh như Mg, Al, Znkhử đến N2O , N2 hoặc NH4NO3. ● Lưu ý : Fe, Al, Cr bị thụ động hoá trong dung dịch HNO3 đặc nguội vì vậy khi cho các kim loại này tác dụng với HNO3 thì không xảy ra phản ứng. b. Với phi kim Khi đun nóng HNO3 đặc có thể tác dụng được với C, P, SVí dụ : C + 4HNO3 (đ) CO2 + 4NO2 + 2H2O S + 6HNO3 (đ) H2SO4 + 6NO2 + 2H2O P + 5HNO3 (đ) H3PO4 + 5NO2 + H2O c. Với hợp chất - H2S, Hl, SO2, FeO, muối sắt (II) có thể tác dụng với HNO3 nguyên tố bị oxi hoá trong hợp chất chuyển lên mức oxi hoá cao hơn. Ví dụ : 3FeO + 10HNO3 (đ) ® 3Fe(NO3)3 + NO + 5H2O 3H2S + 2HNO3 (đ) ® 3S + 2NO + 4H2O - Nhiều hợp chất hữu cơ như giấy, vải, dầu thông bốc cháy khi tiếp xúc với HNO3 đặc. V. Điều chế 1. Trong phòng thí nghiệm NaNO3 (r) + H2SO4 (đ) HNO3 + NaHSO4 Hơi HNO3 thoát ra được dẫn vào bình làm lạnh và ngưng tụ ở đó. 2. Trong công nghiệp - Được sản xuất từ amoniac theo sơ đồ : NH3 NO NO2 HNO3 + Ở to = 850 - 900oC, xt : Pt : 4NH3 +5O2® 4NO +6H2O ; DH = – 907kJ. + Oxi hoá NO thành NO2 : 2NO + O2 ® 2NO2. + Chuyển hóa NO2 thành HNO3 : 4NO2 +2H2O +O2 ® 4HNO3. Dung dịch HNO3 thu được có nồng độ 60 – 62%. Chưng cất với H2SO4 đậm đặc thu được dung dịch HNO3 96 – 98%. PHẦN 2 : MUỐI NITRAT 1. Tính chất vật lý Dễ tan trong nước, là chất điện li mạnh trong dung dịch, chúng phân li hoàn toàn thành các ion. Ví dụ : Ca(NO3)2 ® Ca2+ + 2NO3- - Ion NO3- không có màu, màu của một số muối nitrat là do màu của cation kim loại. Một số muối nitrat dễ bị chảy rữa như NaNO3, NH4NO3. 2. Tính chất hoá học Các muối nitrat dễ bị phân huỷ khi đun nóng. a. Muối nitrat của các kim loại hoạt động (trước Mg): Nitrat Nitrit + O2 2KNO3 2KNO2 + O2 b) Muối nitrat của các kim loại từ Mg đến Cu : Nitrat Oxit kim loại + NO2 + O2 2Cu(NO3)2 2CuO + 4NO2 + O2 c. Muối của những kim loại kém hoạt động ( sau Cu ) : Nitrat kim loại + NO2 + O2 2AgNO3 2Ag + 2NO2 + O2 3. Nhận biết ion nitrat (NO3–) Trong môi trường axit, ion NO3– thể hiện tính oxi hóa giống như HNO3. Do đó thuốc thử dùng để nhận biết ion NO3– là hỗn hợp vụn đồng và dung dịch H2SO4 loãng, đun nóng. Hiện tượng : dung dịch có màu xanh, khí không màu hóa nâu đỏ trong không khí. 3Cu + 8H+ + 2NO3– 3Cu2+ + 2NO↑ + 4H2O (dung dịch màu xanh) 2NO + O2 (không khí) 2NO2 (không màu) (màu nâu đỏ) B. PHƯƠNG PHÁP GIẢI BÀI TẬP VỀ NITƠ VÀ HỢP CHẤT CỦA NITƠ I. Phản ứng tổng hợp, phân hủy NH3 Phương trình phản ứng : N2 (k) + 3H2 (k) 2NH3 (k) (1) Ở phương trình (1), phản ứng thuận là phản ứng tổng hợp NH3 và phản ứng nghịch là phản ứng phân hủy NH3. Phản ứng tổng hợp NH3 là phản ứng thuận nghịch nên hiệu suất phản ứng luôn nhỏ hơn 100%. Hằng số cân bằng của phản ứng thuận là . ● Nhận xét : Trong phản ứng tổng hợp NH3 ta thấy : Thể tích hoặc số mol khí NH3 thu được bằng 1 nửa thể tích hoặc số mol khí H2 và N2 phản ứng. Suy ra thể tích hoặc số mol khí sau phản ứng giảm, lượng giảm bằng 1 nửa lượng phản ứng. Đối với phản ứng phân hủy NH3 thì ngược lại, thể tích hoặc số mol khí sau phản ứng tăng, lượng tăng bằng lượng NH3 phản ứng. Các dạng bài tập liên quan đến phản ứng tổng hợp, phân hủy NH3 : Tính áp suất, hiệu suất phản ứng, thể tích hoặc thành phần phần trăm theo thể tích hay số mol của hỗn hợp trước và sau phản ứng. Tính hằng số cân bằng của phản ứng. Phương pháp giải - Bước 1 : Tính tỉ lệ mol của N2 và H2 trong hỗn hợp (nếu đề cho biết khối lượng mol trung bình của chúng). Từ đó suy ra số mol hoặc thể tích của N2 và H2 tham gia phản ứng. Nếu đề không cho số mol hay thể tích thì ta tự chọn lượng chất phản ứng đúng bằng tỉ lệ mol của N2 và H2. - Bước 2 : Căn cứ vào tỉ lệ mol của N2 và H2 để xác định xem hiệu suất tính theo chất nào (hiệu suất phản ứng tính theo chất thiếu trong phản ứng). Viết phương trình phản ứng căn cứ vào phương trình phản ứng suy ra số mol các chất đã phản ứng (nếu đề chưa cho biết số mol H2 và N2 phản ứng thì ta thường chọn số mol H2 và N2 phản ứng là 3x và x); số mol chất dư và số mol sản phẩm tạo thành. - Bước 3 : Tính tổng số mol hoặc thể tích khí trước và sau phản ứng. Lập biểu thức liên quan giữa số mol khí, áp suất, nhiệt độ của bình chứa trước và sau phản ứng (nếu đề cho biết thông tin về sự thay đổi áp suất). Từ đó suy ra các kết quả mà đề bài yêu cầu. Trên đây cũng là các bước cơ bản để giải một bài tập liên quan đến chất khí nói chung. Trong một bài tập cụ thể tuy thuộc vào giả thiết đề cho mà ta có thể vận dụng linh hoạt các bước trên không nên áp dụng một cách rập khuôn, máy móc. ● Lưu ý : Mối quan hệ giữa số mol khí, áp suất và nhiệt độ khi thực hiện phản ứng trong bình kín có thể tích không đổi : Nếu T2=T1 thì suy ra ; Nếu T2 = T1 và n1 = n2 thì suy ra p1 = p2. ► Các ví dụ minh họa ◄ Ví dụ 1: Trong một bình kín chứa 10 lít nitơ và 10 lít hiđro ở nhiệt độ 0oC và 10 atm. Sau phản ứng tổng hợp NH3, lại đưa bình về 0oC. Biết rằng có 60% hiđro tham gia phản ứng, áp suất trong bình sau phản ứng là : A. 10 atm. B. 8 atm. C. 9 atm. D. 8,5 atm. Hướng dẫn giải Theo phương trình phản ứng tổng hợp NH3 ta thấy N2 và H2 phản ứng theo tỉ lệ là . Theo đề bài ta thấy . Vậy H2 thiếu nên hiệu suất phản ứng tính theo H2. Thể tích H2 phản ứng là 10.60% = 6 lít. Cách 1 : Tính thể tích khi sau phản ứng dựa vào phương trình phản ứng Phương trình phản ứng hoá học : N2 + 3H2 2NH3 (1) bđ: 10 10 0 : lít pư: 2 6 4 : lít spư: 8 4 4 : lít Tổng thể tích N2 và H2 ban đầu là 20 lít. Theo (1) ta thấy tổng thể tích của hỗn hợp N2, H2 và NH3 sau phản ứng là 14 lít. Cách 2 : Tính thể tích khí sau phản ứng dựa vào sự tăng giảm thể tích khí Thể tích H2 phản ứng là 6 lít, suy ra thể tích N2 phản ứng là 2 lít. Tổng thể tích khí phản ứng là 8 lít. Sau phản ứng thể tích khí giảm bằng 1 nửa thể tích khí phản ứng tức là giảm 4 lít. Do đó thể tích khí sau phản ứng là (10 + 10) – 4 = 16 lít. Vì trước và sau phản ứng nhiệt độ không thay đổi nên : Đáp án B. Ví dụ 2: Hỗn hợp X gồm N2 và H2 có Dẫn X đi qua bình đựng bột Fe rồi nung nóng biết rằng hiệu suất tổng hợp NH3 đạt 40% thì thu được hỗn hợp Y. có giá trị là : A. 15,12. B. 18,23. C. 14,76. D. 13,48. Hướng dẫn giải Áp dụng sơ đồ đường chéo cho hỗn hợp N2 và H2 ta có : 28 12,4 – 2 = 10,4 12,4 2 28 – 12,4 = 15,6 Với tỉ lệ trên suy ra H2 thiếu, hiệu suất phản ứng tính theo H2. Trong hỗn hợp X ta chọn Số mol H2 phản ứng là 3.40% = 1,2 mol, suy ra số mol N2 phản ứng là 0,4 mol, số mol NH3 sinh ra là 0,8 mol. Sau phản ứng số mol khí giảm là (1,2 + 0,4) – 0,8 = 0,8 mol. Sau phản ứng số mol khí giảm là 0,8 mol nên : Theo định luật bảo toàn khối lượng ta có : Vậy Đáp án C. Ví dụ 3: Cho hỗn hợp gồm N2, H2 và NH3 có tỉ khối so với hiđro là 8. Dẫn hỗn hợp đi qua dung dịch H2SO4 đặc, dư thì thể tích khí còn lại một nửa. Thành phần phần trăm (%) theo thể tích của mỗi khí trong hỗn hợp lần lượt là : A. 25% N2, 25% H2 và 50% NH3. B. 25% NH3, 25% H2 và 50% N2. C. 25% N2, 25% NH3 và 50% H2. D. 15% N2, 35% H2 và 50% NH3. Hướng dẫn giải Khi cho hỗn hợp gồm N2, H2 và NH3 đi qua dung dịch H2SO4 đặc, dư thì toàn bộ NH3 bị hấp thụ. Theo giả thiết thì sau khi đi qua dung dịch H2SO4 đặc thì thể tích khí còn lại một nửa nên suy ra phần trăm về thể tích của NH3 là 50%, tổng phần trăm thể tích của N2 và H2 là 50%. Áp dụng sơ đồ đường chéo cho hỗn hợp N2 và H2 ta có : 28 15 – 2 = 13 15 2 28 – 15 = 13 %N2 = %H2 = 25%. Đáp án A. Ví dụ 4: Sau quá trình tổng hợp NH3 từ H2 và N2, áp suất trong bình giảm đi 10% so với áp suất lúc đầu. Biết nhiệt độ của phản ứng giữ không đổi trước và sau phản ứng. Phần trăm theo thể tích của N2, H2, NH3 trong hỗn hợp khí thu được sau phản ứng lần lượt là : A. 25% ; 25% ; 50%. B. 30% ; 25% ; 45%. C. 22,22% ; 66,67% ; 11,11%. D. 20% ; 40% ; 40% . Hướng dẫn giải Theo giả thiết nên ta giả sử lúc đầu có 1 mol N2 và 3 mol H2. Trong một bình kín có nhiệt độ không đổi thì áp suất tỉ lệ thuận với số mol hỗn hợp khí : nhỗn hợp khí sau phản ứng = = . Cách 1 : Tính số mol của các chất sau phản ứng dựa vào phản ứng Phương trình phản ứng hoá học: N2 + 3H2 2NH3 (1) bđ: 1 3 0 : mol pư: x 3x 2x : mol spư: 1–x 3–3x 2x : mol Theo (1) ta thấy : nhỗn hợp khí sau phản ứng = (1–x) + (3–3x) + 2x = 4 – 2x = 3,6 x = 0,2 Vậy phần trăm về thể tích của các khí là : Cách 2 : Dựa vào sự tăng giảm thể tích khí Gọi số mol N2 và H2 phản ứng là x và 3x mol. Sau phản ứng số mol khí giảm bằng một nửa lượng phản ứng tức là giảm 2x mol. Ta có : Đáp án C. Ví dụ 5: Hỗn hợp khí X gồm N2 và H2 có tỉ khối so với He bằng 1,8. Đun nóng X một thời gian trong bình kín (có bột Fe làm xúc tác), thu được hỗn hợp khí Y có tỉ khối so với He bằng 2. Hiệu suất của phản ứng tổng hợp NH3 là : A. 50%. B. 36%. C. 40%. D. 25%. Hướng dẫn giải Áp dụng sơ đồ đường chéo cho hỗn hợp N2 và H2 ta có : 28 7,2 – 2 = 5,2 7,2 2 28 – 7,2 = 20,8 Chọn . Phương trình phản ứng hoá học: N2 + 3H2 2NH3 (1) bđ: 1 4 0 : mol pư: x 3x 2x : mol spư: 1–x 4–3x 2x : mol Theo (1) ta thấy : nhỗn hợp khí sau phản ứng = (1–x) + (4–3x) + 2x = 5 – 2x Áp dụng địnhluật bảo toàn khối lượng ta có : mX = mY nX. = nY. . Hiệu suất phản ứng tính theo N2 vì H2 dư : H = Đáp án D. Ví dụ 6: Một bình kín có thể tích là 0,5 lít chứa 0,5 mol H2 và 0,5 mol N2, ở nhiệt độ (toC). Khi ở trạng thái cân bằng có 0,2 mol NH3 tạo thành. Hằng số cân bằng KC của phản ứng tổng hợp NH3 là : A. 1,278. B. 3,125. C. 4,125. D. 6,75. Hướng dẫn giải Theo giả thiết ta thấy ban đầu . Thực hiện phản ứng tổng hợp NH3 đến thời điểm cân bằng Phương trình phản ứng hoá học : N2 + 3H2 2NH3 (1) bđ: 1 1 0 : CM pư: 0,2 0,6 0,4 : CM cb: 0,8 0,4 0,4 : CM Theo (1) tại thời điểm cân bằng [NH3] = 0,8M; [H2] =0,4M; [NH3] = 0,4M. Vậy hằng số cân bằng của phản ứng tổng hợp NH3 là : Đáp án B. II. Tính chất của NH3 và muối amoni (NH4+) ● Những lưu ý về tính chất : Khí NH3 có tính khử mạnh; dung dịch NH3 có tính bazơ yếu và có khả năng tạo phức tan với các muối Cu2+, Zn2+, Ni2+, Ag+. Muối amoni có tính axit. Ví dụ 1: Dẫn 2,24 lít NH3 (đktc) đi qua ống đựng 32 gam CuO nung nóng thu được chất rắn A và khí B. Ngâm chất rắn A trong dung dịch HCl 2M dư. Tính thể tích dung dịch axit đã tham gia phản ứng ? Coi hiệu suất quá trình phản ứng là 100%. A. 0,10 lít. B. 0,52 lít. C. 0,25 lít. D. 0,35 lít. Hướng dẫn giải Theo giả thiết ta có : Phương trình phản ứng : 2NH3 + 3CuO 3Cu + N2 + 3H2O (1) mol: 0,1 0,15 0,15 Theo (1) và giả thiết ta thấy chất rắn A gồm : Phản ứng của A với dung dịch HCl : CuO + 2HCl CuCl2 + H2O (2) mol: 0,25 0,5 Theo (2) và giả thiết ta suy ra : [HCl] = Đáp án C. Ví dụ 2: Dung dịch X chứa các ion sau: Al3+, Cu2+, SO42- và NO3-. Để kết tủa hết ion SO42- có trong 250 ml dung dịch X cần 50 ml dung dịch BaCl2 1M. Cho 500 ml dung dịch X tác dụng với dung dịch NH3 dư thì được 7,8 gam kết tủa. Cô cạn 500 ml dung dịch X được 37,3 gam hỗn hợp muối khan. Nồng độ mol/l của NO3- là : A. 0,2M. B. 0,3M. C. 0,6M. D. 0,4M. Hướng dẫn giải Khi cho X phản ứng với dung dịch BaCl2 thì xảy ra phản ứng : Ba2+ + SO42- BaSO4 (1) mol: 0,05 0,05 Theo (1) và giả thiết suy ra trong 250 ml dung dịch X có 0,05 mol SO42- vậy trong 500 ml dung dịch X có 0,1 mol SO42-. Khi cho X phản ứng với dung dịch NH3 dư thì xảy ra các phản ứng : Al3+ + 3NH3 + 3H2O Al(OH)3 + 3NH4+ (2) mol: 0,1 0,1 Cu2+ + 2NH3 + 2H2O Cu(OH)2 + 2NH4+ (3) Cu(OH)2 + 4NH3 [Cu(NH3)4]2+ + 2OH- (4) Khi cho X phản ứng với dung dịch NH3 dư thì chỉ có Al3+ tạo kết tủa, Cu2+ lúc đầu tạo kết tủa sau đó tạo phức tan vào dung dịch. Theo (2) và giả thiết ta thấy trong 500 ml dung dịch X có 0,1 mol Al3+. Đặt số mol của Cu2+ và NO3- trong 500 ml dung dịch X là x và y, theo định luật bảo toàn điện tích và khối lượng ta có : Vậy [NO3-] = Đáp án C. Ví dụ 3: Có 500 ml dung dịch X chứa Na+, NH4+, CO32- và SO42-. Lấy 100 ml dung dịch X tác dụng với lượng dư dung dịch HCl thu 2,24 lít khí (đktc). Lấy 100 ml dung dịch X cho tác dụng với lượng dư dung dịch BaCl2 thấy có 43 gam kết tủa. Lấy 100 ml dung dịch X tác dụng với lượng dư dung dịch NaOH thu 4,48 lít khí NH3 (đktc). Khối lượng muối có trong 500 ml dung dịch X là : A.14,9 gam. B.11,9 gam. C. 86,2 gam. D. 119 gam. Hướng dẫn giải Phản ứng của dung dịch X với dung dịch HCl : CO32- + H+ CO2 + H2O (1) mol: 0,1 0,1 Phản ứng của dung dịch X với dung dịch BaCl2 : CO32- + Ba2+ BaCO3 (2) mol: 0,1 0,1 SO42- + Ba2+ BaSO4 (3) mol: x x Theo (1), (2), (3) và giả thiết ta có : 0,1.197 + 233.x = 43 x = 0,1 Phản ứng của dung dịch X với dung dịch NaOH : NH4+ + OH- NH3 + H2O (4) mol: 0,2 0,2 Vậy theo các phương trình phản ứng và giả thiết ta thấy trong 100 ml dung dịch X có : 0,1 mol CO32-, 0,1 mol SO42-, 0,2 mol NH4+ và y mol Na+. Áp dụng định luật bảo toàn điện tích ta suy ra : 0,1.2 +0,1.2 = 0,2.1 + y.1 y = 0,2. Khối lượng muối trong 500 ml dung dịch X là : Đáp án D. III. Tính chất của axit HNO3 và muối nitrat 1. Ôn tập phương pháp bảo toàn electron a. Nội dung định luật bảo toàn electron : – Trong phản ứng oxi hóa – khử, tổng số electron mà các chất khử nhường luôn bằng tổng số electron mà các chất oxi hóa nhận. b. Nguyên tắc áp dụng : – Trong phản ứng oxi hóa – khử, tổng số mol electron mà các chất khử nhường luôn bằng tổng số mol electron mà các chất oxi hóa nhận. – Đối với chất khử hoặc hỗn hợp chất khử mà trong đó các nguyên tố đóng vai trò là chất khử có số oxi hóa duy nhất thì cùng một lượng chất phản ứng với các chất oxi hóa (dư) khác nhau, số mol electron mà các chất khử nhường cho các chất oxi hóa đó là như nhau. ● Lưu ý : Khi giải bài tập bằng phương pháp bảo toàn electron ta cần phải xác định đầy đủ, chính xác chất khử và chất oxi hóa; trạng thái số oxi hóa của chất khử, chất oxi hóa trước và sau phản ứng; không cần quan tâm đến số oxi hóa của chất khử và chất oxi hóa ở các quá trình trung gian. 2. Phương pháp giải toán về HNO3 và muối nitrat Dạng 1: HNO3 tác dụng với chất khử (kim loại, oxit kim loại, oxit phi kim, muối) Phương pháp giải - Bước 1 : Lập sơ đồ phản ứng biểu diễn quá trình chuyển hóa giữa các chất (Sau này khi đã làm thành thạo thì học sinh có thể bỏ qua bước này). - Bước 2 : Xác định đầy đủ, chính xác chất khử và chất oxi hóa ; trạng thái số oxi hóa của chất khử, chất oxi hóa trước và sau phản ứng ; không cần quan tâm đến số oxi hóa của chất khử và chất oxi hóa ở các quá trình trung gian nếu phản ứng xảy ra nhiều giai đoạn. - Bước 3 : Thiết lập phương trình toán học : Tổng số mol electron chất khử nhường bằng tổng số mol electron mà chất oxi hóa nhận, kết hợp với các giả thiết khác để lập các phương trình toán học khác có liên quan. Giải hệ phương trình để suy ra kết quả mà đề yêu cầu. ● Lưu ý : - Trong phản ứng của kim loại Mg, Al, Zn với dung dịch HNO3 loãng thì ngoài những sản phẩm khử là khí N2, N2O, NO thì trong dung dịch còn có thể có một sản phẩm khử khác là muối NH4NO3. Để tính toán chính xác kết quả của bài toán ta phải kiểm tra xem phản ứng có tạo ra NH4NO3 hay không và số mol NH4NO3 đã tạo ra là bao nhiêu rồi sau đó áp dụng định luật bảo toàn electron để tìm ra kết quả. ►Các ví dụ minh họa ◄ 1. Tính lượng chất phản ứng với dung dịch HNO3 Ví dụ 1: Chia m gam hỗn hợp A gồm hai kim loại Cu, Fe thành hai phần bằng nhau : - Phần 1 tác dụng hoàn toàn với dung dịch HNO3 đặc, nguội thu được 0,672 lít khí. - Phần 2 tác dụng hoàn toàn với dung dịch H2SO4 loãng dư thu được 0,448 lít khí. Giá trị của m là (biết các thể tích khí được đo ở đktc) : A. 4,96 gam. B. 8,80 gam. C. 4,16 gam. D. 17,6 gam. Hướng dẫn giải Cách 1 : Tính toán theo phương trình phản ứng Hỗn hợp Cu, Fe khi tác dụng với dung dịch HNO3 đặc, nguội thì chỉ có Cu phản ứng : Cu + 4HNO3 Cu(NO3)2 + 2NO2 + 2H2O (1) mol: 0,015 0,03 Hỗn hợp Cu, Fe khi tác dụng H2SO4 loãng thì chỉ có Fe phản ứng : Fe + H2SO4 FeSO4 + H2 (2) mol: 0,02 0,02 Theo (1), (2) và giả thiết ta có : Khối lượng của Cu và Fe trong A là : m = 2(0,015.64 + 0,02.56) = 4,16 gam. Cách 2 : Sử dụng định luật bảo toàn electron Khi A phản ứng với dung dịch HNO3 đặc, nguội sẽ xảy ra các quá trình oxi hóa - khử Cu Cu+2 + 2e N+5 + 1e N+4 mol: 0,015 0,03 0,03 0,03 Căn cứ vào các quá trình oxi hóa - khử và định luật bảo toàn electron ta có Khi A phản ứng với dung dịch H2SO4 loãng sẽ xảy ra các quá trình oxi hóa - khử : Feo Fe+2 + 2e 2H+ + 2e H2o mol: 0,02 0,04 0,04 0,02 Căn cứ vào các quá trình oxi hóa - khử và định luật bảo toàn electron ta có Khối lượng của Cu và Fe trong A là : m = 2(0,015.64 + 0,02.56) = 4,16 gam. Đáp án C. Ví dụ 2: Hòa tan hết 0,02 mol Al và 0,03 mol Cu vào dung dịch HNO3, cô cạn dung dịch sau phản ứng và nung đến khối lượng không đổi thì thu được m gam chất rắn. Giá trị của m là : A. 3,42 gam. B. 2,94 gam. C. 9,9 gam. D. 7,98 gam. Hướng dẫn giải Sơ đồ phản ứng : 2Al 2Al(NO3)3 Al2O3 (1) mol: 0,02 0,02 0,01 Cu Cu(NO3)2 CuO (2) mol: 0,03 0,03 0,03 Áp dụng định luật bảo toàn nguyên tố cho sơ đồ (1), (2) ta thấy : mol ; mol. Vậy khối lượng chất rắn thu được là : 0,01.102 + 0,03.80 = 3,42 gam. Đáp án A. Ví dụ 3: Hoà tan hoàn toàn hỗn hợp gồm x mol FeS2 và y mol Cu2S vào axit HNO3 (vừa đủ), thu được dung dịch X (chỉ chứa hai muối sunfat) và khí duy nhất NO. Tỉ lệ x : y là : A. 1 : 3. B. 3 : 1. C. 1 : 2. D. 2 : 1. Hướng dẫn giải Sơ đồ phản ứng : 2FeS2 + Cu2S ¾® Fe2(SO4)3 + 2CuSO4 (1) Áp dụng định luật bảo toàn nguyên tố cho sơ đồ (1), ta thấy : Þ x : y = 2 : 1 Đáp án D. Ví dụ 4: Hòa tan hoàn toàn m gam Al trong dung dịch HNO3 loãng thu được 1,12 lít hỗn hợp X gồm 3 khí NO, N2O, N2 có tỉ lệ số mol là: 1 : 2 : 2. Giá trị của m là : A. 5,4 gam. B. 3,51 gam. C. 2,7 gam. D. 8,1 gam. Hướng dẫn giải Theo giả thiết ta có : Mặt khác, tỉ lệ mol của 3 khí NO, N2O, N2 là 1 : 2 : 2 nên suy ra : nNO = 0,01 mol ; = 0,02 mol và = 0,02 mol. Các quá trình oxi hóa – khử : Al Al+3 + 3e N+5 + 3e N+2 (NO) 2N+5 + 8e 2N+1 (N2O) 2N5+ + 10e N2o Áp dụng định luật bảo toàn electron ta có : Đáp án B. Ví dụ 5: Hòa tan 15 gam hỗn hợp X gồm hai kim loại Mg và Al vào dung dịch Y gồm HNO3 và H2SO4 đặc thu được 0,1 mol mỗi khí SO2, NO, NO2, N2O. Phần trăm khối lượng của Al và Mg trong X lần lượt là : A. 63% và 37%. B. 36% và 64%. C. 50% và 50%. D. 46% và 54%. Hướng dẫn giải Đặt nMg = x mol ; nAl = y mol. Ta có : 24x + 27y = 15 (1) Quá trình oxi hóa : Mg ® Mg+2 + 2e Al ® Al+3 + 3e mol : x ® 2x y ® 3y Þ Tổng số mol electron nhường bằng (2x + 3y). Quá trình khử : N+5 + 3e ® N+2 2N+5 + 8e ® 2N+1 mol : 0,3 0,1 0,8 0,2 N+5 + 1e ® N+4 S+6 + 2e ® S+4 mol : 0,1 0,1 0,2 0,1 Þ Tổng số mol electron nhận bằng 1,4 mol. Theo định luật bảo toàn electron ta có : 2x + 3y = 1,4 (2) Giải hệ (1), (2) ta được : x = 0,4 mol ; y = 0,2 mol. Þ %Mg = 100% - 36% = 64%. Đáp án B. Ví dụ 6: Cho m gam bột Fe vào dung dịch HNO3 lấy dư, ta được hỗn hợp gồm hai khí NO2 và NO có VX = 8,96 lít (đktc) và tỉ khối đối với O2 bằng 1,3125. Thành phần phần trăm theo thể tích của NO, NO2 và khối lượng m của Fe đã dùng là : A. 25% và 75% ; 1,12 gam. B. 25% và 75% ; 11,2 gam. C. 35% và 65% ; 11,2 gam. D. 45% và 55% ; 1,12 gam. Hướng dẫn giải Ta có : nX = 0,4 mol; = 42. Áp dụng sơ đồ đường chéo cho hỗn hợp N2O và NO ta có : 46 42 – 30 = 12 42 30 46 – 42 = 4 Đặt Þ 4x = 0,4 Þ x = 0,1 Þ Þ Quá trình oxi hóa : Fe ® Fe+3 + 3e mol : a ® 3a Quá trình khử : N+5 + 3e ® N+2 mol : 0,3 ¬ 0,1 N+5 + 1e ® N+4 mol : 0,3 ¬ 0,3 Áp dụng định luật bảo toàn electron ta có : 3a = 0,6 Þ a = 0,2 mol Þ mFe = 0,2.56 = 11,2 gam. Đáp áp B. Ví dụ 7: Cho 12 gam hỗn hợp hai kim loại Fe, Cu tác dụng vừa đủ với dung dịch HNO3 63%. Sau phản ứng thu được dung dịch A và 11,2 lít khí NO2 duy nhất (đktc). Nồng độ % các chất có trong dung dịch A là : A. 36,66% và 28,48%. B. 27,19% và 21,12%. C. 27,19% và 72,81%. D. 78,88% và 21,12%. Hướng dẫn giải Phương trình phản ứng : Fe + 6HNO3 Fe(NO3)3 + 3NO2 + 3H2O Cu + 4HNO3 Cu(NO3)2 + 2NO2 + 2H2O mol Þ mol. Áp dụng định luật bảo toàn khối lượng ta có : Đặt nFe = x mol, nCu = y mol ta có: Þ Đáp án B. Ví dụ 8: Hòa tan 4,59 gam Al bằng dung dịch HNO3 thu được hỗn hợp khí NO và N2O có tỉ khối hơi đối với hiđro bằng 16,75. Thể tích NO và N2O thu được lần lượt là : A. 2,24 lít và 6,72 lít. B. 2,016 lít và 0,672 lít. C. 0,672 lít và 2,016 lít. D. 1,972 lít và 0,448 lít. Hướng dẫn giải Áp dụng sơ đồ đường chéo cho hỗn hợp N2O và NO ta có : 44 33,5 – 30 = 3,5 33,5 30 44 – 33,5 = 10,5 Đặt Quá trình oxi hóa : Al ® Al+3 + 3e mol: 0,17 3.0,17 Quá trình khử : mol: 9x 3x mol: 8x x Áp dụng định luật bảo toàn electron ta có : 3.+ 8.= 3. 9x + 8x = 3.0,17 x = 0,03 Thể tích NO và N2O thu được là : lít ; lít. Đáp án B. Ví dụ 9: Hòa tan hoàn toàn 12 gam hỗn hợp Fe, Cu (tỉ
Tài liệu đính kèm:
 ly_thuyet_va_bai_tap_trac_nghiem_hoa_hoc_lop_11_chuyen_de_2.docx
ly_thuyet_va_bai_tap_trac_nghiem_hoa_hoc_lop_11_chuyen_de_2.docx






