Lý thuyết Hóa hữu cơ 12
Bạn đang xem tài liệu "Lý thuyết Hóa hữu cơ 12", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
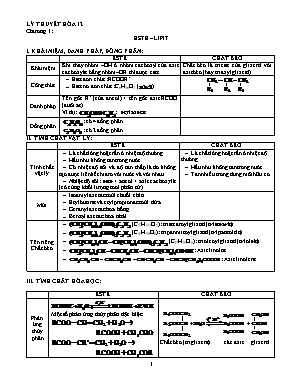
LÝ THUYẾT HÓA 12 Chương 1: ESTE – LIPIT I. KHÁI NIỆM, DANH PHÁP, ĐỒNG PHÂN: ESTE CHẤT BÉO Khái niệm Khi thay nhóm –OH ở nhóm cacboxyl của axit cacboxylic bằng nhóm –OR thì được este Chất béo là trieste của glixerol với axit béo (hay triaxylglixerol) Công thức Este đơn chức: RCOOR’ Este no đơn chức: CnH2nO2 () Danh pháp Tên gốc R’ (của ancol) + tên gốc axit RCOO (đuôi at) Ví dụ: : etylaxetat Đồng phân : có 4 đồng phân : có 2 đồng phân II. TÍNH CHẤT VẬT LÝ: ESTE CHẤT BÉO Tính chất vật lý Là chất lỏng hoặc rắn ở nhiệt độ thường Hầu như không tan trong nước Có nhiệt độ sôi và độ tan thấp là do không tạo được liên kết hiđro với nước và với nhau Nhiệt độ sôi: este < ancol < axit cacboxylic (có cùng khối lượng mol phân tử) Là chất lỏng hoặc rắn ở nhiệt độ thường Hầu như không tan trong nước Tan nhiều trong dung môi hữu cơ Mùi Isoamyl axetat: mùi chuối chín Etyl butirat và etyl propionat: mùi dứa Geranyl axetat: hoa hồng Benzyl axetat: hoa nhài Tên riêng Chất béo (C57H110O6): tristearoylglixerol (tristearin) (C51H98O6): tripanmitoylglixerol (tripanmitin) (C57H98O6): trioleoylglixerol (triolein) : Axit linoleic : Axit linolenic III. TÍNH CHẤT HÓA HỌC: ESTE CHẤT BÉO Phản ứng thủy phân Một số phản ứng thủy phân đặc biệt: Chất béo (triglixerit) các axit glixerol Phản ứng xà phòng hóa Chất béo (triglixerit) xà phòng glixerol Cộng hiđro (C17H33COO)3C3H5(lỏng) + 3H2 (C17H35COO)3C3H5(rắn) Phản ứng đặc biệt Lưu ý Thủy phân este trong môi trường axit có đặc điểm thuận nghịch Thủy phân este trong môi trường kiềm (xà phòng hóa) có đặc điểm không thuận nghịch Phản ứng cộng hiđro dùng để chuyển từ chất lỏng sang chất rắn Chất béo và este đều có phản ứng thủy phân Dầu mỡ để lâu có mùi khó chịu là do liên kết đôi C=C ở gốc axit bị oxi hóa chậm bởi oxi thành peoxit, phân hủy tạo thành anđehit có mùi khó chịu Chỉ số axit của chất béo là số mg KOH cần để trung hòa lượng axit béo tự do trong 1 gam chất béo . Chỉ số xà phòng hóa là số mg KOH cần để xà phòng hóa hoàn toàn 1 gam chất béo. IV. ĐIỀU CHẾ, ỨNG DỤNG: ESTE CHẤT BÉO Điều chế Ứng dụng Dung môi tách, chiết chất hữu cơ, pha sơn Chất tạo hương Dùng sản xuất chất dẻo Điều chế xà phòng và glixerol Sản xuất thực phẩm: mì sợi, đồ hộp Thức ăn quan trong của con người Nguồn dinh dưỡng quan trọng Chương 2: CACBOHIĐRAT (còn gọi là GLUXIT hay SACCARIT) I. PHÂN LOẠI CACBOHIĐRAT: CACBOHI ĐRAT Khi bị thủy phân tạo ra monosaccarit Glucozơ và fructozơ (là đồng phân của nhau) Monosaccarit Đisaccarit Saccarozơ và mantozơ (là đồng phân của nhau) 2 phân tử monosaccarit Polisaccarit Tinh bột và xenlulozơ (là đồng phân của nhau) Nhiều phân tử monosaccarit II. CÁC PHẢN ỨNG CHỨNG MINH CẤU TẠO GLUCOZƠ: Phản ứng với Chứng minh glucozơ AgNO3/NH3 (phản ứng tráng bạc), nước brom Có nhóm anđehit –CHO Cu(OH)2 tạo dung dịch màu xanh lam Có nhiều nhóm hiđroxyl –OH (kề nhau) CH3COOH tạo este chứa 5 gốc axit CH3COO- Có 5 nhóm –OH Khử hoàn toàn glucozơ thu được hexan Có 6 nguyên tử cacbon và mạch không phân nhánh III. TÍNH CHẤT VẬT LÝ VÀ TRẠNG THÁI TỰ NHIÊN: GLUCOZ Ơ FRUCTOZ Ơ SACCAROZƠ TINH BỘT XENLULOZƠ CTPT C6H12O6 C6H12O6 C12H22O11 (C6H10O5)n (C6H10O5)n Cấu tạo Ancol 5 chức và anđehit 1 chức Ancol 5 chức và xeton 1 chức Nhiều mắt xích (Amilozơ và amilopectin) Nhiều gốc Trạng thái Chất rắn Chất rắn Chất rắn Chất rắn Chất rắn Màu sắc Không màu Không màu Không màu Không màu Không màu Tính tan Dễ tan trong nước Dễ tan trong nước Tan tốt trong nước Không tan trong nước Không tan trong nước Tan trong nước Svayde Vị Ngọt Ngọt Ngọt Trong tự nhiên Mật ong khoảng 30% Máu người 0,1%... Đường nho Mật ong 40%... Đường mía, đường kính, đường kết tinh, đường phèn, đường củ cải, đường thốt nốt Gạo khoai chuối xanh, táo Trong bông Ghi chú Độ ngọt sắp theo thứ tự: glucozơ < saccarozơ < fructozơ Trong tinh bột các gốc liên kết với nhau bằng liên kết () Trong tinh bột các đoạn mạch (20 – 30 mắt xích) liên kết với nhau bằng liên kết () Mantozơ còn gọi là đường mạch nha IV. TÍNH CHẤT HÓA HỌC: GLUCOZ Ơ FRUCTOZ Ơ Cu(OH)2 (to thường) 2C6H12O6 + Cu(OH)2(C6H11O6)2Cu + 2H2O (Dung dịch xanh lam) Phản ứng tương tự glucozơ Phản ứng tạo este Phản ứng tráng bạc HOCH2[CHOH]4CHO+2AgNO3+3NH3+ H2O HOCH2[CHOH]4COONH4 + 2Ag+ 2NH4NO3 Amoni gluconat Cu(OH)2 trong NaOH (đun nóng) HOCH2[CHOH]4CHO + 2Cu(OH)2+NaOH HOCH2[CHOH]4COONa + Cu2O+ 3H2O Natri gluconat (đỏ gạch) Tạo kết tủa đỏ gạch H2/Ni, to HOCH2[CHOH]4CHO + H2 HOCH2[CHOH]4CH2OH Sobitol Tạo poliancol Phản ứng lên men SACCAROZ Ơ TINH BỘT XENLULOZƠ Cu(OH)2 (tothường) 2C12H22O11 + Cu(OH)2 (C12H21O11)2Cu + 2H2O Phản ứng thủy phân C12H22O11 + H2O C6H12O6 + C6H12O6 Saccarozơ glucozơ fructozơ (C6H10O5)n + nH2O nC6H12O6 Glucozơ (C6H10O5)n + nH2O nC6H12O6 Glucozơ Phản ứng màu Tinh bột Chất có màu xanh tím Phản ứng HNO3đặc, anhiđric axetic Ghi chú Glucozơ, saccarozơ, fructozơ, xenlulozơ có phản ứng của ancol đa chức (poliancol) Fructozơ phản ứng với AgNO3/NH3, Cu(OH)2 xảy ra trong môi trường kiềm Glucozơ thể hiện tính oxi hóa khi tác dụng với H2/Ni đun nóng Glucozơ thể hiện tính khử khi tác dụng với AgNO3/NH3, Cu(OH)2, đun nóng Xenlulozơ trinitrat dùng làm thuốc súng không khói V. TÓM TẮT TÍNH CHẤT HÓA HỌC: Phản ứng Các chất có phản ứng Cu(OH)2, tạo dd xanh lam, to thường Glucozơ Fructozơ Saccarozơ Phản ứng thủy phân Saccarozơ Tinh bột Xenlulozơ Mantozơ H2/Ni, to Glucozơ Fructozơ Cu(OH)2, to tạo kết tủa đỏ gạch Glucozơ Fructozơ Phản ứng tráng bạc Glucozơ Fructozơ Phản ứng màu Tinh bột IV. ĐIỀU CHẾ: GLUCOZƠ Thủy phân tinh bột hoặc xenlulozơ Lục hợp HCHO Quang hợp V. ỨNG DỤNG: GLUCOZ Ơ FRUCTOZ Ơ SACCAROZƠ TINH BỘT XENLULOZƠ Làm thuốc tăng lực Tráng gương, tráng ruột phích Sản xuất ancol Làm bánh kẹo Pha chế thuốc Tráng gương, tráng ruột phích Sản xuất bánh, kẹo, hồ dán Chế biến giấy Sản xuất tơ nhân tạo (tơ visco, tơ axetat) Chế tạo thuốc súng không khói, phim ảnh Chương 3: AMIN, AMINO AXIT VÀ PROTEIN A. AMIN, AMINO AXIT: I. KHÁI NIỆM, PHÂN LOẠI, DANH PHÁP: AMIN AMINO AXIT Khái niệm Khi thay thế nguyên tử H trong phân tử NH3 bằng gốc hiđrocacbon ta thu được amin Ví dụ: CH3-NH-CH3: đimetylamin (N-metylmetanamin) (CH3)3N : trimetylamin (N,N-đimetylmetanamin) C6H5-NH2: phenylamin(bezenamin) anilin Là loại hợp chất hữu cơ tạp chức, phân tử chứa đồng thời nhóm amino (-NH2) và nhóm cacboxyl (-COOH) Công thức tổng quát: Ví dụ: Amino axit no, 1 axit, 1 amin: CnH2n+1O2N Phân loại Theo gốc hiđrocacbon Amin béo: CH3-NH2, C2H5-NH2. Amin thơm: C6H5-NH2.. Theo bậc của amin Amin bậc một: CH3-NH2 Amin bậc hai: CH3-NH-CH3 Amin bậc ba: (CH3)3N Danh pháp Tên gốc – chức: Tên amin = tên gốc hiđrocacbon + yl + amin. Tên thay thế: Tên amin = tên ankan tương ứng + vị trí + amin Tên thông thường chỉ áp dụng cho một số amin Nếu có nhiều nhóm chức thì thêm các tiếp đầu ngữ đi, tri. Ví dụ: NH2-(CH2)6-NH2: hexametylenđiamin Tên thay thế: Tên amino = axit + vị trí + amino + tên axit tương ứng axit 2-aminopropanoic Tên bán hệ thống: Tên amino = Axit + chữ cái chỉ vị trí + amino + tên axit tương ứng axit -aminopropionic -Tên thông thường: alanin Lưu ý C4H11N: 8 đồng phân (bậc 1 có 4, bậc 2 có 3, bậc 3 có 1) C3H9N: 4 đồng phân (bậc 1 có 2, bậc 2 có 1, bậc 3 có 1) II. CẤU TẠO PHÂN TỬ VÀ TÍNH CHẤT VẬT LÝ: AMIN AMINO AXIT Cấu tạo phân tử Trong phân tử amin, nguyên tử nitơ tạo được một, hai hoặc ba liên kết với nguyên tử cacbon. Amino axit là những hợp chất có cấu tạo ion lưỡng cực H2N-CH2-COOH H3N+-CH2-COO- dạng phân tử dạng ion lưỡng cực Tính chất vật lý Metyl, đimetyl amin, trimetylamin là những chất khí, mùi khai, tan nhiều trong nước Chất rắn kết tinh, dễ tan trong nước, nhiệt độ nóng chảy cao Ứng dụng Amino axit thiên nhiên là cơ sở kiến tạo nên các loại protein của cơ thể sống. Làm gia vị: bột ngọt muối momo natri của axit glutamic (mì chính), thuốc hỗ trợ thần kinh, thuốc bổ gan (axit glutamic) Sản xuất tơ nilon - 6, nilon - 7 III. TÍNH CHẤT HÓA HỌC: AMIN AMINO AXIT Tác dụng axit Amin làm quỳ tím hóa xanh (trừ anilin) CH3NH2 + H2O[CH3NH3]+ + OH- C6H5-NH2 + HCl [C6H5-NH3]+Cl- Phenylamoni clorua HOOC-CH2NH2+HCl HOOC-CH2NH3+Cl- Amino axit có công thức: Nếu x = y: quỳ tím không đổi màu Nếu x > y: quỳ tím hóa xanh Nếu x < y: quỳ tím hóa đỏ Tác dụng kiềm H2N-CH2-COOH + NaOH H2N-CH2-COONa + H2O Amino axit có tính lưỡng tính Phản ứng thế ở nhân thơm (nhóm NH2) Phản ứng este hóa H2N-CH2-COOH + C2H5OH H2N-CH2-COOC2H5 + H2O (Cl-H3N+-CH2-COOC2H5) Phản ứng trùng ngưng nH2N-[CH2]5-COOH (-NH-[CH2]5-CO-)n + nH2O axit -aminocaproic policaproamit Lực bazơ IV. ĐIỀU CHẾ: AMIN AMINO AXIT B. PEPTIT VÀ PROTEIN: PEPTIT PROTEIN Khái niệm Peptit là loại hợp chất chứa từ 2 đến 50 gốc -amino axit liên kết với nhau bởi các liên kết peptit Liên kết peptit là liên kết –CO-NH- giữa hai đơn vị -amino axit. Nhóm –CO-NH- giữa hai đơn vị -amino axit được gọi là nhóm peptit. -Protein là những polipeptit cao phân tử có phân tử khối từ vài chục nghìn đến vài triệu Phân loại Những phân tử chứa 2, 3, 4gốc -amino axit gọi là đi, tri, tetrapeptitchứa nhiều hơn 10 gọi là polipeptit Protein đơn giảnhỗn hợp các -amino axit Protein phức tạp: gồm protein đơn giản + phi protein (axit nucleic, lipoprotein) Danh pháp Tên peptit = tên thường của amino axit kết hợp với nhau Ví dụ: Ala – Gly, Gly – Ala – Lys Tính chất vật lý Tan trong nước tạo thành dung dịch keo và bị đông tụ lại khi đun nóng Sự đông tụ và kết tủa protein cũng xảy ra khi cho axit, bazơ hoặc một muối vào dung dịch protein. Tính chất hóa học a)Phản ứng thủy phân: b)Phản ứng màu biure: peptit + Cu(OH)2phức chất màu tím Điều kiện: peptit phải có từ hai liên kết peptit trở lên Protein bị hủy phânchuỗi polipeptitcác -amino axit Protein + CuSO4màu tím xanh Chương 4: POLIME VÀ VẬT LIỆU POLIME A. POLIME: POLIME Khái niệm Polime là những hợp chất có phân tử khối rất lớn do nhiều đơn vị cơ sở (gọi là mắt xích) liên kết với nhau tạo nên. Mắt xích là đơn vị cơ sở liên kết với nhau tạo thành polime. CH2=CH2 (-CH2-CH2-)n monome polime n: hệ số polime (độ polime hóa) Danh pháp Tên của polime xuất phát từ tên monome hoặc tên của loại hợp chất + tiền tố poli Ngoài ra một số polime có tên thường: TD: (-CH2-CH2-)n : polietilen (-NH-[CH2]5-CO-)n : policaproamit (-CF2-CF2-) : teflon Phân loại Polime thiên nhiên: tinh bột Polime tổng hợp: Polime trùng hợp: polietilen Polime trùng ngưng: nilon - 6 Polime bán tổng hợp: tơ visco Đặc điểm Mạch không nhánh: amilozơ Mạch phân nhánh: amilopectin, glicogen Mạch mạng lưới không gian: cao su lưu hóa, nhựa bakelit Tính chất vật lý Polime là chất rắn, không bay hơi, không có nhiệt độ nóng chảy xác định. Chất nhiệt dẻo: là polime khi nóng chảy cho chất lỏng nhớt, để nguội sẽ rắn lại. Chất nhiệt rắn: là polime không nóng chảy khi đun mà bị phân hủy Polime có tính dẻo: polietilen, polipropilen Polime có tính đàn hồi: polibutađien, poliisopren Polime dễ kéo thành sợi dai, bền: nilon – 6, xenlulozơ Polime trong suốt, không giòn: polimetylmetacrylat Polime có tính cách điện, cách nhiệt: polietilen, polivinyl clorua Polime bán dẫn: polianilin, polithiophen Tính chất hóa học 1. Phản ứng giữ nguyên mạch polime: 2. Phản ứng cắt mạch polime: Polime có nhóm chức trong mạch dễ bị thủy phân TD: xenlulozơ, poliamit, protein Polime trùng hợp bị nhiệt phân (giải trùng hợp hay đepolime hóa) 3. Phản ứng tăng mạch polime: (phản ứng khâu mạch polime) Phương pháp điều chế 1.Phản ứng trùng hợp: Điều kiện: phân tử phải có liên kết bội hoặc vòng kém bền có thể mở ra TD: Trùng hợp là quá trình kết hợp nhiều phân tử nhỏ (monome) giống nhau hay tương tự nhau thành phân tử lớn (polime) 2.Phản ứng trùng ngưng: Điều kiện: trong phân tử phải có ít nhất hai nhóm chức có khả năng phản ứng TD: nH2N-[CH2]5-COOH (-NH-[CH2]5-CO-)n + nH2O axit -aminocaproic policaproamit Trùng ngưng là quá trình kết hợp nhiều phân tử nhỏ (monome) thành phân tử lớn (polime) đồng thời giải phóng những phân tử nhỏ khác B. VẬT LIỆU POLIME: I. CHẤT DẺO VÀ TƠ: CHẤT DẺO TƠ Khái niệm Chất dẻo là những vật liệu polime có tính dẻo. Thành phần chủ yếu của chất dẻo là polime Vật liệu compozit là vật liệu hỗn hợp gồm ít nhất hai thành phần phân tán vào nhau mà không tan vào nhau. Thành phần của vật liệu compozit gồm chất nền (polime) và chất độn Vật liệu compozit có độ bền, độ chịu nhiệt tăng so với các polime thành phẩm. Tơ là những polime hình sợi dài và mảnh, có độ bền nhất định Đặc điểm: Phân tử polime trong tơ có mạch không phân nhánh, sắp xếp song song với nhau, mền, dai, không độc Phân loại Tơ thiên nhiên: bông, len, tơ tằm Tơ hóa học Tơ tổng hợp: tơ poliamit (nilon, capron ), tơ vinylic thế (vinilon, nitron) Tơ bán tổng hợp: tơ visco, tơ xenlulozơ axetat Một số loại 1) Polietilen (PE): 2) Poli propilen (P.P): 3) Poli(vinyl clorua) (PVC): Vinyl clorua PVC poli(vinyl clorua) 4) Polivinyl axetat (P.V.A) 5) Polistiren (P.S): 6) Poli(metyl metacrylat): Thủy tinh hữu cơ (plexiglas) 7) Poli tetra flo etilen (Teflon): 8) Cupren: 9) Poli fomanđehit: 10) Poli(phenol fomanđehit) (PPF): Gồm ba dạng: nhựa novalac, nhựa rezol, nhựa rezit Nếu anđehit fomic dư và xúc tác bazơ nhựa rezol nhựa rezit 1) Tơ nilon-6,6: 2) Tơ nitron: (hay olon) 3) Tơ clorin: C2nH3nCln + Cl2 ® C2nH3n-1Cln+1 + HCl 4) Tơ capron (nilon – 6): 5) Tơ polieste (lapsan): 6) Tơ visco: 7) Tơ axetat: 8) Tơ enang (nilon – 7): Ứng dụng PVC dùng làm vật liệu cách điện, ống dẫn nước, vải che mưa Tơ nilon -6,6: dùng dệt vải may mặc, vải lót săm lốp xe, dệt bít tất, bện làm dây cáp, dây dù, đan lưới Tơ nitron: dùng dệt vải may quần áo ấm hoặc bện thành sợi len đan áo rét II. CAO SU VÀ KEO DÁN TỔNG HỢP: CAO SU KEO DÁN TỔNG HỢP Khái niệm Cao su là loại vật liệu polime có tính đàn hồi Tính đàn hồi là tính bị biến dạng khi chịu lực tác dụng bên ngoài và trở lại dạng ban đầu khi lực đó thôi tác dụng. -Bản chất: Có thể tạo ra màng hết sức mỏng, bền chắc giữa hai mảnh vật liệu Phân loại Cao su thiên nhiên: poliisopren Cao su tổng hợp: Một số loại Cao su buna-S: Cao su buna: Cao su buna-N: 4) Cao su isopren (cao su thiên nhiên): 5) Cao su cloropren: 1) Nhựa vá săm: 2) Keo dán epoxi: keo dán hai thành phần 3) Keo dán ure-fomanđehit: Ứng dụng Cao su thiên nhiên có tính đàn hồi, không dẫn điện và nhiệt, không thấm khí và nước, không tan trong nước, etanol, axeton Cao su lưu hóa có tính đàn hồi, chịu nhiệt, lâu mòn, khó tan trong các dung môi hơn cao su thường Keo epoxi dùng để dán các vật liệu bằng kim loại, thủy tinh, chất dẻo trong các ngành sản xuất oto, máy bay, xây dựng và trong đời sống Keo dán ure – fomanđehit dùng dán các vật liệu bằng gỗ, chất dẻo C. NHẬN BIẾT MỘT SỐ CHẤT HỮU CƠ: HCHC Thuốc thử Hiện tượng Phương trình phản ứng Anken Dung dịch brom Mất màu dung dịch CH3CH = CHCH2CH3 +Br2 ® CH3CHCHCH2CH3 ½ ½ Br Br Dung dịch KMnO4 Mất màu dung dịch 3CH2=CH2 + 4H2O + 2KMnO4 3HO-CH2-CH2-OH + 2MnO2 + 2KOH Ankin Dung dịch brom Mất màu dung dịch HC º CH + Br2 ® Br2HC-CHBr2 Dung dịch KMnO4 Mất màu dung dịch AgNO3/NH3 Tạo kết tủa vàng HCºCH+2AgNO3+2NH3®AgCºCAg +2NH4NO3 Ancol Kim loại Natri Sủi bọt khí 2CnH2n + 1 – OH + 2Na ® 2CnH2n + 1 – ONa + H2 Phenol Kim loại Natri Sủi bọt khí 2C6H5OH + 2Na2C6H5ONa + H2 Dung dịch Brom Tạo kết tủa trắng Anđehit AgNO3/NH3 Kết tủa trắng bạc RCHO + 2AgNO3 + H2O + 3NH3 RCOONH4 + 2NH4NO3 + 2Ag Cu(OH)2 đun nóng Tạo kết tủa đỏ gạch Axit cacboxylic Quỳ tím Hóa đỏ CaCO3, Na2CO3 Sủi bọt khí 2CH3COOH+CaCO3(CH3COO)2Ca+H2O+CO2 Kim loại Na, Sủi bọt khí 2CH3COOH + Zn (CH3COO)2Zn + H2 Glucozơ Cu(OH)2 to thường Tạo dung dịch xanh lam Cu(OH)2 đun nóng Tạo kết tủa đỏ gạch Saccarozơ Cu(OH)2 to thường Tạo dung dịch xanh lam Tinh bột Iot Màu xanh tím Fructozơ Cu(OH)2 to thường Tạo dung dịch xanh lam Glixerol Cu(OH)2 to thường Tạo dung dịch xanh lam 2C3H5(OH)3+Cu(OH)2®[C3H5(OH)2O]2Cu+2H2O Peptit và protein Cu(OH)2 to thường Màu xanh tím
Tài liệu đính kèm:
 ly_thuyet_hoa_huu_co_12.doc
ly_thuyet_hoa_huu_co_12.doc





