Kiểm tra học kì I - Năm 2015-2016 Trường THCS Nghĩa Trung môn Hóa – lớp 8
Bạn đang xem tài liệu "Kiểm tra học kì I - Năm 2015-2016 Trường THCS Nghĩa Trung môn Hóa – lớp 8", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
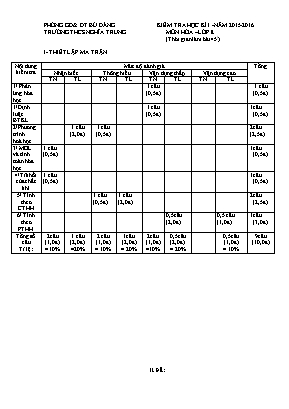
PHÒNG GD& ĐT BÙ ĐẰNG KIỂM TRA HỌC KÌ I -NĂM 2015-2016 TRƯỜNG THCS NGHĨA TRUNG MÔN HÓA –LỚP 8 (Thời gian làm bài 45/) I- THIẾT LẬP MA TRẬN Nội dung kiểm tra Mức độ đánh giá Tổng Nhận biết Thông hiểu Vận dụng thấp Vận dụng cao TN TL TN TL TN TL TN TL 1/ Phản ứng hóa học 1 câu (0,5đ) 1 câu (0,5đ) 1/Định luật BTKL 1 câu (0,5đ) 1câu (0,5đ) 2/Phương trình hoá học 1 câu (2,0đ) 1 câu (0,5đ) 2câu (2,5đ) 3/ MOL và tính toán hóa học 1 câu (0,5đ) 1câu (0,5đ) 4/Tỉ khối của chất khí 1 câu (0,5đ) 1câu (0,5đ) 5/ Tính theo CTHH 1 câu (0,5đ) 1 câu (2,0đ) 2câu (2,5đ) 6/ Tính theo PTHH 0,5câu (2,0đ) 0,5 câu (1,0đ) 1câu (3,0 đ) Tổng số câu Tỉ lệ: 2câu (1,0đ) = 10% 1 câu (2,0đ) =20% 2 câu (1,0đ) = 10% 1câu (2,0đ) = 20% 2câu (1,0đ) =10% 0,5câu (2,0đ) = 20% 0,5câu (1,0đ) = 10% 9câu (10,0đ) II.ĐỀ: A/TRẮC NGHIỆM: (3Đ) Khoanh tròn vào đáp án đúng trong các câu sau: Câu 1 : Thể tích của 22 gam khí CO2 ở đktc là: A/ 22,4lit B/ 11,2lit C/ 5,6lit D/ 44,8lit Câu 2: Cho sơ đồ phản ứng: Al + HCl ---> AlCl3 + H2 Hệ số cân bằng của PTHH trên lần lượt là: A/ 6:4:2:3 B/ 2:6:2:2 C/ 2:6:2:4 D/ 2:6:2:3 Câu 3: Trong các khí sau : CH4; O2; H2; SO2; CO; NH3. Những khí nặng hơn không khí là: A/ CH4; O2 ;NH3 B/ O2; SO2 C/ H2; NH3 D/ CH4; H2 ;NH3 Câu 4: Thành phần % về khối lượng của nguyên tố Fe có trong FeO là: A/ 76,78% B/ 78,76% C/ 76,79% D/ 77,78% Câu 5: Khối lượng của 0.5 mol BaO là: A/ 76,5 gam. B/ 76,6 gam. B/ 153 gam. D/ 75,5 gam. Câu 6 : Khi nung đá vôi Canxicacbonat thu được 13,2 gam canxi ôxit và 3,6 gam khí cacbonic. Khối lượng Đá vôi đem nung là : A/ 16,7 gam B/ 26,8 gam B/ 9,6 gam D/ 16,8 gam B-TỰ LUẬN (7,0Đ) Câu 1: (2,0đ): Hoàn thành các PTHH sau: a/ ? + Fe ---> FeCl3 b/ P + ? ---> P2O5 c/ NaOH + AlCl3 ---> Al(OH)3 + NaCl d/ Fe2O3 + CO ---> Fe + CO2 Câu 2 :(2,0đ): Một hợp chất khí A có thành phần % về khối lượng các nguyên tố là: %Fe = 36,8%; % S= 21,0% , % O = 42,2 %.Biết hợp chất này có khối lượng mol là 152 gam/mol. Em hãy xác định công thức hóa học của hợp chất. Câu 3 : (3,0đ): Cho 11,2g Fe vào axit clohiđric HCl, sau phản ứng thu được muối sắt II clorua FeCl2 và có khí hiđro H2 thoát ra. a/ Viết PTHH và tính thể tích khí hiđro thoát ra ở đktc? b/ Tính khối lượng axit clohiđric HCl cần dùng? c/ Nếu thay kim loại Fe bằng kim loại Mg và giữ nguyên khối lượng thì sau phản ứng kim loại nào cho nhiều thể tích H2 (ở đktc) hơn? ( Mg=24; Zn=65; H=1; Cl=35,5) III. HƯỚNG DẪN CHẤM - BIỂU ĐIỂM A/ TRẮC NGHIỆM: (3,0đ) ( Mỗi câu trả lời đúng 0,5đ) 1 - B 2- D 3- B 4- D 5- A 6- D B/ TỰ LUẬN: (7,0đ) Câu 1( 2,0đ) Mỗi PTHH cân bằng đúng (0,5đ) (Nếu chọn 2 chất đúng mà không cân bằng được 0, 5đ): (Thiếu điều kiện: -0,25đ) Câu 2 (2,0đ) Lập đúng công thức Câu 3(3,0đ) a/- Đổi ra số mol của Fe= 0,2mol (0,25đ) - Từ PTHH tính được số mol của các chất liên quan (0,5đ) -Viết đúng PTHH (0,5đ) -Tính được thể tích khí H2 = 4,48lit: (0,25đ) b/Tính được khối lượng HCl =14,6g ( 0,5đ) c/ - Viết PTHH (0,25đ) Mg + 2 HCl MgCl2 + H2 - số mol của Mg = 0,47 mol (0,25đ) - Tính được thể tích H2 = 10,528lit (0,25đ) - Kết luận được kim loại Mg cho thể tích Hiđro nhiều hơn.(0,25đ) Nghĩa Trung, ngày 9/12/2015 Tổ trưởng duyệt: Người ra đề: Nguyễn Thị Kim Phụng Nguyễn Công Thương
Tài liệu đính kèm:
 Ma tran de va dap an thi HKI.doc
Ma tran de va dap an thi HKI.doc





