Kiểm tra 1 tiết môn Hóa học 10 cơ bản ( bài số 4)
Bạn đang xem tài liệu "Kiểm tra 1 tiết môn Hóa học 10 cơ bản ( bài số 4)", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
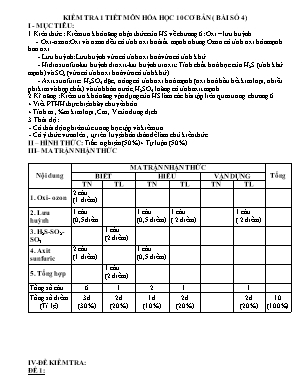
KIỂM TRA 1 TIẾT MÔN HÓA HỌC 10 CƠ BẢN ( BÀI SỐ 4) I - MỤC TIÊU: 1. Kiên thức : Kiểm tra khả năng nhận thức của HS về chương 6: Oxi – lưu huỳnh . - Oxi-ozon: Oxi và ozon đều có tính oxi hoá rất mạnh nhưng Ozon có tính oxi hóa mạnh hơn oxi. - Lưu huỳnh: Lưu huỳnh vừa có tính oxi hoá vừa có tính khử. - Hiđrosunfua-lưu huỳnh đioxit-lưu huỳnh trioxit: Tính chất hoá học của H2S (tính khử mạnh) và SO2 (vừa có tính oxi hoá vừa có tính khử). - Axit sunfuric: H2SO4 đặc, nóng có tính oxi hoá mạnh (oxi hoá hầu hết kim loại, nhiều phi kim và hợp chất) và tính háo nước; H2SO4 loãng có tính axit mạnh. 2. Kĩ năng : Kiểm tra khả năng vận dụng của HS làm các bài tập liên quan trong chương 6. + Viết PTHH thực hiện hãy chuyển hóa. + Tính m , %m kim loại ,Cm , V của dung dịch.. 3. Thái độ : - Có thái độ nghiêm túc trong học tập và kiểm tra. - Có ý thức vươn lên , tự rèn luyện bản thân để làm chủ kiến thức. II – HÌNH THỨC : Trắc nghiệm (50%) + Tự luận (50%) III– MA TRẬN NHẬN THỨC Nội dung MA TRẬN NHẬN THỨC Tổng BIẾT HIÊU VẬN DỤNG TN TL TN TL TN TL 1. Oxi- ozon 2 câu (1 điểm) 2. Lưu huỳnh 1 câu (0,5điểm 1 câu (0,5 điểm) 1 câu ( 2 điểm) 1 câu ( 2 điểm) 3. H2S-SO2- SO3 1 câu (2 điểm) 4. Axit sunfuric 2 câu (1 điểm) 1 câu (0,5 điểm) 5. Tổng hợp 1 câu (2 điểm) Tổng số câu 6 1 2 1 1 Tổng số điểm (Tỉ lệ) 3đ (30%) 2đ (20%) 1đ (10%) 2đ (20%) 2đ (20%) 10 (100%) IV-ĐỀ KIỂM TRA: ĐỀ 1: Phần I: Trắc nghiệm khách quan(0,5đ/1 câu) (Khoanh tròn vào đáp án đúng) Câu 1: Chọn phát biểu đúng về oxi: Nguyên tử oxi dễ nhường 2e Có tính oxi hóa Tác dụng với tất cả kim loại Có tính khử Câu 2: Phản ứng điều chế oxi trong phòng thí nghiệm là: 2KMnO4 → K2MnO4 + MnO2 + O2↑ 2H2O → 2H2 + O2↑ 2KClO3 → 2KCl + 3O2↑ Cả A và C Câu 3: Thể tích khí thoát ra ở đktc khi cho 12g Ozon tác dụng với dung dịch KI dư là: (Cho nguyên tử khối O = 16) A. 3,36 lít B. 4,48 lít. C. 6,72 lít. D. 5,60 lít Câu 4: Trong các hợp chất hoá học, số oxi hoá thường gặp của lưu huỳnh là: A. -2, +4,+6 B. -1,0,+4,+6 C. -2,0,+2,+4,+6 D. -2,0,+4,+6 Câu 5: Chọn ý đúng khi nói về khí hyđro sunfua A. tính axit yếu B. làm mất màu cánh hoa hồng C. tan tốt trong nước D. khử được hyđro Câu 6: Cho phản ứng hóa học: H2S + 4Br2 + 4H2O → H2SO4 + 8HBr Câu nào sau đây diễn tả đúng tính chất các chất trong phản ứng? A. Br2 là chất oxi hóa, H2S là chất khử. B. H2S là chất khử, H2O là chất oxi hóa. C. Br2 là chất oxi hóa, H2O là chất khử D. H2S là chất oxi hóa, Br2 là chất khử Câu 7: Để nhận ra sự có mặt của ion sunfat trong dung dịch, người ta thường dùng A. quỳ tím. B. dung dịch muối Mg2+. C. dung dịch chứa ion Ba2+ D. thuốc thử duy nhất là Ba(OH)2 Câu 8: Kim loại nào sau đây, bị thụ động trong H2SO4 đặc nguội? A. Zn, Al, Cr. B. Fe, Al, Cr. C. Cu, Fe, Ag. D. Zn, Fe, Mg. Câu 9: Cho các phản ứng sau: 1. 2SO2 + O2 ⇋ 2SO3 2.SO2 + 2H2S 3S + 2H2O 3. SO2 + Br2 + 2H2O H2SO4 + 2HBr 4. SO2 +NaOH NaHSO3. Các phản ứng trong đó SO2 có tính khử là A. 1,2,3 B. 2,4 C. 2,3,4 D. 1, 3 Câu 10: Sục từ từ 2,24 lit SO2 (đktc) vào 100 ml dd NaOH 2M. Muối tạo thành sau phản ứng là A. Na2SO4 . B. Na2SO3 C. Na2SO3 và NaHSO3 D. NaHSO3 Phần II: TỰ LUẬN(5 đ) Câu 1:(2đ) Hoàn thành sơ đồ phản ứng: (Ghi rõ đk phản ứng nếu có) S Câu 2:( 1đ) Cân bằng các PTHH sau theo phương pháp thăng bằng electron: Mg + H2SO4 ..... + SO2 +..... Câu 3: ( 2đ) Cho 13,6 gam hỗn hợp gồm Fe và Mg vào dung dịch H2SO4 loãng dư thu được 6,72 lít khí (đktc). Tính % khối lượng mỗi kim loại trong hỗn hợp ban đầu? (Fe=56, Mg=24 , H=1 , O=16) ĐỀ 2: Phần I: Trắc nghiệm khách quan(0,5đ/1 câu) (Khoanh tròn vào đáp án đúng) Câu 1. Chọn phát biểu đúng về tính chất hóa học của oxi: Tác dụng với hầu hết kim loại (trừ Au, Pt) Tác dụng với hầu hết phi kim (trừ halogen) Tác dụng với nhiều hợp chất vô cơ và hữu cơ Tất cả đều đúng Câu 2: Người ta điều chế oxi trong phòng thí nghiệm bằng cách nào sau đây? A. Chưng cất phân đoạn không khí lỏng. B. Điện phân nước. C. Điện phân dung dịch NaOH. D. Nhiệt phân KClO3 với xúc tác Câu 3: Thể tích khí thoát ra ở đktc khi cho 12g Ozon tác dụng với dung dịch KI dư là: (Cho nguyên tử khối O = 16) A. 3,36 lít B. 4,48 lít. C. 6,72 lít. D. 5,60 lít Câu 4: Chỉ ra câu trả lời không đúng về khả năng phản ứng của S: A. S vừa có tính oxi hoá vừa có tính khử. B. Hg phản ứng với S ngay nhiệt độ thường. C. Ở nhiệt độ thích hợp, S tác dụng với hầu hết các phi kim và thể hiện tính oxi hóa. D. Ở nhiệt độ cao, S tác dụng với nhiều kim loại và thể hiện tính oxi hoá. Câu 5: Dung dịch H2S để lâu trong không khí bị vẫn đục màu vàng là do: A. Dung dịch bị nhiễm bẫn. B. H2S kết tinh. C. H2S tác dụng với oxi không khí. D. H2S tác dụng với CO2 trong không khí. Câu 6: Sục từ từ 2,24 lit SO2 (đktc) vào 150 ml dd NaOH 1M. Muối tạo thành sau phản ứng A. Na2SO3 B. NaHSO3 C. Na2SO4 D. Hỗn hợp Na2SO3 và NaHSO3 Câu 7: Trong các phát biểu sau đây, hãy chọn phát biểu không đúng về H2SO4: A. Khi tiếp xúc với H2SO4 đặc dễ gây bỏng nặng. B. Khi pha loãng axit sunfuric, chỉ được cho từ từ nước vào axit. C. H2SO4 đặc là chất hút nước mạnh. D. H2SO4 loãng có đầy đủ tính chất chung của axit Câu 8. Có 3 dung dịch không màu đựng trong 3 lọ hóa chất mất nhãn. NaCl, K2CO3 , BaCl2. Để phân biệt 3 dung dịch trên, dùng thuốc thử là dung dịch A. H2SO4. B. HCl. C. NaOH. D. BaCl2. Câu 9: Trong các phản ứng dưới đây phản ứng nào SO2 thể hiện tính oxi hóa? A. SO2 + 2NaOH → Na2SO3 + H2O B. 2SO2 + O2 → 2SO3 C. SO2 + 2H2S → 3S + 2H2O D. SO2 + NaOH → NaHSO3 Câu 10. Trong các phản ứng sau đây, phản ứng nào thể hiện tính axit của H2S: H2S + 2KOH → K2S + H2O H2S + 2FeCl3 → 2FeCl2 + S↓+ H2O H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl Tất cả đều đúng . Phần II: TỰ LUẬN(5 đ) Câu 1:(2đ) Hoàn thành sơ đồ phản ứng: (Ghi rõ đk phản ứng nếu có) S Câu 2:( 1đ) Cân bằng các PTHH sau theo phương pháp thăng bằng electron: Al + H2SO4 ..... + SO2 +..... Câu 3: ( 2đ) Cho 6,8 gam hỗn hợp X gồm Mg và Fe vào dung dịch axit sunfuric loãng thì thu được 3,36 lit khí bay ra (đktc). Tính % khối lượng mỗi kim loại trong hỗn hợp X? (Fe=56, Mg=24 , H=1 , O=16) V- ĐÁP ÁN VÀ THANG ĐIỂM Đề 1: Phần I: Trắc nghiệm (0,5đ/1 câu) Câu 1 2 3 4 5 6 7 8 9 10 Đáp án A D D A A A C B D B Phần II : Tự luận Câu Nội dung Điểm 1 (Không cân băng PTPU và đkpư trừ 1 nửa số điểm) 1. S + H2 H2S 450-500 0C V2O5 2. 2H2S + 3O2 2SO2 + 2H2O 3. 2SO2 + O2 2SO3 4. H2O + SO3 H2SO4 5. Cu + 2H2SO4(đ)® CuSO4 + SO2 + 2H2O 0,4đ 0,4đ 0,4đ 0,4đ 0,4đ 2 Xác định được SOXH của các nguyên tố , viết QT oxi hóa và quá trình khử. Mg + 2H2SO4 MgSO4 + SO2 + 2H2O 0,5đ 0,5đ 3 Phương trình phản ứng : Fe + H2SO4 FeSO4 + H2 (1) x x (mol) Mg + H2SO4 MgSO4 + H2 (2) y y (mol) Gọi x, y là số mol của Fe và Cu Số mol : Ta có hệ phương trình sau : Vậy phần trăm khối lượng của mỗi kim loại trong hỗn hợp ban đầulà : %Mg = 100 – 82,35= 17,65% 0,5đ 0,5đ 0,25đ 0,25đ 0,5đ Đề 2: Phần I: Trắc nghiệm (0,5đ/1 câu) Câu 1 2 3 4 5 6 7 8 9 10 Đáp án D D D C C D B A C A Phần II : Tự luận Câu Nội dung Điểm 1 (Không cân băng PTPU và đkpư trừ 1 nửa số điểm) 1. S + H2 H2S 450-500 0C V2O5 2. 2H2S + 3O2 2SO2 + 2H2O 3. 2SO2 + O2 2SO3 4. H2O + SO3 H2SO4 5. Cu + 2H2SO4(đ)® CuSO4 + SO2 + 2H2O 0,4đ 0,4đ 0,4đ 0,4đ 0,4đ 2 Xác định được SOXH của các nguyên tố , viết QT oxi hóa và quá trình khử. 2Al + 6H2SO4 Al2(SO4)3 + 3SO2 + 6H2O 0,5đ 0,5đ 3 Phương trình phản ứng : Fe + H2SO4 FeSO4 + H2 (1) x x (mol) Mg + H2SO4 MgSO4 + H2 (2) y y (mol) Gọi x, y là số mol của Fe và Cu Số mol : Ta có hệ phương trình sau : Vậy phần trăm khối lượng của mỗi kim loại trong hỗn hợp ban đầulà : %Mg = 100 – 82,35= 17,65% 0,5đ 0,5đ 0,25đ 0,25đ 0,5đ V.RÚT KINH NGHIỆM
Tài liệu đính kèm:
 DE_KIEM_TRA_HOA_10_BAI_SO_4.doc
DE_KIEM_TRA_HOA_10_BAI_SO_4.doc





