Khởi động với Halogen
Bạn đang xem tài liệu "Khởi động với Halogen", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
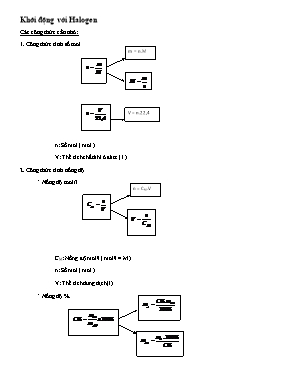
Khởi động với Halogen Các công thức cần nhớ: m = n.M 1. Công thức tính số mol V = n.22,4 n: Số mol ( mol ) V: Thể tích chất khí ở đktc ( l ) 2. Công thức tính nồng độ n = CM.V * Nồng độ mol/l CM: Nồng độ mol/l ( mol/l = M ) n: Số mol ( mol ) V: Thể tích dung dịch (l) * Nồng độ % C%: Nồng độ phần trăm ( % ) mct: Khối lượng chất tan (g) mdd: Khối lượng dung dịch (g) 3. Công thức tính khối lượng riêng m= D.V D: Khối lượng riêng của dung dịch ( g/ml ) m: Khối lượng dung dịch (g) V: Thể tích dung dịch (ml) 4. Công thức tính tỉ khối dA/B: Tỉ khối của khí A so với khí B MA: Khối lượng mol khí A (g/mol) MB: Khối lượng mol khí B (g/mol) 5. PV= nRT * Chú ý: Mkk = 29 Suy ra n= PV/R Dạng 1: Tính theo phương trình hóa học : VD1: Hoà tan hoàn toàn 53,36 gam Fe3O4 bằng dung dịch HCl 0,5M. a) Tính khối lượng muối thu được? b) Tính thể tích dd axit đã dùng? c) Tính nồng độ mol/l của các chất trong dung dịch sau phản ứng (coi thể tích dd thay đổi không đáng kể). Giải : n oxit = 0,23mol VD2: Cho 6,05 g hỗn hợp gồm Zn và Al tác dụng vừa đủ với m gam dd HCl 10% cô cạn dd sau phản ứng thu đ ược 13,15 g muối khan. Tìm giá trị của m. Cách 1: Viết 2 ptpu, đặt nZn=xmol ; nAl = ymol . Suy ra số mol HCl ͢͢ mct HCl ͢mdd HCl. Cách 2: Dùng bảo toàn nguyên tố Khối lượng muối = m KL + mCl ͢ →m Cl →nCl = nHCl . Tính mdd HCl như trên VD3: (ĐH – khối A – 2009). Hòa tan hoàn toàn 14,6 gam hỗn hợp X gồm Al và Sn bằng dung dịch HCl (dư), thu được 5,6 lít khí H2 (ở đktc). Thể tích khí O2 (ở đktc) cần để phản ứng hoàn toàn với 14,6 gam hỗn hợp X là: A. 2,80 lít. B. 1,68 lít. C. 4,48 lít. D. 3,92 lít. Tóm tắt bài toán: .. Cách 1: Viết ptpu, tính số mol Al, Sn. Viết tiếp ptpu Al, Sn với Oxi rồi tính tiếp Dài và mất time. . Cách 2: Nhanh chóng khi dung bảo toàn e. ne H+ nhận= ne O nhận VD4: (ĐH – khối A – 2008). Để hòa tan hoàn toàn 2,32 gam hỗn hợp gồm FeO, Fe3O4 và Fe2O3 (trong đó số mol FeO bằng số mol Fe2O3), cần dùng vừa đủ V lít dung dịch HCl 1M. Giá trị của V là: A. 0,23. B. 0,18. C. 0,08. D. 0,16. Cách 1: Đặt ẩn, viết pt. Bó tay vì có 3 ẩn mà 2 dữ kiện Cách 2: Dùng Chiêu thức với Fe3O4 Lưu ý : Có nhiều chiêu thức giải bài toán vớ Fe, oxit Fe sẽ được học sau. VD5: Bài toán chất dư Cho 1,96 gam bột Fe vào 100 ml dung dịch CuCl2 10% (d=1,12g/ml). a) Viết phương trình phản ứng ? b) Tính nồng độ mol/l của chất trong dung dịch sau phản ứng (coi thể tích dd thay đổi không đáng kể). Giải : GV dạy HS cách xác định chất hết, chất dư và tính mdd sau pư = mban đầu + m chất rắn hòa tan- mket tủa- mkhi bay ra. . Dạng 2: “Truy tìm kim loại “ VD1: Hòa tan hoàn toàn 4,8g một kim loại A thuộc nhóm IIA vào 200g dung dịch HCl 20% thì thu được 4,48 lít khí (đktc). Xác định tên kim loại A. Tính nồng độ % các chất trong dung dịch thu được sau phản ứng. Giải : .................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................... VD2: Cho một lượng đơn chất halogen tác dụng hết với magie thu được 19g magie halogenua. Cũng lượng đơn chất halogen đó tác dụng hết với nhôm tạo ra 17,8g nhôm halogenua. Xác định tên halogen trên. ................................................................................................................................................................................................................................................................................................................................................................. VD3: Cho 6,2g hỗn hợp 2 kim loại A, B thuộc nhóm IA tác dụng hoàn toàn với H2O thu được 2,24 lít (đktc). Xác định A, B. Biết A, B thuộc 2 chu kì liên tiếp. . VD4: Hòa tan hết m gam hh A gồm có Fe và một KL (M) bằng dd HCl thu được 1,008 lit H2 ( đktc ) và dd B. Cô cạn B thu được 4,575g hh muối khan. Tìm giá trị của m. Giải : Không cần biết M là gì vẫn tìm được m. Dùng Chiêu thức 2 dòng.(Hệ quả của bảo toàn nguyên tố) Bài luyện tập: Câu 1: Hòa tan hoàn toàn 2,175g hh gồm 3 kim loại : Zn, Mg , Fe vào dd HCl dư thấy thoát ra 1,344 lit khí H2 ( đktc ). Cô cạn dd thu được sau pư thì được m gam muối khan . Giá trị của m là bao nhêu? .. Câu 2 : (TSĐHCĐB-2008): Cho 9,12 gam hh gồm FeO, Fe2O3, Fe3O4 td với dd HCl dư. Sau phản ứng xảy ra hoàn toàn, được dd Y; cô cạn dd Y thu được 7,62 gam FeCl2 và m gam FeCl3. Giá trị của m là A. 6,5 B. 7,8 C. 9,75 D. 8,75 .. Câu 3: Cho 14,4g hỗn hợp X gồm Cu và CuO tác dụng vừa đủ với 500ml dung dịch HCl 0,4M. Vậy khối lượng của đồng trong hỗn hợp trên là bao nhiêu? .. Câu 4: Hoà tan hoàn toàn 1,36 gam hỗn hợp CaO và CuO vào lượng vừa đủ 400ml dung dịch HCl 0,1M a) viết các phương trình phản ứng xảy ra? b) Tính thành phần % khối lượng mỗi chất trong hỗn hợp? c) Tính khối lượng các muối tạo thành sau phản ứng? .. Câu 5: Hoà tan hoàn toàn 8 gam hỗn hợp Fe và Fe2O3 bằng dung dịch HCl 10% (d=1,1 g/ml) sau phản ứng thu được 2,24 lit H2 (đktc). a) Tính thành phần % khối lượng các chất trong hỗn hợp? b) Tính nồng độ mol/l của các chất trong dung dịch sau phản ứng (coi thể tích dd thay đổi không đáng kể). .. Câu 6: Cho 2,12g muối cacbonat một kim loại hóa trị I tác dụng với dd HCl dư tạo ra 448ml khí (ở đktc). Tìm CT của muối. .. Câu 7: Cho 10,8g một kim loại R ở nhóm IIIA tác dụng hết 500 ml d2 HCl thu được 13,44 lit khí (đktc). a) Xác định tên kim loại R. b) Tìm nồng độ mol/l dung dịch HCl cần dùng. .. Câu 8: Cho 1,365 g một kim loại kiềm X tan hết trong dd HCl thu đ ược dd có khối l ượng lớn hơn dd HCl đã dùng là 1,33 g. Tìm tên X. .. Câu 9. Khi cho m (g) kim loại Canxi tác dụng hoàn toàn với 17,92 lit khí X2 (đktc) thì thu được 88,8g muối halogenua. a. Viết PTPƯ dạng tổng quát. b. Xác định công thức chất khí X2 đã dùng. c. Tính giá trị m. .. Câu 10. Để hoà tan hoàn toàn 8,1g một kim loại thuộc nhóm IIIA cần dùng 450 ml dung dịch HCl 2,0M, thu được dung dịch A và V lit khí H2 (đktc). a. Xác định nguyên tử khối của kim loại trên, cho biết tên của kim loại đó. b. Tính giá trị V. c. Tính nồng độ mol của dung dịch A, xem như thể tích dung dịch thay đổi không đáng kể. .. Câu 11: Hòa tan 4,25 g 1 muối halogen của kim loại kiềm vào dd AgNO3 dư thu đ ược 14,35 g kết tủa. CT của muối là gì? Câu 12: Cho một lượng đơn chất halogen tác dụng hết với magie thu được 19g magie halogenua. Cũng lượng đơn chất halogen đó tác dụng hết với nhôm tạo ra 17,8g nhôm halogenua. Xác định tên halogen trên. .. Câu 13: X là nguyên tố thuộc nhóm halogen. Oxit cao nhất chứa 38,79% X vế khối lượng. Tìm tên X. .. Câu 14: Cho 8g oxit kim loại R ở nhóm IIA tác dụng hoàn toàn với 800 ml dung dịch HCl 0,5M.. a) Xác định tên kim loại R. b) Tính khối lượng muối tạo thành. .. Câu 15: Oxit cao nhất của nguyên tố R có dạng R2O7. Hợp chất khí của nó với Hidro chứa 2,74% hidro về khối lượng. Tìm tên R. Nếu cho 0,25 mol đơn chất của R tác dụng với hidro (vừa đủ) thu được hợp chất khí. Hòa tan khí này vào nước thu được 200 g dung dịch axit. Tính C% của dung dịch axit này. ..
Tài liệu đính kèm:
 Khoi_dong_voi_Halogen.docx
Khoi_dong_voi_Halogen.docx





