Kế hoạch dạy học môn Hóa học Lớp 10,11,12 (Theo CV 4040) - Năm học 2021-2022
Bạn đang xem 20 trang mẫu của tài liệu "Kế hoạch dạy học môn Hóa học Lớp 10,11,12 (Theo CV 4040) - Năm học 2021-2022", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
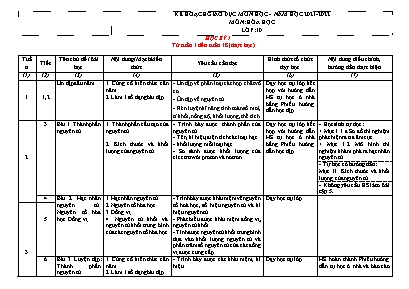
KẾ HOẠCH GIÁO DỤC MÔN HỌC - NĂM HỌC 2021-2022 MÔN: HÓA HỌC LỚP: 10 HỌC KỲ I Từ tuần 1 đến tuần 18 (thực học) Tuần Tiết Tên chủ đề /Bài học Nội dung/Mạch kiến thức Yêu cầu cần đạt Hình thức tổ chức dạy học Nội dung điều chỉnh, hướng dẫn thực hiện (1) (2) (3) (4) (5) (6) (7) 1 1,2 Ôn tập đầu năm 1. Củng cố kiến thức cần năm. 2. Làm 1 số dạng bài tập. - Ôn tập về phân loại các hợp chất vô cơ. - Ôn tập về nguyên tử. - Rèn luyện kĩ năng tính toán số mol, tỉ khối, nồng độ, khối lượng, thể tích. Dạy học tại lớp kết hợp với hướng dẫn HS tự học ở nhà bằng Phiếu hướng dẫn học tập 2 3 Bài 1. Thành phần nguyên tử 1. Thành phần cấu tạo của nguyên tử. 2. Kích thước và khối lượng của nguyên tử - Trình bày được thành phần của nguyên tử. - Tên, kí hiệu, điện tích các loại hạt - khối lượng mỗi loại hạt. - So sánh được khối lượng của electron với proton và nơtron. Dạy học tại lớp kết hợp với hướng dẫn HS tự học ở nhà bằng Phiếu hướng dẫn học tập - Học sinh tự đọc: + Mục I.1.a. Sơ đồ thí nghiệm phát hiện ra tia âm cực + Mục I.2. Mô hình thí nghiệm khám phá ra hạt nhân nguyên tử - Tự học có hướng dẫn: Mục II. Kích thước và khối lượng của nguyên tử. - Không yêu cầu HS làm Bài tập 5. 4 Bài 2. Hạt nhân nguyên tử. Nguyên tố hóa học. Đồng vị 1. Hạt nhân nguyên tử. 2. Nguyên tố hóa học. 3. Đồng vị. 4. Nguyên tử khối và nguyên tử khối trung bình của các nguyên tố hóa học - Trình bày được khái niệm về nguyên tố hoá học, số hiệu nguyên tử và kí hiệu nguyên tử. - Phát biểu được khái niệm đồng vị, nguyên tử khối. - Tính được nguyên tử khối trung bình dựa vào khối lượng nguyên tử và phần trăm số nguyên tử của các đồng vị được cung cấp. Dạy học tại lớp 3 5 6 Bài 3. Luyện tập: Thành phần nguyên tử 1. Củng cố kiến thức cần năm. 2. Làm 1 số dạng bài tập. - Trình bày được các khái niệm, kí hiệu. - Làm được các dạng bài tập về nguyên tử. Dạy học tại lớp HS hoàn thành Phiếu hướng dẫn tự học ở nhà và báo cáo tại lớp kết hợp hoạt động luyện tập 4 7 Chủ đề 1: Cấu trúc lớp vỏ electron nguyên tử - Bài 4. Cấu tạo vỏ nguyên tử - Bài 5. Cấu hình electron nguyên tử - Bài 6. Luyện tập: Cấu tạo vỏ nguyên tử 1. Sự chuyển động của các electron trong nguyên tử. 2. Lớp electron và phân lớp electron. 3. Số electron tối đa trong một phân lớp, một lớp. 4. Thứ tự các mức năng lượng trong nguyên tử. 5. Cấu hình electron nguyên tử. - Trình bày và so sánh được mô hình của Rutherford – Bohr với mô hình hiện đại mô tả sự chuyển động của electron trong nguyên tử. - Trình bày được khái niệm lớp, phân lớp electron và mối quan hệ về số lượng phân lớp trong một lớp. - Viết được cấu hình electron nguyên tử theo lớp, phân lớp electron khi biết số hiệu nguyên tử Z của 20 nguyên tố đầu tiên trong bảng tuần hoàn. - Dựa vào đặc điểm cấu hình electron lớp ngoài cùng của nguyên tử dự đoán được tính chất hoá học cơ bản (kim loại hay phi kim) của nguyên tố tương ứng. Dạy học tại lớp 8 5 9 10 Bài 7. Bảng tuần hoàn các nguyên tố hóa học 1. Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn. 2. Cấu tạo của bảng tuần hoàn các nguyên tố hóa học - Nêu được nguyên tắc sắp xếp của bảng tuần hoàn các nguyên tố hoá học (dựa theo cấu hình electron). - Mô tả được cấu tạo của bảng tuần hoàn các nguyên tố hoá học và nêu được các khái niệm liên quan (ô, chu kì, nhóm). - Phân loại được nguyên tố (dựa theo cấu hình electron: nguyên tố s, p, d, f; dựa theo tính chất hoá học: kim loại, phi kim, khí hiếm). - Xác định được vị trí trong bảng tuần hoàn của nguyên tố (ô, nhóm, chu kì) khi biết cấu hình electron và ngược lại. Dạy học tại lớp với các phương tiện trực quan kết hợp với hướng dẫn HS tự học ở nhà bằng Phiếu hướng dẫn học tập - Tự học có hướng dẫn: + Mục II. 1. Ô nguyên tố + Mục II. 2. Chu kì 6 11 12 Chủ đề 2: Sự biến đổi tuần hoàn cấu hình electron nguyên tử, tính chất của các nguyên tố hóa học. Định luật tuần hoàn 1. Sự biến đổi tuần hoàn cấu hình electron nguyên tử của các nguyên tố hóa học. 2. Cấu hình electron nguyên tử của các nguyên tố nhóm A. 3. Bán kính nguyên tử. 4. Độ âm điện. 5. Tính kim loại, tính phi kim. - Nêu được đặc điểm cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố nhóm A. - Trình bày được nguyên nhân của sự tương tự nhau về tính chất hoá học các nguyên tố trong cùng một nhóm A. - Trình bày được nguyên nhân của sự biến đổi tuần hoàn tính chất của các nguyên tố. - Nhận xét được xu hướng biến đổi bán kính nguyên tử, độ âm điện của nguyên tử các nguyên tố trong một chu kì, trong một nhóm (nhóm A). - Nhận xét và giải thích được xu hướng biến đổi tính kim loại, phi kim của nguyên tử các nguyên tố trong một chu kì, trong một nhóm (nhóm A). Dạy học tại lớp với các phương tiện trực quan kết hợp với hướng dẫn HS tự học ở nhà bằng Phiếu hướng dẫn học tập Bài 8 và bài 9 tích hợp thành một bài. Sự biến đổi tuần hoàn cấu hình electron nguyên tử, tính chất của các nguyên tố hóa học. Định luật tuần hoàn HS tự đọc II.2. Một số nhóm A tiêu biểu 7 13,14 Ôn tập kiểm tra giữa học kì 1 1. Củng cố kiến thức cần năm. 2. Làm 1 số dạng bài tập. - Ôn tập kiến thức về nguyên tử, đồng vị, nguyên tố hóa học và bảng tuần hoàn các nguyên tố hóa học. - Giải được các bài tập liên quan. Dạy học tại lớp kết hợp với hướng dẫn HS tự học ở nhà bằng Phiếu hướng dẫn học tập 8 15 Kiểm tra giữa học kì 1 Trường tổ chức 16 Chủ đề 2(tt): Sự biến đổi tuần hoàn cấu hình electron nguyên tử, tính chất của các nguyên tố hóa học. Định luật tuần hoàn 6. Hóa trị của các nguyên tố. 7. Oxit và hiđroxit của các nguyên tố nhóm A thuộc cùng chu kì. 8. Định luật tuần hoàn. 9. Luyện tập - Nhận xét được xu hướng biến đổi hóa trị của nguyên tử các nguyên tố trong một chu kì, trong một nhóm (nhóm A). - Nhận xét được xu hướng biến đổi thành phần và tính chất axit/bazơ của các oxit và hiđroxit theo chu kì. - Phát biểu được định luật tuần hoàn. Dạy học tại lớp với các phương tiện trực quan kết hợp với hướng dẫn HS tự học ở nhà bằng Phiếu hướng dẫn học tập 17 9 18 Bài 10. Ý nghĩa bảng tuần hoàn các nguyên tố hóa học 1. Quan hệ giữa vị trí của nguyên tố và cấu tạo nguyên tử của nó. 2. Quan hệ giữa vị trí và tính chất của nguyên tố. 3. So sánh tính chất hóa học của một nguyên tố với các nguyên tố lân cận. - Trình bày được mối quan hệ giữa vị trí các nguyên tố trong bảng tuần hoàn với cấu tạo nguyên tử và tính chất cơ bản của nguyên tố và ngược lại. - So sánh được tính kim loại, phi kim của nguyên tố đó với các nguyên tố lân cận. Dạy học tại lớp kết hợp với hướng dẫn HS tự học ở nhà bằng Phiếu hướng dẫn học tập Tự học có hướng dẫn 10 19 Bài 11. Luyện tập: Bảng tuần hoàn, sự biến đổi tuần hoàn cấu hình electron nguyên tử và tính chất của các nguyên tố hóa học 1. Củng cố kiến thức cần năm. 2. Làm 1 số dạng bài tập. - Trình bày được các kiến thức về bảng tuần hoàn. - Làm được các bài tập về xác định nguyên tố, tính khối lượng các chất. Dạy học tại lớp kết hợp với hướng dẫn HS tự học ở nhà bằng Phiếu hướng dẫn học tập 20 Bài 12. Liên kết ion – Tinh thể ion 1. Sự hình thành ion 2. Sự tạo thành liên kết ion. 3. Tinh thể ion - Nêu được định nghĩa liên kết ion và tính chất chung của hợp chất ion. - Viết được cấu hình electron của ion đơn nguyên tử cụ thể. - Xác định được ion đơn nguyên tử, ion đa nguyên tử trong một phân tử chất cụ thể. - Trình bày sự tạo thành liên kết ion trong một số hợp chất như: NaCl, CaCl2, Na2O. - Phân biệt được liên kết ion với các liên kết khác dựa vào bản chất cụ thể. Dạy học tại lớp với các phương tiện trực quan kết hợp với hướng dẫn HS tự học ở nhà bằng Phiếu hướng dẫn học tập - HS sử dụng app AR VR Molecules Editor hoặc chemistry simulator AR quan sát các phân tử NaCl. - III. Tinh thể ion Học sinh tự đọc - Bài tập 2: Không yêu cầu hs làm 11 21 Bài 13. Liên kết cộng hóa trị 1. Sự hình thành liên kết cộng hóa trị. 2. Độ âm điện và liên kết hóa học - Trình bày được khái niệm và lấy được ví dụ về liên kết cộng hoá trị (liên kết đơn, đôi, ba). - Viết được công thức electron và công thức cấu tạo của một số chất đơn giản. - Phân biệt được các loại liên kết (liên kết cộng hoá trị không phân cực, phân cực, liên kết ion) dựa theo độ âm điện. Dạy học tại lớp với các phương tiện trực quan kết hợp với hướng dẫn HS tự học ở nhà bằng Phiếu hướng dẫn học tập - HS sử dụng app AR VR Molecules Editor hoặc chemistry simulator AR quan sát các phân tử HCl, H2, H2O. II. Độ âm điện và liên kết hóa học Tự học có hướng dẫn 22 Bài 14. Tinh thể nguyên tử và tinh thể phân tử Không dạy cả bài 12 23 Bài 16. Luyện tập: Liên kết hóa học 1. Củng cố kiến thức cần năm. 2. Làm 1 số dạng bài tập. - Biết ion đơn, đa nguyên tử, ion dương, âm. - Giải thích được sự tạo thành các chất. - Không yêu cầu hs so sánh tinh thể ion, tinh thể nguyên tử, tinh thể phân tử. - Bài tập 6 Không yêu cầu học sinh làm 24 Bài 15. Hóa trị và số oxi hóa 1. Hóa trị 2. Số oxi hóa - Trình bày được khái niệm điện hoá trị, cộng hóa trị của nguyên tố trong hợp chất. - Nêu được các quy tắc và xác định được số oxi hoá của nguyên tố trong các phân tử đơn chất và hợp chất và ion. Dạy học tại lớp 13 25 Luyện tập: Hóa trị và số oxi hóa 1. Củng cố kiến thức cần năm. 2. Làm 1 số dạng bài tập. 26 Chủ đề: Phản ứng oxi hóa – khử Bài 17. Phản ứng oxi hóa – khử 1. Định nghĩa 2. Lập phương trình hóa học của phản ứng oxi hóa – khử 3. Ý nghĩa của phản ứng oxi hóa – khử trong thực tiễn - Phân biệt được chất oxi hóa và chất khử, sự oxi hoá và sự khử trong phản ứng oxi hoá - khử cụ thể. - Nêu được khái niệm về phản ứng oxi hoá – khử và ý nghĩa của phản ứng oxi hoá – khử. - Cân bằng được phản ứng oxi hoá – khử bằng phương pháp thăng bằng electron. Dạy học tại lớp 14 27 28 Bài 18. Phân loại phản ứng trong hóa học vô cơ 1. Phản ứng có sự thay đổi số oxi hóa và phản ứng không có sự thay đổi số oxi hóa 2. Kết luận Nhận biết được một phản ứng thuộc loại phản ứng oxi hoá - khử dựa vào sự thay đổi số oxi hoá của các nguyên tố. Dạy học tại lớp kết hợp với hướng dẫn HS tự học ở nhà bằng phiếu hướng dẫn học tập Tự học có hướng dẫn cả bài. 15 29 Bài 19. Luyện tập phản ứng oxi hóa – khử 1. Củng cố kiến thức cần năm. 2. Làm 1 số dạng bài tập. - Xác định được chất oxi hóa, chất khử, quá trình oxi hóa, quá trình khử. Cân bằng được phản ứng oxi hóa khử. - Giải bài tập oxi hóa khử (mức dễ) Dạy học tại lớp kết hợp với hướng dẫn HS tự học ở nhà bằng Phiếu hướng dẫn học tập Tích hợp trong chủ đề. 30 Bài 20. Bài thực hành số 1: Phản ứng oxi hóa – khử 1. Làm thí nghiệm 2. Viết tường trình Thực hiện được các thí nghiệm: - Phản ứng giữa kim loại và dung dịch axit - Phản ứng giữa kim loại và dung dịch muối - Phản ứng oxi hóa – khử trong môi trường axit. Làm ở phòng thí nghiệm thực hành Tích hợp trong chủ đề. - Đánh giá thường xuyên lấy điểm thực hành. 16 31,32 Hoạt động trải nghiệm: “Xây dựng bảng tuần hoàn các nguyên tố Hóa học” 1. Lựa chọn giải pháp xây dựng. 2. Tiến hành thực hành. 3. Đánh giá, trình bày sản phẩm. - Học sinh vận dụng được các kiến thức về các qui luật của định luật tuần hoàn. - Sắp xếp các nguyên tố theo chu kì, nhóm. - Trình bày, bảo vệ được quy trình làm sản phẩm của mình, phản biện được các ý kiến thảo luận. - Tự nhận xét, đánh giá được quá trình làm việc cá nhân và nhóm. Dạy học tại lớp và hoàn thiện sản phẩm ở nhà. 17 33 Ôn tập học kì 1 1. Củng cố kiến thức cần năm. 2. Làm 1 số dạng bài tập. - Ôn tập các kiến thức liên quan ở học kì 1. - Giải 1 số bài tập. Dạy học tại lớp kết hợp với hướng dẫn HS tự học ở nhà bằng Phiếu hướng dẫn học tập 34 35 18 36 Kiểm tra học kì 1 Trường tổ chức HỌC KỲ II Từ tuần 19 đến tuần 35 (thực học) Tuần Tiết Tên chủ đề /Bài học Nội dung/Mạch kiến thức Yêu cầu cần đạt Hình thức tổ chức dạy học Nội dung điều chỉnh, hướng dẫn thực hiện (1) (2) (3) (4) (5) (6) (7) 19 37 Chủ đề 2: Nhóm halogen (10 tiết) Bài 21. Khái quát về nhóm halogen Bài 22. Clo Bài 23. Hiđro clorua - Axit clohiđric và muối clorua Bài 24. Sơ lược về hợp chất có oxi của clo Bài 25. Flo – Brom – Iot Bài 26. Luyện tập: Nhóm halogen Bài 27. Bài thực hành số 2: Tính chất hoá học của khí clo và hợp chất của clo Bài 28. Bài thực hành số 3: Tính chất hoá học của brom và iot 1/ Tiết 37: - HĐ trải nghiệm, kết nối - Hình thành kiến thức về: Khái quát nhóm halogen 2/ Tiết 38, 39: Hình thành kiến thức về: - Khái quát nhóm halogen (tt) - Trạng thái tự nhiên đơn chất halogen - Tính chất vật lý, ứng dụng các đơn chất halogen 3/ Tiết 40, 41: Hình thành kiến thức về: - Tính chất hóa học của các đơn chất halogen. - Điều chế các đơn chất halogen. 4/ Tiết 42, 43: Hình thành kiến thức về: Tính chất vật lý, tính chất hóa học của các HX và điều chế HCl. 5/ Tiết 44: Hình thành kiến thức về: - Các muối: clorua, nước Gia-ven, clorua vôi. - Nhận biết ion halogenua 6/ Tiết 45, 46: HĐ luyện tập, tìm tòi mở rộng - Phát biểu được trạng thái tự nhiên của các nguyên tố halogen. - Mô tả được trạng thái, màu sắc, nhiệt độ nóng chảy, nhiệt độ sôi của các đơn chất halogen. - Trình bày được xu hướng nhận thêm 1 electron (từ kim loại) hoặc dùng chung electron (với phi kim) để tạo hợp chất ion hoặc hợp chất cộng hoá trị dựa theo cấu hình electron nguyên tử. - Thực hiện được (hoặc quan sát video) thí nghiệm chứng minh được xu hướng giảm dần tính oxi hoá của các halogen thông qua một số phản ứng: Thay thế halogen trong dung dịch muối bởi một halogen khác; Halogen tác dụng với hiđro và với nước. - Giải thích được xu hướng phản ứng của các đơn chất halogen với hydrogen theo khả năng hoạt động của halogen (điều kiện phản ứng, hiện tượng phản ứng và hỗn hợp chất có trong bình phản ứng). - Thực hiện được (hoặc quan sát video) một số thí nghiệm chứng minh tính oxi hoá mạnh của các halogen và so sánh tính oxi hoá giữa chúng - Trình bày được xu hướng biến đổi tính acid của dãy axit halogen hiđric. - Thực hiện được thí nghiệm phân biệt các ion F‒, Cl‒, Br‒, I‒ bằng cách cho dung dịch AgNO3 vào dung dịch muối của chúng. - Viết được các PTHH minh họa tính chất của các đơn chất và hợp chất. Dạy học tại lớp, phòng thí nghiệm/phòng học bộ môn kết hợp với hướng dẫn HS tự học ở nhà bằng phiếu hướng dẫn học tập - Mục IV. Ứng dụng của clo (Bài 22) Tự học có hướng dẫn 38 - Mục ứng dụng của flo, brom, iot (Bài 25) Khuyến khích học sinh tự đọc 20 39 - Mục sản xuất flo, brom, iot trong công nghiệp (Bài 25) - Tích hợp với phần luyện tập nhóm halogen 40 - Tự học có hướng dẫn: + Cả bài 24. + Không yêu cầu viết các PTHH: NaClO + CO2 + H2O; CaOCl2 + CO2 + H2O 21 41 - Tích hợp khi dạy chủ đề nhóm halogen: + Thí nghiệm 1, 2, 3 (bài 27) + Thí nghiệm 1, 2, 3 (bài 28) 42 Tích hợp: - Clo và hợp chất vào ứng dụng: + Môi trường. + Đời sống. + Cloramin B. 22 43 44 23 45 46 24 47 Bài 29. Oxi - Ozon 1/ Oxi 2/ Ozon - Trình bày được vị trí, cấu hình electron nguyên tử của nguyên tố oxi. - Trình bày được tính chất vật lý, ứng dụng, điều chế oxi, ozon. - Trình bày được tính chất hóa học của oxi, ozon và viết được PTHH minh họa. - Tính % thể tích khí oxi và ozon trong hỗn hợp. Dạy học tại lớp /phòng học bộ môn kết hợp với hướng dẫn HS tự học ở nhà bằng Phiếu hướng dẫn học tập - Tự học có hướng dẫn, lưu ý tập trung vào vai trò và ứng dụng của ozon. 48 Ôn tập kiểm tra giữa học kì 2 1. Củng cố kiến thức cần năm. 2. Làm 1 số dạng bài tập. - Nêu được trạng thái, tính chất vật lí, ứng dụng và điều chế các halogen, oxi, ozo. - Viết được các phương trình phản ứng. - Giải được các bài tập. Dạy học tại lớp kết hợp với hướng dẫn HS tự học ở nhà bằng Phiếu hướng dẫn học tập 25 49 50 Kiểm tra giữa kì 2 Trường tổ chức 26 51 Chủ đề 3: Lưu huỳnh và hợp chất của lưu huỳnh (9 tiết) Bài 30. Lưu huỳnh Bài 31. Bài thực hành số 4: Tính chất của oxi, lưu huỳnh Bài 32. Hiđro sunfua - Lưu huỳnh đioxit - Lưu huỳnh trioxit Bài 33. Axit sunfuric - Muối sunfat Bài 34. Luyện tập: Oxi và lưu huỳnh. Bài 35. Bài thực hành số 5: Tính chất các hợp chất của lưu huỳnh. 1/ Tiết 51: - HĐ trải nghiệm kết nối - HĐ hình thành kiến thức về lưu huỳnh 2/ Tiết 52, 53: Hình thành kiến thức về: - Tính chất vật lý, tính chất hóa học của H2S, SO2, SO3. 3/ Tiết 54, 55: Hình thành kiến thức về tính chất hóa học (tt) và điều chế, ứng dụng của H2S, SO2, SO3. 4/ Tiết 56, 57: Hình thành kiến thức về tính chất hóa học, sản xuất H2SO4, muối sunfat. 5/ Tiết 58, 59: HĐ luyện tập, tìm tòi mở rộng - Nêu được vị trí, cấu hình electron lớp electron ngoài cùng của nguyên tử lưu huỳnh. - Trình bày được tính chất vật lý, trạng thái tự nhiên của lưu huỳnh và các hợp chất của lưu huỳnh. - Trình bày được tính chất hóa học của lưu huỳnh, các hợp chất của lưu huỳnh và viết được PTHH minh họa. - Trình bày được phương pháp điều chế, ứng dụng của lưu huỳnh và các hợp chất của lưu huỳnh. - Dự đoán được tính chất của lưu huỳnh và hợp chất dựa vào sự thay đổi số oxi hóa. - Thực hiện được (hoặc quan sát video) các thí nghiệm, rút ra nhận xét, kết luận về tính chất của lưu huỳnh và hợp chất của lưu huỳnh. - Phân biệt H2S, SO2 với khí khác đã biết. - Tính % thể tích khí H2S, SO2 trong hỗn hợp. - Phân biệt muối sunfat , axit sunfuric với các axit và muối khác (CH3COOH, H2S ...) - Tính khối lượng lưu huỳnh, hợp chất của lưu huỳnh tham gia và tạo thành trong phản ứng. - Tính nồng độ hoặc khối lượng dung dịch H2SO4 tham gia hoặc tạo thành trong phản ứng. Dạy học tại lớp/phòng thí nghiệm/phòng học bộ môn kết hợp với hướng dẫn HS tự học ở nhà bằng Phiếu hướng dẫn học tập - Không dạy: Bài 30: Mục II.2. Ảnh hưởng của nhiệt độ đến tính chất vật lí 52 27 53 - Tự học có hướng dẫn: Bài 30: + Mục II.1. Hai dạng thù hình của lưu huỳnh. + Mục IV. Ứng dụng của lưu huỳnh. + Mục V. Trạng thái tự nhiên và sản xuất lưu huỳnh. 54 - Không làm: + Thí nghiệm 2 (Bài 31) + Thí nghiệm 1, 3 (bài 35) 28 55 - Tích hợp khi dạy chủ đề: Lưu huỳnh và hợp chất của lưu huỳnh: + Thí nghiệm 3, 4 (bài 31) + Thí nghiệm 2, 4 (bài 35) 56 - Tích hợp vào mục sản xuất H2SO4: Mục điều chế SO2 và SO3 (bài 32) 29 57 - Tích hợp khi dạy chủ đề: Lưu huỳnh và hợp chất của lưu huỳnh (ở HĐ luyện tập) Các nội dung luyện tập phần lưu huỳnh và hợp chất của lưu huỳnh (Bài 34) 58 Tích hợp các nội dung: - Tác hại của việc xông hơi lưu huỳnh chống ẩm mốc thực phẩm. - Cách sử dụng lưu huỳnh an toàn. - Bảo vệ môi trường: Tác hại của mưa axit. 30 59 60 Bài 36. Tốc độ phản ứng hóa học 1/ Khái niệm về tốc độ phản ứng hóa học 2/ Các yếu tố ảnh hưởng đến tốc độ phản ứng hóa học - Trình bày được định nghĩa tốc độ phản ứng và nêu thí dụ cụ thể. - Trình bày được các yếu tố ảnh hưởng đến tốc độ phản ứng: nồng độ, áp suất, nhiệt độ, diện tích tiếp xúc, chất xúc tác. - Quan sát thí nghiệm cụ thể, hiện tượng thực tế về tốc độ phản ứng, rút ra được nhận xét. - Vận dụng được các yếu tố ảnh hưởng đến tốc độ phản ứng để làm tăng hoặc giảm tốc độ của một số phản ứng trong thực tế đời sống, sản xuất theo hướng có lợi. Dạy học tại lớp/phòng thí nghiệm/phòng học bộ môn Cả bài 37. Bài thực hành số 6: Tốc độ phản ứng hoá học Tích hợp khi dạy bài 36: Tốc độ phản ứng hoá học 31 61 Tích hợp nội dung: - Cách hầm xương, hầm đậu nhanh mềm, rang các loại đậu cho chín đều. 62, Bài 38. Cân bằng hóa học 1/ Phản ứng một chiều, phản ứng thuận nghịch và cân bằng hóa học 2/ Sự chuyển dịch cân bằng hóa học 3/ Các yếu tố ảnh hưởng đến cân bằng hóa học 4/ Ý nghĩa của tốc độ phản ứng và cân bằng hóa học trong sản xuất hóa học Trình bày được: - Định nghĩa phản ứng thuận nghịch và nêu thí dụ . - Khái niệm về cân bằng hoá học và nêu thí dụ. - Khái niệm về sự chuyển dịch cân bằng hoá học và nêu thí dụ. - Nội dung nguyên lí Lơ Sa- tơ- liê và cụ thể hoá trong mỗi trường hợp cụ thể. - Quan sát thí nghiệm rút ra được nhận xét về phản ứng thuận nghịch và cân bằng hoá học. - Dự đoán được chiều chuyển dịch cân bằng hoá học trong những điều kiện cụ thể. - Vận dụng được các yếu tố ảnh hưởng đến cân bằng hoá học để đề xuất cách tăng hiệu suất phản ứng trong trường hợp cụ thể. Dạy học tại lớp/phòng thí nghiệm/phòng học bộ môn 32 63 64 Bài 39. Luyện tập: Tốc độ phản ứng và cân bằng hóa học 1. Củng cố kiến thức cần năm. 2. Làm 1 số dạng bài tập. - Trình bày được định nghĩa về tốc độ phản ứng, cân bằng hóa học. Các yếu tố ảnh hưởng. - Giải thích chiều phản ứng khi thay đồi các điều kiện. - Giải thích các hiện tượng trong thực tế. Dạy học tại lớp kết hợp với hướng dẫn HS tự học ở nhà bằng Phiếu hướng dẫn học tập. 33 65 Hoạt động trải nghiệm STEM: “Oxi quanh ta.” - Quá trình tạo oxi của cây Rong đuôi chó; - Thiết kế mô hình máy tạo oxi cho hồ cá; 1. Lựa chọn trải nghiệm cho phù hợp với học sinh. 2. Tiến hành thực hành. 3. Đánh giá, trình bày sản phẩm. - Học sinh vận dụng được các kiến thức về Tính chất vật lí, tính chất hóa học và ứng ụng của oxi. - Xây dựng mô hình theo kế hoạch. - Trình bày, bảo vệ được quy trình làm sản phẩm của mình, phản biện được các ý kiến thảo luận. - Tự nhận xét, đánh giá được quá trình làm việc cá nhân và nhóm. Hướng dẫn trên lớp và hoàn thành sản phẩm ở nhà. 66 Hoạt động trải nghiệm: “Tạo núi lửa” 1. Lựa chọn trải nghiệm cho phù hợp với học sinh. 2. Tiến hành thực hành. 3. Đánh giá, trình bày sản phẩm. - Thí nghiệm chứng minh các yếu tố ảnh hưởng đến tốc độ phản ứng. Thực hiện tại phòng thí nghiệm. 34 67 Ôn tập cuối học kì 2 1. Củng cố kiến thức cần năm. 2. Làm 1 số dạng bài tập. - Ôn tập các kiến thức liên quan ở học kì 1. - Giải 1 số bài tập. Dạy học tại lớp kết hợp với hướng dẫn HS tự học ở nhà bằng Phiếu hướng dẫn học tập. 68 35 69 70 Kiểm tra học kì 2 Trường tổ chức KẾ HOẠCH GIÁO DỤC MÔN HÓA HỌC LỚP 11, CHƯƠNG TRÌNH CHUẨN -NĂM HỌC 2021-2022 HỌC KỲ I – LỚP 11 Tuần Tiết Tên chủ đề /Bài học Nội dung/Mạch kiến thức Yêu cầu cần đạt Hình thức tổ chức dạy học Nội dung điều chỉnh, hướng dẫn thực hiện 1 2 3 4 5 6 7 1 1 Ôn tập đầu năm 1. Củng cố kiến thức cần nắm 2. Một số dạng bài tập - Ôn tập, củng cố, về ion, điện tích ion, axit, bazơ, muối đã học. - Rèn luyện kĩ năng tính toán số mol, nồng độ, khối lượng, thể tích. - Biết cách hoạt động nhóm hiệu quả, vẽ sơ đồ tư duy Dạy học tại lớp. 1. Hướng dẫn HS cách hoạt động nhóm, cách sử dụng tiêu chí đánh giá, nội quy môn học 2. Hướng dẫn phương pháp học tập lớp học đảo ngược Chương 1: Sự điện li (8 tiết: 7 tiết lí thuyết+1 tiết trải nghiệm) 2 Bài 1. Sự điện li Hiện tượng điện li - Thực hành( quan sát) thí nghiệm, rút ra được kết luận về tính dẫn điện của dung dịch chất điện li, chất dẫn điện mạnh, chất dẫn điện yếu. -Nêu được khái niệm về sự điện li, chất điện li, chất điện li mạnh, chất điện li yếu - Phân biệt được chất điện li, chất không điện li, chất điện li mạnh, chất điện li yếu. - Viết được phương trình điện li. Dạy học tại lớp/ phòng thí nghiệm kết hợp với việc giao nhiệm vụ cho HS làm ở nhà qua phiếu hướng dẫn học tập. Lồng ghép thí nghiệm trong dạy bài mới( GV biểu diễn, HS thực hành hoặc chiếu video) Tự học có hướng dẫn Mục 2. Phân loại các chất điện li 2 3 Bài 2. Axit, bazơ và muối 1. Axit 2. Bazơ 3. Hiđroxit lưỡng tính 4. Muối - Vấn đề thực tế “Các axit, bazơ, muối thường gặp trong đời sống. -Nhận biết được một chất cụ thể là axit, bazơ muối, hiđroxit lưỡng tính, muối trung hoà, muối axit theo định nghĩa (thuyết A-rê-ni-ut). - Viết được phương trình điện li của các axit, bazơ, muối, hiđroxit lưỡng tính cụ thể. - Tính được nồng độ mol ion trong dung dịch chất điện li mạnh. Dạy học tại lớp kết hợp với việc giao nhiệm vụ cho HS làm ở nhà qua phiếu hướng dẫn học tập. Không dạy - Mục III. Hidroxit lưỡng tính (Sn(OH)2, Pb(OH)2) - Bài tập 2, phần d * GV tích hợp trong tiết dạy với vấn đề thực tế các axit, bazo, muối thường gặp tròn đời sống như muối ăn, vôi, giấm, chanh. 4 3 5 Bài 3. Sự điện li của nước. pH. Chất chỉ thị axit - bazơ 1. Nước là chất điện li rất yếu 2. Khái niệm về pH. Chất chỉ thị axit – bazơ -Vấn đề thực tế: pH trong các bộ phận cơ thể người, trong đất và các chất thường gặp trong đời sống. - Nêu được tích số ion của nước và ý nghĩa của nó. - Nêu được khái niệm về pH, định nghĩa môi trường axit, môi trường trung tính và môi trường kiềm. - Tính được pH của dung dịch axit mạnh, bazơ mạnh. - Xác định được môi trường của dung dịch thường gặp bằng cách sử dụng giấy chỉ thị vạn năng, giấy quỳ tím hoặc dung dịch phenolphtalein. . Dạy học tại lớp/phòng thí nghiệm kết hợp với việc giao nhiệm vụ cho HS làm ở nhà qua phiếu hướng dẫn học tập. Lồng ghép thí nghiệm trong dạy bài mới( GV biễu diễn, HS thực hành hoặc chiếu video) Tự học có hướng dẫn (HS hoàn thành Phiếu hướng dẫn tự học ở nhà và báo cáo tại lớp) Mục II. 2. Chất chỉ thị axit - bazơ Vấn đề thực tế: pH trong các bộ phận cơ thể người, trong đất và các chất thường gặp trong đời sống. Hoạt động thực hành tại nhà: hoặc phòng thí nghiệm xác định môi trường của dung dịch thường gặp như nước muối, xà phòng, nước cm bằng chất chỉ thị màu. 6 Bài 4. Phản ứng trao đổi ion trong dung dịch các chất điện li 1.Điều kiện xảy ra phản ứng trao đổi ion trong dung dịch các chất điện li 2. Kết luận - Thực hành thí nghiệm để biết có phản ứng hóa học xảy ra và điều kiện xảy ra . -Nêu được điều kiện xảy ra và bản chất của phản ứng trao đổi ion trong dung dịch các chất điện li. - Dự đoán được kết quả phản ứng trao đổi ion trong dung dịch các chất điện li. - Viết được phương trình ion đầy đủ và rút gọn. - Tính khối được lượng kết tủa hoặc thể tích khí sau phản ứng tính nồng độ mol ion thu được sau phản ứng Dạy học tại lớp/phòng thí nghiệm kết hợp với việc giao nhiệm vụ cho HS làm ở nhà qua phiếu hướng dẫn học tập. Lồng ghép thí nghiệm trong dạy bài mới( GV biễu diễn, HS thực hành hoặc chiếu video) 4 7 Luyện tập Dạy học tại lớp 8 Chương 2: NITƠ-PHOTPHO 5 9 Bài 7:Niơ 1. Vị trí và cấu hình electron nguyên tử 2. Tính chất vật lý, ứng dụng 3. Tính chất hóa học 4. Trạng thái tự nhiên, điều chế - Trình bày được vị trí trong BTH và cấu hình electron nguyên tử của nguyên tố nitơ. - Phát biểu được tính chất vật lý, ứng dụng và trạng thái tự nhiên của nitơ. - Giải thích được tính trơ của đơn chất nitơ ở nhiệt độ thường thông qua liên kết. - Trình bày được sự hoạt động của đơn chất nitơ ở nhiệt độ cao đối với kim loại, hiđro, oxi. - Tính được thể tích khí nitơ ở đktc trong phản ứng hoá học; Dạy học tại lớp kết hợp với hướng dẫn HS tự học ở nhà bằng Phiếu hướng dẫn học tập Tự học có hướng dẫn (HS hoàn thành Phiếu hướng dẫn tự học ở nhà và báo cáo tại lớp) Mục II. Tính chất vật lí Mục V. Trạng thái tự nhiên Mục VI.1. Trong công nghiệp Không dạy Mục VI.2. Trong phòng thí nghiệm Có thể cho HS tìm hiểu bài thơ “Cô gái Nitơ” , hoặc sáng tác thơ, nhạc liên quan đến tính chất nitơ và báo cáo trước lớp. 10 Bài 8. Amoniac và muối amoni 1. Amoniac - Cấu tạo phân tử - Tính chất vật lý, ứng dụng, điều chế - Tính chất hóa học 2. Muối amoni - Tính chất vật lý - Tính chất hóa học - Trình bày được cấu tạo phân tử, tính chất vật lí (tính tan, tỉ khối, màu, mùi), ứng dụng chính, cách điều chế amoniac trong phòng thí nghiệm và trong công nghiệp của amoniac. - Trình bày được tính chất hóa học của amoniac và viết được phương trình hoá học minh hoạ. - Trình bày được tính chất cơ bản của muối amoni (dễ tan và phân li, chuyển hoá thành amoniac trong kiềm, dễ bị nhiệt phân) và nhận biết được ion amoni trong dung dịch. - Thực hiện được (hoặc quan sát video) thí nghiệm nhận biết được ion amoni. - Tính thể tích khí amoniac sản xuất được ở đktc theo hiệu suất phản ứng Dạy học tại lớp/ phòng thí nghiệm. Lồng ghép thí nghiệm trong dạy bài mới( GV biễu diễn, HS thực hành hoặc chiếu video) Không dạy Hình 2.2. Sơ đồ cấu tạo của phân tử NH3 Mục III.2.b. Tác dụng với clo Thay bằng PTHH: 4NH3 + 5O2 → (dòng 1↑ trang 41) Tích hợp -Ứng dụng muối amoni làm sạch bề mặt kim loại trước khi hàn. Xử lý sự cố rò rỉ khí NH3. 6 11 12 Bài 9. Axit nitric và muối nitrat 1. Axit nitric - Cấu tạo phân tử - Tính chất vật lý, ứng dụng - Tính chất hóa học - Điều chế 2. Muối nitrat - Tính chất - Ứng dụng 3. Chu trình của nitơ trong tự nhiên - Trình bày được cấu tạo phân tử, tính chất vật lí (tính tan, tỉ khối, màu, mùi), ứng dụng chính, cách điều chế amoniac trong phòng thí nghiệm và trong công nghiệp của amoniac. - Trình bày được tính chất hóa học của amoniac và viết được phương trình hoá học minh hoạ. - Trình bày được tính chất cơ bản của muối amoni (dễ tan và phân li, chuyển hoá thành amoniac trong kiềm, dễ bị nhiệt phân) và nhận biết được ion amoni trong dung dịch. - Thực hiện được (hoặc quan sát video) thí nghiệm nhận biết được ion amoni. - Tính thể tích khí amoniac sản xuất được ở đktc theo hiệu suất phản ứng. Dạy học tại lớp/ Dạy học tại lớp (sử dụng các phương tiện trực quan). Lồng ghép thí nghiệm trong dạy bài mới( GV biễu diễn, HS thực hành hoặc chiếu video) Thí nghiệm 1_Bài 14: Tính oxi hóa của axit nitric Tích hợp khi dạy về tính chất hóa học của HNO3 Thí nghiệm 2_Bài 14: Tính oxi hóa của muối kali nitrat nóng chảy Tích hợp khi dạy về muối nitrat Không dạy Mục B.I.3. Nhận biết ion nitrat Khuyến khích học sinh tự đọc Mục C. Chu trình của nitơ trong tự nhiên Tích hợp - Tác hại việc tẩm ướp thịt, cá bằng muối NaNO3 -Tác hại khí cười N2O, NO, NO2. 7 13 14 Ôn tập kiểm tra giữa học kì 1 Dạy học tại lớp kết hợp với hướng dẫn HS tự học ở nhà bằng Phiếu hướng dẫn học tập 8 15 Ôn tập kiểm tra giữa học kì 1 Dạy học tại lớp kết hợp với hướng dẫn HS tự học ở nhà bằng Phiếu hướng dẫn học tập 16 Kiểm tra giữa học kì 1 Nội dung kiểm tra theo bảng đặc tả và ma trận Lưu ý : Không kiểm tra các phần hướng dẫn tự học, tự đọc, tự làm, tự thực hiện, không yêu cầu, những nội dung yêu cầu học sinh thực hành, thí nghiệm. Không đưa các bài tập nặng về tính toán, ít bản chất hóa học. Trải nghiệm chất chỉ thị màu thiên nhiên -Tìm được các loại thực vật tại địa phương có thể điều chế -Điều chế được chất chỉ thị màu thiên nhiên -Thử nghiệm sự thay đổi màu sắc chỉ thị tự nhiên ở các môi
Tài liệu đính kèm:
 ke_hoach_day_hoc_mon_hoa_hoc_lop_101112_theo_cv_4040_nam_hoc.docx
ke_hoach_day_hoc_mon_hoa_hoc_lop_101112_theo_cv_4040_nam_hoc.docx





