Giáo án Hóa 10 - Tên bài thực hành: Tính chất hoá học của brom và iot
Bạn đang xem tài liệu "Giáo án Hóa 10 - Tên bài thực hành: Tính chất hoá học của brom và iot", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
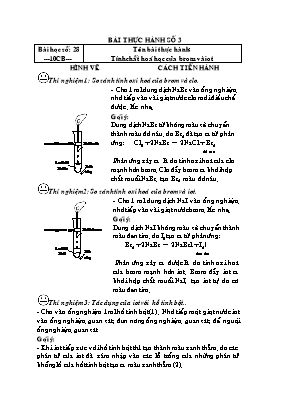
BÀI THỰC HÀNH SỐ 3 Bài học số: 28 ---10CB--- Tên bài thực hành: Tính chất hoá học của brom và iot HÌNH VẼ CÁCH TIẾN HÀNH Thí nghiệm 1: So sánh tính oxi hoá của brom và clo. - Cho 1 ml dung dịch NaBr vào ống nghiệm, nhỏ tiếp vào vài giọt nước clo mới điều chế được , lắc nhẹ. Gợi ý: Dung dịch NaBr từ không màu sẽ chuyển thành màu đỏ nâu, do Br2 đã tạo ra từ phản ứng: Cl2 + 2NaBr " 2NaCl + Br2 đỏ nâu Phản ứng xảy ra là do tính oxi hoá của clo mạnh hơn brom. Clo đẩy brom ra khỏi hợp chất muối NaBr, tạo Br2 màu đỏ nâu. Thí nghiệm2: So sánh tính oxi hoá của brom và iot. - Cho 1 ml dung dịch NaI vào ống nghiệm, nhỏ tiếp vào vài giọt nước brom, lắc nhẹ. Gợi ý: Dung dịch NaI không màu sẽ chuyển thành màu đen tím, do I2 tạo ra từ phản ứng: Br2 + 2NaBr " 2NaBrl + I2$ đen tím Phản ứng xảy ra được là do tính oxi hoá của brom mạnh hơn iot. Brom đẩy iot ra khỏi hợp chất muối NaI, tạo iot tự do có màu đen tím. Thí nghiệm 3: Tác dụng của iot với hồ tinh bột.. - Cho vào ống nghiệm 1ml hồ tinh bột(1) . Nhỏ tiếp một giọt nước iot vào ống nghiệm, quan sát; đun nóng ống nghiệm, quan sát; để nguội ống nghiệm, quan sát Gợi ý: - Khi iot tiếp xúc với hồ tinh bột thì tạo thành màu xanh thẫm, do các phân tử của iot đã xâm nhập vào các lỗ trống của những phân tử khổng lồ của hồt tinh bột tạo ra màu xanh thẫm (2). Giữa iot và hồ tinh bột không có phản ứng hoá học xảy ra. Khi bị đun nóng các phân tử iot chuyển thành hơi bay lên, nên mất màu xanh (3), để nguội các phân tử I2 ngưng tụ lại bám vào hồ tinh bột, nên xuất hiện lại màu xanh đen (4).
Tài liệu đính kèm:
 thuc_hanh_hoa_10.doc
thuc_hanh_hoa_10.doc





