Đề thi học kì II môn: Hóa học 10 cơ bản
Bạn đang xem tài liệu "Đề thi học kì II môn: Hóa học 10 cơ bản", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
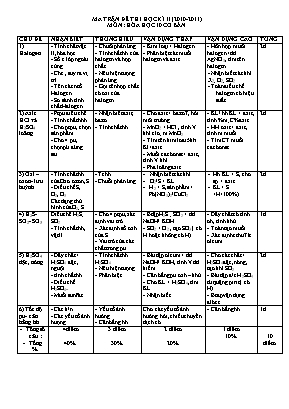
MA TRẬN ĐỀ THI HỌC KÌ II (2010-2011) MÔN : HÓA HỌC 10 CƠ BẢN CHỦ ĐỀ NHẬN BIẾT THÔNG HIỂU VẬN DỤNG THẤP VẬN DỤNG CAO TỔNG 1) Halogen - Tính chất vật lí, hóa học - Số e lớp ngoài cùng - Che , suy ra vị trí - Tên các ntố Halogen - So sánh tính chất Halogen - Chuỗi phản ứng - Tính chất hh của halogen và hợp chất - Nêu hiện tượng phản ứng - Gọi tên hợp chất có oxi của halogen - Kim loại + Halogen - Phân biệt các muối halogen và axit - Hỗn hợp muối halogen+dd AgNO3, tìm tên halogen - Nhận biết các khí X2; O2; SO2... - Toán điều chế halogen có hiệu suất 2đ 2) Axit HCl và H2SO4 loãng - Ptpu điều chế - Tính chất hhh - Cho ptpu, chọn sản phẩm - Cho 4 pư, chọn pứ đúng sai - Nhận biết axit, bazơ - Tính chất hh - Cho axit + bazo7 , hỏi môi trường - MnO2 + HCl , tính V khí clo; m MnO2 - Tìm tên kim loai5khi Kl+axit - Muối cacbonat + axit , tính V khí - Pha loãng axit - KL/ hh KL + axit , tính %m; C%axit... - HH oxit + axit , tính m muối - Tìm CT muối cacbonat 2đ 3) Oxi – ozon- lưu huỳnh - Tính chất hh của Oxo ozon, S - Điều chế S, O2, O3 Các dạng thù hình của O2; S Tchh Chuỗi phản ứng Nhận biết các khí.. O2/S + KL H2 + S,sản phẩm + Pb(NO3)2/CuCl2 Hh KL + S, cho sp + axit KL+ S <H<100%) 2đ 4) H2S- SO2- SO3 Điều chế H2S; SO2 - Tính chất hh, vật lí - Cho 4 ptpu, xác định vai trò - Xác định số oxh của S - Vai trò của các chất trong pu - Btập H2S ; SO2 + dd NaOH/ KOH - SO2 + O2 , tạo SO3 ( có H hoặc không có H) - Dãy chất có tính oh, tính khử - Toán tạo muối - Xác định cthu71c oleum 1đ 5) H2SO4 đặc, nóng - Dãy chất + H2SO4 đặc, nguội - tính chất hh - Điều chế H2SO4= - Muối sunfat - Tính chất hh H2SO4 - Nêu hiện tượng - Phân biệt - Bài tập oleum + dd NaOH/ KOH, tính V dd kiềm - Cân bằng pu oxh – khử - Cho KL + H2SO4, tìm KL - Nhận biết - Cho các chất + H2SO4đặc, nóng, tạo khí SO2 - Bài tập đ/c H2SO4 từ quặng pirit ( có H) - Btap vận dụng đlbt e 2đ 6) Tốc độ pu- cân bằng hh - Các k/n - Các yếu tố ảnh hượng - Yếu tố ảnh hưởng - Cân bằng hh Cho các yếu tố ảnh hưởng hỏi, chiều chuyển dịch cb - Cân bằng hh 1đ Tổng số câu : Tồng % 4điểm 40% 3 điểm 30% 2 điểm 20% 1 điểm 10% 10 điểm Sở Giáo Dục và Đào Tạo Đăklăk ĐỀ KIỂM TRA HỌC KÌ II NĂM HỌC 2014-2015 Trường PTTH Quang Trung Môn: Hóa Học Khối 10 ------***------ Thời gian 45 phút (Đề có 02 trang) Họ và Tên: Lớp: . Điểm Chữ kí GT: ( Học làm trực tiếp vào đề và không được sử dụng bảng hệ thống tuần hoàn) (0,5đ) Viết cấu hình electron của nguyên tử sau: S (Z=16) : .; b. F (Z=9): . (0,5đ) Nhóm VIIA có những nguyên tố hoá học nào? Viết kí hiệu hoá học các nguyên tố đó. (2đ) Hoàn thành các phương trình hoá học sau: a. Fe + Cl2 → b. HCl + KMnO4 → c. Cu + H2SO4 đặc, nóng→ d. Fe + H2SO4 đặc, nóng → (1đ) Viết phương trình hoá học của các thí nghiệm sau. Đốt nóng đỏ dây đồng rồi đưa vào bình tam giác chứa khí clo ( đáy bình có lớp cát) .. Nhỏ dung dịch H2SO4 loãng vào ống nghiệm chứa một ít bột CuO (màu đen), đun nhẹ. .. (1đ) Nối hiện tượng mô tả ở cột B với thí nghiệm ở cột A sao cho phù hợp A. Thí nghiệm B. Hiện tượng Nhỏ dung dịch Na2S vào dd Pb(NO3)2 1. Mất màu dần Nhỏ dung dịch BaCl2 vào dd Na2SO4 2. Xuất hiện kết tủa trắng Cho mẩu giấy màu vào cốc nước clo 3. Xuất hiện kết tủa đen Nhỏ H2 SO4 đặc vào cốc nước cất 4. Xuất hiện kết tủa, sau đó tan dần. 5. Nước nóng dần. (0,75đ)Oxi có vai trò quyết định đối với sự sống của con người và động vật. Mỗi người mỗi ngày cần từ 20-30m3 không khí để thở. Hàng năm, trên thế giới sản xuất hàng chục triệu tấn oxi để đáp ứng nhu cầu đời sống và sản xuất. Trong đó: 55% được dùng trong ; 25% dùng trong .; 10% dùng trong ; 10% còn lại dùng trong hàn cắt kim loại, thuốc nổ nhiên liệu tên lửa Chọn các lĩnh vực: Công nghiệp hoá chất; luyện thép; Y khoa, điền vào các chỗ trống trên cho phù hợp. (0,25đ) Trong tự nhiên, cây xanh được coi là nhà máy sản xuất cacbohiđrat và oxi từ cacbon đioxit và nước dưới tác dụng của ánh sáng mặt trời. Nhờ quá trình trên mà lượng oxi trong không khí hầu như không đổi. Quá trình trên được gọi là quá trình . (0,25đ) Hoà tan hoàn toàn 13,7g hỗn hợp Mg, Zn bằng dd H2 SO4 đặc, nóng thu được V lít SO2 (đktc, sản phẩm khử duy nhất) và dd X. Cô cạn dd X được 52,1 gam muối sunfat trung hoà. Giá trị của V là : ....................... (0,25đ) Hấp thụ hoàn toàn 0,2 mol khí SO2 vào dung dịch chứa 0,5mol NaOH, sau phản ứng thu được dung dịch X. Dung dịch X chứa chất tan nào ? số mol bằng bao nhiêu ? Trả lời: (0,25đ)Hòa tan hết 1,69 gam Oleum có công thức H2SO4.3SO3 vào nước dư. Trung hòa dung dịch thu được cần V ml dung dịch KOH 1M. Giá trị của V là:........................ (0,75đ) Trong các phát biểu sau, phát biểu nào đúng (điền chữ Đ)? phát biểu nào sai (điền chữ S)? .. Khí SO2 được dùng để tẩy trắng giấy, bột giấy, chống nấm mốc cho lượng thực, thực phẩm, khử trùng nước sinh hoạt. ..Cho phản ứng 2KClO3(r) → 2KCl(r) + 3O2(k). Nhiệt độ không ảnh hưởng đến tốc độ phản ứng này. ..Cho cân bằng: 2SO2 (k) + O2 (k) 2SO3 (k). Khi tăng nhiệt độ thì tỉ khối của hỗn hợp khí so với H2 giảm đi, chứng tỏ phản ứng thuận toả nhiệt và cân bằng dịch chuyển theo chiều nghịch khi tăng nhiệt độ. (1đ) Hãy ghép cặp chất và tính chất sao cho phù hợp Chất Tính chất của chất S a. có tính oxi hoá SO2 b. có tính khử H2S c. chất rắn có tính oxi hoá và tính khử H2SO4 d. không có tính oxi hoá và tính khử e. chất khí có tính oxi hoá và tính khử (0,5đ) Cho phương trình phản ứng sau: 5SO2 + 2KMnO4 + 2H2O → 2MnSO4 + K2SO4 + 2H2SO4 Trong phản ứng trên, SO2 đóng vai trò là chất ; KMnO4 đóng vai trò là chất .. dd H 2SO4 đặc Na2SO3 tt dd Br2 Lắp dụng cụ thí nghiệm như hình vẽ bên (0,25đ) Lắp dụng cụ thí nghiệm và hoá chất như hình vẽ bên đã hợp lí chưa? Nếu chưa, thì cần chỉnh sửa và bổ sung như thế nào? (0,25đ) Viết phương trình hoá học xảy ra trong bình cầu .. .. (0,25đ) Viết phương trình hoá học và mô tả hiện xảy ra trong bình tam giác. ... (0,25đ) Bộ dụng cụ trên còn dùng để điều chế những chất nào trong các chất sau: H2S, Cl2, HCl, O3, F2. (khoanh tròn vào các chất được chọn)
Tài liệu đính kèm:
 HK_2_lop_10_cb.doc
HK_2_lop_10_cb.doc





