Đề thi học ki II môn Hóa học 9
Bạn đang xem tài liệu "Đề thi học ki II môn Hóa học 9", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
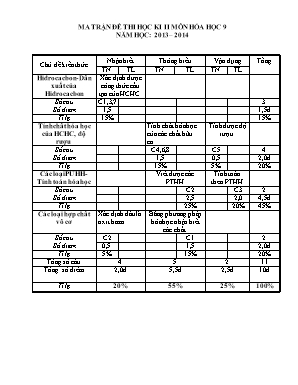
MA TRẬN ĐỀ THI HỌC KI II MÔN HÓA HỌC 9 NĂM HỌC: 2013 – 2014 Chủ đề kiến thức Nhận biết Thông hiểu Vận dụng Tổng TN TL TN TL TN TL Hiđrocacbon- Dẫn xuất của Hiđrocacbon Xác định được công thức cấu tạo của HCHC. Số câu Số điểm C1,3,7 3 1,5 1,5đ Tỉ lệ 15% 15% Tính chất hóa học của HCHC, độ rượu Tính chất hóa học của các chất hữu cơ. Tính được độ rượu Số câu Số điểm C4,6,8 C5 4 1,5 0,5 2,0đ Tỉ lệ 15% 5% 20% Các loại PƯHH-Tính toán hóa học Viết được các PTHH Tính toán theo PTHH Số câu Số điểm C2 C3 2 2,5 2,0 4,5đ Tỉ lệ 25% 20% 45% Các loại hợp chất vô cơ Xác định đâu là oxit bazơ. Bằng phương pháp hóa học nhận biết các chất. Số câu Số điểm C2 C1 2 0,5 1,5 2,0đ Tỉ lệ 5% 15% 20% Tổng số câu 4 5 2 11 Tổng số điểm 2,0đ 5,5đ 2,5đ 10đ Tỉ lệ 20% 55% 25% 100% PHÒNG GD&ĐT TÂY TRÀ Đề chính thức TRƯỜNG TH&THCS SỐ 2 TRÀ PHONG ĐỀ THI HỌC KÌ II NĂM HỌC 2013-2014 MÔN: HÓA HỌC 9 Thời gian: 45 phút (không kể thời gian phát đề) (Đề thi gồm có 01 trang) I /TRẮC NGHIỆM KHÁCH QUAN(4,0 điểm) Lựa chọn đáp án đúng nhất bằng cách khoanh tròn vào một trong các chữ A, B, C hoặc D trong các câu sau: Câu 1: Hãy chỉ ra công thức nào viết đúng của Ben zen? A. B. C. D. Câu 2: Dãy oxit nào sau đây gồm toàn oxit bazơ CuO , BaO, MgO, K2O , CaO. C. CuO , BaO, CO2, P2O5, K2O. N2O5 , CO2 , K2O , CaO, MgO. D. CO2, BaO, N2O5 , P2O5 , MgO . Câu 3: Công thức cấu tạo của axit axetic là: A. C2H6O B. CH3–COOH C. C4H10 D. CH3–O–CH3 Câu 4: Trong các chất sau chất nào tác dụng với Natri: A. CH3–CH3 B. CH3–CH2–OH C. C6H6 D. CH3–O–CH3. Câu 5: Trong 200 ml dung dịch rượu 450 chứa số ml rượu etylic nguyên chất là: A. 100ml B. 150ml C. 90ml D. 200ml Câu 6: Axit axetic không phản ứng được với: A. NaOH B. Na2CO3 C. Na D. CH3COOC2H5 Câu 7: Các chất nào sau đây là hợp chất hữu cơ: A. CH4, C2H4Br2, CaCO3 B. C2H5ONa, NaCl, CH3COONa C. C2H4Br2, CO2 , H2O D. CH4, C2H4, C6H12O6 Câu 8: Phản ứng đặc trưng của liên kết đôi là gì? A. phản ứng oxi hóa khử B. phản ứng cháy C. phản ứng cộng D. phản ứng thế II/ TỰ LUẬN (6,0 điểm) Câu 1: (1,5 điểm) Trình bày phương pháp hoá học phân biệt các dung dịch bị mất nhãn sau: HCl, Na2SO4, H2SO4. Câu 2: (2,5 điểm) Viết các phương trình phản ứng hóa học theo chuỗi biến hóa sau: Fe FeCl3 Fe(OH)3 Fe2O3 Fe2(SO4)3 Fe(OH)3 Câu 3: (2,0 điểm) Hoà tan hoàn toàn 6,5 g Zn bằng 500ml dd H2SO4 loãng dư. a/ Viết PTHH và tính thể tích khí thoát ra ở (đktc). b/ Tính nồng độ M của dd H2SO4 đã dùng. Cho biết: Zn= 65; O= 16; H =1; S= 32. -----------------Hết------------------- (Cán bộ coi thi không giải thích gì thêm) PHÒNG GD&ĐT TÂY TRÀ TRƯỜNG TH&THCS SỐ 2 TRÀ PHONG ĐÁP ÁN ĐỀ THI HỌC KÌ II NĂM HỌC 2013-2014 MÔN: HÓA HỌC, LỚP 9 (Đáp án gồm có 01 trang) I /TRẮC NGHIỆM KHÁCH QUAN (4,0 điểm) Câu 1 2 3 4 5 6 7 8 Đáp án D A B B C D D C * Mỗi câu đúng được 0,5 điểm. II/ TỰ LUẬN (6,0 điểm) TT Câu Nội dung Số điểm 01 1 Trích ở mỗi chất lỏng một ít hóa chất đựng vào 3 ống nghiệm làm mẫu thử: - Dùng quì tím nhận ra HCl và H2SO4 vì 2 dd này làm quì tím chuyển sang màu đỏ dung dịch không làm đổi màu quì tím là Na2SO4. - Dùng dung dịch BaCl2 nhận ra dd H2SO4 nhờ xuất hiện kết tủa trắng. H2SO4 + BaCl2 " BaSO4 + 2 HCl Dung dịch còn lại không thấy có hiện tượng gì là dd HCl 0,25 điểm 0,5 điểm 0,25 điểm 0,25 điểm 0,25 điểm 02 2 1. 2. (0,5đ) 3. 4. 5. 0,5 điểm 0,5 điểm 0,5 điểm 0,5 điểm 0,5 điểm 03 3 PTHH: Zn + H2SO4 " ZnSO4 + H2 Theo PTHH ta có số mol H2 = số mol H2SO4 = số mol Zn = 6,5 /65 = 0,1 mol Thể tích khí H2 ở đktc là: 0,1 . 22,4 = 2,24 (l) Nồng độ mol của dd H2SO4 là: 0,1/0,5= 0,2M 0,5 điểm 0,5 điểm 0,5 điểm 0,5 điểm * Học sinh có cách giải khác, nếu đúng vẫn cho điểm tối đa.
Tài liệu đính kèm:
 DE_THI_HK_II_HOA_9.doc
DE_THI_HK_II_HOA_9.doc





