Đề kiểm tra học kì II môn Hóa học lớp 9
Bạn đang xem tài liệu "Đề kiểm tra học kì II môn Hóa học lớp 9", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
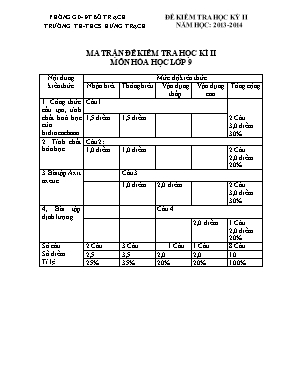
PHÒNG GD- ĐT BỐ TR ẠCH ĐỀ KIỂM TRA HỌC KỲ II TRƯỜNG TH-THCS HƯNG TRẠCH NĂM HỌC: 2013-2014 MA TRẬN ĐỀ KIỂM TRA HỌC KÌ II MÔN HÓA HỌC LỚP 9 Nội dung kiến thức Mức độ kiến thức Nhận biết Thông hiểu Vận dụng thấp Vận dụng cao Tổng cộng 1. Công thức cấu tạo, tính chất hoá học của hiđrocacbnon Câu 1 1,5 điểm 1,5 điểm 2 Câu 3,0 điểm 30% 2. Tính chất hóa học Câu 2: 1,0 điểm 1,0 điểm 2 Câu 2,0 điểm 20% 3.Bài tập Axit axetic Câu 3 1,0 điểm 2,0 điểm 2 Câu 3,0 điểm 30% 4, Bài tập định lượng. Câu 4 2,0 điểm 1 Câu 2,0 điểm 20% Số câu Số điểm Tỉ lệ 2 Câu 3 Câu 1 Câu 1 Câu 8 Câu 2,5 3,5 2,0 2,0 10 25% 35% 20% 20% 100% ĐỀ I: Câu 1 (3 đ): Em hãy viết công thức cấu tạo và nêu tính chất hóa học đặc trưng của metan, etylen và axetylen. Viết các phương trình phản ứng đó. Câu 2 (2 đ): Hoàn thành các phương trình phản ứng sau: a) C2H2 + .. t0 ... + H2O b) .. + men CH3COOH + .. c) ... + . H2SO4 CH3COOC2H5 + .. d) CH4 + .. á. sáng HCl + . Câu 3. (3 đ) Để hòa tan hết a gam natri cacbonat cần dùng 300 gam dung dịch axit axetic thu được 8,4 lít khí cacbonđioxit đo ở (đktc). a/ Viết phương trình hóa học xảy ra. b/ Tìm a và tính nồng độ phần trăm của axit axetic đã dùng. Câu 4. (2 đ) Đốt cháy hoà toàn 3 gam một hợp chất hữu cơ A thấy sinh ra 6,6 gam khí CO2 và 3,6 gam H2O. Biết khối lượng mol của A bằng 60. Xác định công thức phân tử của A. ĐỀ II: Câu 1 (3 đ): Em hãy viết công thức cấu tạo và nêu tính chất hóa học đặc trưng của metan, etylen và axetylen. Viết các phương trình phản ứng đó. Câu 2 (2 đ): Hoàn thành các phương trình phản ứng sau: a) C2H4 + .. t0 ... + H2O b) C2H5OH + men + .. c) ... + . CH3COONa + H2O d) C6H6 + . Fe, t0 HBr + . Câu 3. (3 đ) Để hòa tan hết a gam kali cacbonat cần dùng 200 gam dung dịch axit axetic thu được 10,64 lít khí cacbonđioxit đo ở (đktc). a/ Viết phương trình hóa học xảy ra. b/ Tìm a và tính nồng độ phần trăm của axit axetic đã dùng. Câu 4. (2 đ) Đốt cháy hoà toàn 4,5 gam một hợp chất hữu cơ A thấy sinh ra 6,6 gam khí CO2 và 2,7 gam H2O. Biết khối lượng mol của A bằng 60. Xác định công thức phân tử của A. ĐÁP ÁN ĐỀ KIỂM TRA HỌC KÌ II MÔN HÓA 9 ĐỀ I: Đáp án Biểu điểm Câu 1: - Viết đúng mỗi công thức cấu tạo được 0,5 đ. - Tính chất hóa học đặc trưng của: + metan: tham gia phản ứng thế: CH4 + Cl2 á sáng CH3Cl + HCl + etylen: Tham gia phản ứng cộng: C2H4 + Br2 C2H4Br2 + axetylen: phản ứng cộng: C2H2 + Br2 C2H2Br2 Hoặc C2H2 + 2 Br2 C2H2Br4 Câu 2: Phương trình phản ứng: a) C2H2 + 2,5O2 t0 2CO2 + H2O b) C2H5OH + O2 men CH3COOH + H2O c) CH3COOH + C2H5OH H2SO4 CH3COOC2H5 + H2O d) CH4 + Cl2 á. sáng HCl + CH3Cl Câu 3: a. PTHH. Na2CO3 + 2CH3COOH 2CH3COONa + H2O + CO2 b. Ta có: Theo PTPƯ ta có: Vậy nồng độ % dung dịch axit axetic là: Câu 4: Ta có: Và: Mà : mC + mH < mA . Vậy trong A có C, H và O. Với mO = 3 – (0,4 + 1,8) =0,8 g => nO = 0,8: 16 = 0,05 (mol) Công thức tổng quát của A là: CxHyOz Ta có tỉ lệ: x: y: z = 0,15: 0,4: 0,05 =3: 8: 1 Vậy công thức đơn giản là (C3H8O)n Với MA = 60 nên n = 1. Công thức phân tử là C3H8O 1,5 đ 0.25 đ 0.25 đ 0.25 đ 0.25 đ 0.25 đ 0.25 đ 0.5 đ 0.5 đ 0.5 đ 0.5 đ 0.5 đ 0.5 đ 0.5 đ 0.5 đ 0.5 đ 0.5 đ 0.25 đ 0.25 đ 0.25 đ 0.25 đ 0.25 đ 0.25 đ 0.25 đ 0.25 đ ĐÁP ÁN ĐỀ KIỂM TRA HỌC KÌ II MÔN HÓA 9 ĐỀ II: Đáp án Biểu điểm Câu 1: - Viết đúng mỗi công thức cấu tạo được 0,5 đ. - Tính chất hóa học đặc trưng của: + metan: tham gia phản ứng thế: CH4 + Cl2 á sáng CH3Cl + HCl + etylen: Tham gia phản ứng cộng: C2H4 + Br2 C2H4Br2 + axetylen: phản ứng cộng: C2H2 + Br2 C2H2Br2 Hoặc C2H2 + 2 Br2 C2H2Br4 Câu 2: Phương trình phản ứng: a) C2H4 + 3O2 t0 2CO2 + 2H2O b) C2H5OH + O2 men CH3COOH + H2O c) CH3COOH + NaOH CH3COONa + H2O d) C6H6 + Br2 Fe, t0 HBr + C 6H5Br Câu 3: a. PTHH. K2CO3 + 2CH3COOH 2CH3COOK + H2O + CO2 b. Ta có: Theo PTPƯ ta có: Vậy nồng độ % dung dịch axit axetic là: Câu 4: Ta có: Và: Mà : mC + mH < mA . Vậy trong A có C, H và O. Với mO = 4,5 – (0,3 + 1,8) =2,4 g => nO = 2,4: 16 = 0,15 (mol) Công thức tổng quát của A là: CxHyOz Ta có tỉ lệ: x: y: z = 0,15: 0,3: 0,15 =1: 2: 1 Vậy công thức đơn giản là (CH2O)n Với MA = 60 nên n = 2. Công thức phân tử là C2H4O2 1,5 đ 0.25 đ 0.25 đ 0.25 đ 0.25 đ 0.25 đ 0.25 đ 0.5 đ 0.5 đ 0.5 đ 0.5 đ 0.5 đ 0.5 đ 0.5 đ 0.5 đ 0.5 đ 0.5 đ 0.25 đ 0.25 đ 0.25 đ 0.25 đ 0.25 đ 0.25 đ 0.25 đ 0.25 đ Giáo viên: Nguyễn Hải Nam
Tài liệu đính kèm:
 de_kiem_tra_hoc_ki_II_mon_Hoa_9_co_ma_tran.doc
de_kiem_tra_hoc_ki_II_mon_Hoa_9_co_ma_tran.doc





