Đề cương ôn tập Hóa 8 - Học kỳ II
Bạn đang xem tài liệu "Đề cương ôn tập Hóa 8 - Học kỳ II", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
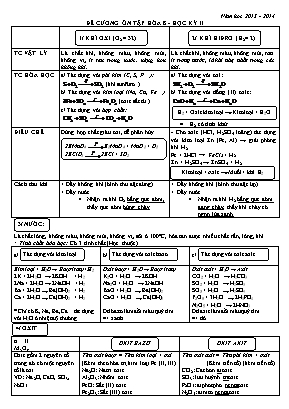
Năm học 2013 - 2014 ĐỀ CƯƠNG ễN TẬP HểA 8 - HỌC KỲ II 1/ KHÍ OXI (O2 = 32) 2/ KHÍ HIĐRO (H2= 2) TC VẬT Lí Là chất khớ, khụng màu, khụng mựi, khụng vị, ớt tan trong nước, nặng hơn khụng khớ. Là chất khớ, khụng màu, khụng mựi, tan ớt trong nước, là khớ nhẹ nhất trong cỏc khớ. TC HểA HỌC a/ Tỏc dụng với phi kim (C, S, P): (khớ sunfurơ ) b/ Tỏc dụng với kim loại (Na, Cu, Fe) (oxit sắt từ ) c/ Tỏc dụng với hợp chất: Kim loại + Axit đ Muối + khớ H2 a/ Tỏc dụng với oxi: b/ Tỏc dụng với đồng (II) oxit: H2 + Oxit kim loại đ Kim loại + H2O H2 cú tớnh khử ĐIỀU CHẾ Dựng hợp chất giàu oxi, dễ phõn hủy 2KMnO4 K2MnO4 + MnO2 + O2 2KClO3 2KCl + 3O2 - Cho axit (HCl, H2SO4 loóng) tỏc dụng với kim loại Zn (Fe, Al) đ giải phúng khớ H2. Fe + 2HCl đ FeCl2 + H2 Zn + H2SO4 đ ZnSO4 + H2 Cỏch thu khớ + Đẩy khụng khớ (bỡnh thu đặt đỳng). + Đẩy nước Nhận ra khớ O2 bằng que đúm, thấy que đúm bựng chỏy. + Đẩy khụng khớ (bỡnh thu đặt ỳp) + Đẩy nước Nhận ra khớ H2 bằng que đúm đang chỏy, thấy khớ chỏy cú ngọn lửa xanh 3/ NƯỚC: Là chất lỏng, khụng màu, khụng mựi, khụng vị, sụi ở 1000C, hũa tan được nhiều chất rắn, lỏng, khớ. * Tớnh chất húa học: Cú 3 tớnh chất (Học thuộc) Tỏc dụng với kim loại a/ Tỏc dụng với oxit bazơ b/ Tỏc dụng với oxit axit c/ Kim loại + H2Ođ Bazơ (tan)+H2 2K + 2H2O đ 2KOH + H2 2Na + 2H2O đ 2NaOH + H2 Ba + 2H2O đ Ba(OH)2 + H2 Ca + 2H2O đ Ca(OH)2 + H2 * Chỉ cú K, Na, Ba, Catỏc dụng với H2O ở nhiệt độ thường Oxit bazơ + H2Ođ Bazơ (tan) K2O + H2O đ 2KOH Na2O + H2O đ 2NaOH BaO + H2O đ Ba(OH)2 CaO + H2O đ Ca(OH)2 Dd bazơ làm đổi màu quỳ tớm => xanh Oxit axit + H2Ođ Axit CO2 + H2O đ H2CO3 SO2 + H2O đ H2SO3 SO3 + H2O đ H2SO4 P2O5 + 3H2O đ 2H3PO4 N2O5 + H2O đ 2HNO3 Dd axit làm đổi màu quỳ tớm => đỏ 4/ OXIT n II MxOy OXIT AXIT OXIT BAZƠ Oxit gồm 2 nguyờn tố trong đú cú một nguyờn tố là oxi VD: Na2O, CaO, SO3, N2O5 Tờn oxit bazơ = Tờn kim loại + oxi (Kốm theo húa trị kim loại Fe (II, III) Na2O: Natri oxit Al2O3: Nhụm oxit FeO: Sắt (II) oxit Fe2O3: Sắt (III) oxit Tờn oxit axit = Tờn phi kim + oxit (Kốm tiền tố) (kốm tiền tố) CO2: Cacbon đioxit SO3: lưu huỳnh trioxit P2O5: điphotpho pentaoxit N2O5: đinitơ pentaoxit 5/ AXIT I n Hn-gốc axit Axit khụng cú oxi (HCl, H2S, HB r, HF) Axit cú oxi (H2SO4, HNO3, H2CO3, H3PO4..) Gồm cú 1 hay nhiều nguyờn tử H liờn kết với gốc axit Axit + tờn phi kim + hiđric HCl: Axit clohiđric H 2S: Axit sunfuhiđric HF: Axit flohiđric Axit + tờn phi kim + ic (ơ) H2So4: Axit sunfuric H2SO3: Axit sunfurơ H3PO4: Axit photphoric 6/ BAZƠ n I M(OH)n Bazơ tan (gọi là Kiềm): LiOH, KOH, NaOH, Ba(OH)2, Ca(OH)2 Bazơ khụng tan Cu(OH)2, Mg(OH)2, Al(OH)3, Fe(OH)2 Gồm cú 1 nguyờn tử kim loại liờn kết với một hay nhiều nhúm - OH Tờn kim loại + hiđroxit NaOH: Natri hiđroxit Ca(OH) 2: Canxi hiđroxit Ba(OH)2: Bari hiđroxit LiOH: Liti hiđroxit Tờn kim loại (kốm theo húa trị + hiđroxit Al(OH)3: nhụm hiđroxit Fe(OH)2: Sắt (II) hiđroxit Fe(OH)3: Sắt (III) hiđroxit 7/ MUỐI x y Kim loại - gốc axit Muối trung hũa (Trong gốc Axit khụng cú ngtử H) Muối axit (Trong gốc axit cũn nguyờn tử H) Gồm 1 hay nhiều nguyờn tử kim loại liờn kết với gốc axit Tờn kim loại + Tờn gốc axit Na2SO4: Natri sunfat CaCO3: Canxi cacbonat FeCl2: Sắt (II) clorua Fe(NO3)3: Sắt (III) nitrat Tờn kim loại + Tờn gốc axit NaHSO4: Natri hiđrosunfat Ca(HCO3)2: Canxi hiđrocacbonat Ca(H2PO4): Canxi đihiđrophotphat * TấN GỐC AXIT (Thuộc) -Cl =S -NO3 =CO3 =SO4 =SO3 =PO4 Clorua Sunfua Nitrat Cacbonat Sunfat Sunfit Photphat 8/ Cỏc loại phản ứng húa học Cỏc loại phản ứng húa học Tổng quỏt Vớ dụ PTHH 1. Phản ứng húa hợp (2 hay nhiều chất đ 1 chất) A + B đ AB Na2O + H2O đ 2NaOH 2. Phản ứng phõn hủy (1 chất đ 2 hay nhiều chất) AB đ A + B 2Fe(OH)3 đ Fe2O3 + 3H2 O 3. Phản ứng thế Đơn chất + Hợp chất đ A + BC đ AC + B 2Al + 6HCl đ 2AlCl3 + 3H2 NHẬN BIẾT CHẤT KHÍ KHÍ O2 KHÍ H2 KHÍ CO2 KHễNG KHÍ - Dựng que đúm cũn tàn đỏ, thấy que bựng chỏy - Dựng que đang chỏy, khớ chỏy với ngọn lửa màu xanh. - Dẫn khớ qua CuO (đen) thấy chuyển thành Cu (đỏ) - Dựng que đang chỏy, khớ làm que tắt. - Dẫn qua dd nước vụi trong, thấy nước vụi trong đục. Cũn lại sau khi nhận biết cỏc chất khớ. Cỏc cụng thức tớnh toỏn: Tớnh số mol (n) Tớnh thể tớch khớ (V) Tớnh khối lượng (m) Tớnh nồng độ % (C%) Tớnh nồng độ mol/l V = n.22,4 * Tớnh thể tớch k/khớ m = n . M
Tài liệu đính kèm:
 ON_TAP_HOA_8_HK_2_RAT_HAY.doc
ON_TAP_HOA_8_HK_2_RAT_HAY.doc





