Các chuyên đề Hóa học vô cơ bồi dưỡng học sinh giỏi THCS
Bạn đang xem tài liệu "Các chuyên đề Hóa học vô cơ bồi dưỡng học sinh giỏi THCS", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
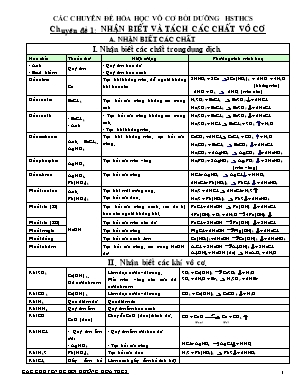
CÁC CHUYÊN ĐỀ HĨA HỌC VƠ CƠ BỒI DƯỠNG HSTHCS Chuyên đề 1: NHẬN BIẾT VÀ TÁCH CÁC CHẤT VÔ CƠ A. NHẬN BIẾT CÁC CHẤT I. Nhận biết các chất trong dung dịch. Hoá chất Thuốc thử Hiện tượng Phương trình minh hoạ - Axit - Bazơ kiềm Quỳ tím - Quỳ tím hoá đỏ - Quỳ tím hoá xanh Gốc nitrat Cu Tạo khí không màu, để ngoài không khí hoá nâu 8HNO3 + 3Cu 3Cu(NO3)2 + 2NO + 4H2O (không màu) 2NO + O2 2NO2 (màu nâu) Gốc sunfat BaCl2 Tạo kết tủa trắng không tan trong axit H2SO4 + BaCl2 BaSO4+ 2HCl Na2SO4 + BaCl2 BaSO4+ 2NaCl Gốc sunfit - BaCl2 - Axit - Tạo kết tủa trắng không tan trong axit. - Tạo khí không màu. Na2SO3 + BaCl2 BaSO3+ 2NaCl Na2SO3 + HCl BaCl2 + SO2 + H2O Gốc cacbonat Axit, BaCl2, AgNO3 Tạo khí không màu, tạo kết tủa trắng. CaCO3 +2HCl CaCl2 + CO2 + H2O Na2CO3 + BaCl2 BaCO3 + 2NaCl Na2CO3 + 2AgNO3 Ag2CO3 + 2NaNO3 Gốc photphat AgNO3 Tạo kết tủa màu vàng Na3PO4 + 3AgNO3 Ag3PO4 + 3NaNO3 (màu vàng) Gốc clorua AgNO3, Pb(NO3)2 Tạo kết tủa trắng HCl + AgNO3 AgCl + HNO3 2NaCl + Pb(NO3)2 PbCl2 + 2NaNO3 Muối sunfua Axit, Pb(NO3)2 Tạo khí mùi trứng ung. Tạo kết tủa đen. Na2S + 2HCl 2NaCl + H2S Na2S + Pb(NO3)2 PbS+ 2NaNO3 Muối sắt (II) NaOH Tạo kết tủa trắng xanh, sau đó bị hoá nâu ngoài không khí. FeCl2 + 2NaOH Fe(OH)2 + 2NaCl 4Fe(OH)2 + O2 + 2H2O 4Fe(OH)3 Muối sắt (III) Tạo kết tủa màu nâu đỏ FeCl3 + 3NaOH Fe(OH)3 + 3NaCl Muối magie Tạo kết tủa trắng MgCl2 + 2NaOH Mg(OH)2 + 2NaCl Muối đồng Tạo kết tủa xanh lam Cu(NO3)2 +2NaOH Cu(OH)2 + 2NaNO3 Muối nhôm Tạo kết tủa trắng, tan trong NaOH dư AlCl3 + 3NaOH Al(OH)3 + 3NaCl Al(OH)3 + NaOH (dư) NaAlO2 + 2H2O II. Nhận biết các khí vô cơ. Khí SO2 Ca(OH)2, Dd nước brom Làm đục nước vôi trong. Mất màu vàng nâu của dd nước brom SO2 + Ca(OH)2 CaSO3 + H2O SO2 + 2H2O + Br2 H2SO4 + 2HBr Khí CO2 Ca(OH)2 Làm đục nước vôi trong CO2 + Ca(OH)2 CaCO3 + H2O Khí N2 Que diêm đỏ Que diêm tắt Khí NH3 Quỳ tím ẩm Quỳ tím ẩm hoá xanh Khí CO CuO (đen) Chuyển CuO (đen) thành đỏ. CO + CuO Cu + CO2 (đen) (đỏ) Khí HCl - Quỳ tím ẩm ướt - AgNO3 - Quỳ tím ẩm ướt hoá đỏ - Tạo kết tủa trắng HCl + AgNO3 AgCl+ HNO3 Khí H2S Pb(NO3)2 Tạo kết tủa đen H2S + Pb(NO3)2 PbS+ 2HNO3 Khí Cl2 Giấy tẩm hồ tinh bột Làm xanh giấy tẩm hồ tinh bột Axit HNO3 Bột Cu Có khí màu nâu xuất hiện 4HNO3 + Cu Cu(NO3)2 + 2NO2+ 2H2O * Bài tập: @. Nhận biết bằng thuốc thử tự chọn: Câu 1: Trình bày phương pháp phân biệt 5 dung dịch: HCl, NaOH, Na2SO4, NaCl, NaNO3. Câu 2: Phân biệt 4 chất lỏng: HCl, H2SO4, HNO3, H2O. Câu 3: Có 4 ống nghiệm, mỗi ống chứa 1 dung dịch muối (không trùng kim loại cũng như gốc axit) là: clorua, sunfat, nitrat, cacbonat của các kim loại Ba, Mg, K, Pb. Hỏi mỗi ống nghiệm chứa dung dịch của muối nào? Nêu phương pháp phân biệt 4 ống nghiệm đó?. Câu 4: Phân biệt 3 loại phân bón hoá học: phân kali (KCl), đạm 2 lá (NH4NO3), và supephotphat kép Ca(H2PO4)2. Câu 5: Có 8 dung dịch chứa: NaNO3, Mg(NO3)2, Fe(NO3)2, Cu(NO3)2, Na2SO4, MgSO4, FeSO4, CuSO4. Hãy nêu các thuốc thử và trình bày các phương án phân biệt các dung dịch nói trên. Câu 6: Có 4 chất rắn: KNO3, NaNO3, KCl, NaCl. Hãy nêu cách phân biệt chúng. Câu 7: Bằng phương pháp hoá học hãy nhận biết các hỗn hợp sau: (Fe + Fe2O3), (Fe + FeO), (FeO + Fe2O3). Câu 8: Có 3 lọ đựng ba hỗn hợp dạng bột: (Al + Al2O3), (Fe + Fe2O3), (FeO + Fe2O3). Dùng phương pháp hoá học để nhận biết chúng. Viết các phương trình phản ứng xảy ra. @. Nhận biết chỉ bằng thuốc thử qui định: Câu 1: Nhận biết các dung dịch trong mỗi cặp sau đây chỉ bằng dung dịch HCl: 4 dung dịch: MgSO4, NaOH, BaCl2, NaCl. 4 chất rắn: NaCl, Na2CO3, BaCO3, BaSO4. Câu 2: Nhận biết bằng 1 hoá chất tự chọn: 4 dung dịch: MgCl2, FeCl2, FeCl3, AlCl3. 4 dung dịch: H2SO4, Na2SO4, Na2CO3, MgSO4. 4 axit: HCl, HNO3, H2SO4, H3PO4. Câu 3: Chỉ được dùng thêm quỳ tím và các ống nghiệm, hãy chỉ rõ phương pháp nhận ra các dung dịch bị mất nhãn: NaHSO4, Na2CO3, Na2SO3, BaCl2, Na2S. Câu 4: Cho các hoá chất: Na, MgCl2, FeCl2, FeCl3, AlCl3. Chỉ dùng thêm nước hãy nhận biết chúng. @. Nhận biết không có thuốc thử khác: Câu 1: Có 4 ống nghiệm được đánh số (1), (2), (3), (4), mỗi ống chứa một trong 4 dung dịch sau: Na2CO3, MgCl2, HCl, KHCO3. Biết rằng: Khi đổ ống số (1) vào ống số (3) thì thấy kết tủa. Khi đổ ống số (3) vào ống số (4) thì thấy có khí bay lên. Hỏi dung dịch nào được chứa trong từng ống nghiệm. Câu 2: Trong 5 dung dịch ký hiệu A, B, C, D, E chứa Na2CO3, HCl, BaCl2, H 2SO4, NaCl. Biết: Đổ A vào B có kết tủa. Đổ A vào C có khí bay ra. Đổ B vào D có kết tủa. Xác định các chất có các kí hiệu trên và giải thích. Câu 3: Có 4 lọ mất nhãn A, B, C, D chứa KI, HI, AgNO 3, Na2CO3. + Cho chất trong lọ A vào các lọ: B, C, D đều thấy có kết tủa. + Chất trong lọ B chỉ tạo kết tủa với 1 trong 3 chất còn lại. + Chất C tạo 1 kết tủa và 1 khí bay ra với 2 trong 3 chất còn lại. Xác định chất chứa trong mỗi lọ. Giải thích? Câu 4: Hãy phân biệt các chất trong mỗi cặp dung dịch sau đây mà không dùng thuốc thử khác: a) NaCl, H2SO4, CuSO4, BaCl2, NaOH. b) NaOH, FeCl2, HCl, NaCl. Câu 5: Không được dùng thêm hoá chất nào khác , hãy nhận biết các chất đựng trong các lọ mất nhãn sau: KOH, HCl, FeCl3, Pb(NO3)2, Al(NO3)3, NH4Cl. Câu 6: Không được dùng thêm hoá chất nào khác , hãy nhận biết 5 lọ mất nhãn sau: NaHSO4, Mg(HCO3)2, Ca(HCO3)2, Na2CO3, KHCO3. B. CÂU HỎI TINH CHẾ VÀ TÁCH HỖN HỢP THÀNH CHẤT NGUYÊN CHẤT I. Nguyên tắc: @ Bước 1: Chọn chất X chỉ tác dụng với A (mà không tác dụng với B) để chuyển A thành AX ở dạng kết tủa, bay hơi hoặc hoà tan; tách khỏi B (bằng cách lọc hoặc tự tách). @ Bước 2: Điều chế lại chất A từ AX * Sơ đồ tổng quát: B A, B XY AX (, tan) A Ví dụ: Hỗn hợp các chất rắn: Chất X chọn dùng để hoà tan. CaSO4 Hỗn hợp CO2 Trình bày: + Cho hỗn hợp đun nóng với H2SO4 CaCO3 + H2SO4 CaSO4 + CO2 + H2O + Thu lấy CO2 đem hấp thụ bằng dd Ca(OH)2 dư CO2 + Ca(OH)2 CaCO3 + H2O II. Phương pháp tách một số chất vô cơ cần lưu ý: Chất cần tách Phản ứng tách và phản ứng tái tạo lại chất ban đầu Phương pháp tách Al (Al2O3 hay hợp chất nhôm) Al NaAlO2 Al(OH)3Al2O3 Al Lọc, điện phân Zn (ZnO) Zn Na2ZnO2Zn(OH)2 ZnO Zn Lọc, nhiệt luyện Mg Mg MgCl2 Mg(OH)2MgO Mg Lọc, nhiệt luyện Fe (FeO hoặc Fe2O3) Fe FeCl2 Fe(OH)2FeO Fe Lọc, nhiệt luyện Cu (CuO) Cu CuSO4 Cu(OH)2CuO Cu Lọc, nhiệt luyện III. Bài tập : Câu 1: Tách riêng dung dịch từng chất sau ra khỏi hỗn hợp dung dịch AlCl3, FeCl3, BaCl2. Câu 2: Nêu phương pháp tách hỗn hợp gồm 3 khí: Cl2, H2 và CO2 thành các chất nguyên chất. Câu 3: Nêu phương pháp tách hỗn hợp đá vôi, vôi sống, silic đioxit và sắt (II) clorua thành từng chất nguyên chất. Câu 4: Trình bày phương pháp hoá học để lấy từng oxit từ hỗn hợp : SiO2, Al2O3, Fe2O3 và CuO. Câu 5: Trình bày phương pháp hoá học để lấy từng kim loại Cu và Fe từ hỗn hợp các oxit SiO2, Al2O3, CuO và FeO. Câu 6: Bằng phương pháp hoá học hãy tách từng kim loại Al, Fe, Cu ra khỏi hỗn hợp 3 kim loại. Câu 7: Tinh chế: O2 có lẫn Cl2 , CO2 Cl2 có lẫn O2, CO2, SO2 AlCl3 lẫn FeCl3 và CuCl2 CO2 có lẫn khí HCl và hơi nước Câu 8: Một loại muối ăn có lẫn các tạp chất: Na2SO4, MgCl2, CaCl2, CaSO4. Hãy trình bày phương pháp hoá học để lấy NaCl tinh khiết. Viết PTPƯ. Chuyên đề 2: BÀI TOÁN NỒNG ĐỘ DUNG DỊCH I. Các loại nồng độ: 1. Nồng độ phần trăm (C%): là lượng chất tan có trong 100g dung dịch. Công Thức: : Khối lượng chất tan (g) : Khối lượng dung dịch (g) Với: = V.D V: Thể tích dung dịch (ml) D: Khối lượng riêng (g/ml) Vậy: = II. Nồng độ mol (CM): Cho biết số mol chất tan có trong 1 lít dung dịch : (mol/l) III. Quan hệ giữa nồng độ phần trăm và độ tan S : IV. Quan hệ giữa nồng độ phần trăm và nồng độ mol. Ta có: hay V. Khi pha trộn dung dịch: 1) Sử dụng quy tắc đường chéo: @ Trộn m1 gam dung dịch có nồng độ C1% với m2 gam dung dịch có nồng độ C2%, dung dịch thu được có nồng độ C% là: gam dung dịch gam dung dịch @ Trộn V1 ml dung dịch có nồng độ C1 mol/l với V2 ml dung dịch có nồng độ C2 mol/l thì thu được dung dịch có nồng độ C (mol/l), với Vdd = V1 + V2. ml dung dịch ml dung dịch @ Trộn V1 ml dung dịch có khối lượng riêng D1 với V2 ml dung dịch có khối lượng riêng D2, thu được dung dịch có khối lượng riêng D. ml dung dịch ml dung dịch 2) Có thể sử dụng phương trình pha trộn: (1) , là khối lượng của dung dịch 1 và dung dịch 2. , là nồng độ % của dung dịch 1 và dung dịch 2. là nồng độ % của dung dịch mới. (1) 3) Để tính nồng độ các chất có phản ứng với nhau: - Viết các phản ứng xảy ra. - Tính số mol (khối lượng) của các chất sau phản ứng. - Tính khối lượng hoặc thể tích dung dịch sau phản ứng. C Lưu ý: Cách tính khối lượng dung dịch sau phản ứng. Nếu sản phẩm không có chất bay hơi hay kết tủa. Nếu sản phẩm tạọ thành có chất bay hơi hay kết tủa. Nếu sản phẩm vừa có kết tủa và bay hơi. BÀI TẬP: Câu 1: Tính khối lượng AgNO3 bị tách ra khỏi 75 gam dung dịch bão hoà AgNO3 ở 50oC, khi dung dịch được hạ nhiệt độ đến 20oC. Biết ; . Câu 2: Có 2 dung dịchHCl nồng độ 0,5M và 3M. Tính thể tích dung dịch cần phải lấy để pha được 100ml dung dịch HCl nồng độ 2,5M. Câu 3: Khi hoà tan m (g) muối FeSO4.7H2O vào 168,1 (g) nước, thu được dung dịch FeSO4 có nồng độ 2,6%. Tính m? Câu 4: Lấy 12,42 (g) Na2CO3.10H2O được hoà tan trong 50,1ml nước cất (D = 1g/ml). Tính nồng độ phần trăm của dung dịch thu được. Câu 5: Lấy 8,4 (g) MgCO3 hoà tan vào 146 (g) dung dịch HCl thì vừa đủ. Viết phương trình phản ứng. Tính nồng độ phần trăm của dung dịch HCl đầu? Tính nồng độ phần trăm các chất trong dung dịch sau phản ứng? Câu 6: Hoà tan 10 (g) CaCO3 vào 114,1 (g) dung dịch HCl 8%. Viết phương trình phản ứng. Tính nồng độ phần trăm các chất thu được sau phản ứng? Câu 7: Hoà tan hoà toàn 16,25g một kim loại hoá trị (II) bằng dung dịch HCl 18,25% (D = 1,2g/ml), thu được dung dịch muối và 5,6 lít khí hiđro (đktc). Xác định kim loại? Xác định khối lượng dung dịch HCl 18,25% đã dùng? Tính CM của dung dịch HCl trên? Tìm nồng độ phần trăm của dung dịch muối sau phản ứng? Câu 8: Cho a (g) Fe tác dụng vừa đủ 150ml dung dịch HCl (D = 1,2 g/ml) thu được dung dịch và 6,72 lít khí (đktc). Cho toàn bộ lượng dung dịch trên tác dụng với dung dịch AgNO3 dư, thu được b (g) kết tủa. Viết các phương trình phản ứng. Tìm giá trị a, b? Tính nồng độ phần trăm và nồng độ mol/l dung dịch HCl? Câu 9: Một hỗn hợp gồm Na2SO4 và K2SO4 trộn theo tỉ lệ 1 : 2 về số mol. Hoà tan hỗn hợp vào 102 (g) nước, thu được dung dịch A. Cho 1664 (g) dung dịch BaCl2 10% vào dung dịch A, xuất hiện kết tủa. Lọc bỏ kết tủa, thêm H2SO4 dư vào nước lọc thấy tạo ra 46,6 (g) kết tủa. Xác định nồng độ phần trăm của Na2SO4 và K2SO4 trong dung dịch A ban đầu? Câu 10: Cho 39,09 (g) hỗn hợp X gồm 3 muối: K2CO3, KCl, KHCO3 tác dụng với Vml dung dịch HCl dư 10,52% (D = 1,05g/ml), thu được dung dịch Y và 6,72 lít khí CO2 (đktc). Chia Y thành 2 phần bằng nhau. - Phần 1: Để trung hoà dung dịch cần 250ml dung dịch NaOH 0,4M. - Phần 2: Cho tác dụng với AgNO3 dư thu được 51,66 (g) kết tủa. a) Tính khối lượng các chất trong hỗn hợp ban đầu? b) Tìm Vml? Câu 11: Cho 46,1 (g) hỗn hợp Mg, Fe, Zn phản ứng với dung dịch HCl thì thu được 17,92 lít H2 (đktc). Tính thành phần phần trăm về khối lượng các kim loại trong hỗn hợp. Biết rằng thể tích khí H2 do sắt tạo ra gấp đôi thể tích H2 do Mg tạo ra. Câu 11: Để hoà tan hoàn toàn 4 (g) hỗn hợp gồm một kim loại hoá trị (II) và một kim loại hoá trị (III) phải dùng 170ml dung dịch HCl 2M. Cô cạn dung dịch sau phản ứng sẽ thu được bao nhiêu gam hỗn hợp muối khan. Tính thể tích khí H2 (ở đktc) thu được sau phản ứng. Nếu biết kim loại hoá trị (III) ở trên là Al và nó có số mol gấp 5 lần số mol kim loại hoá trị (II). Hãy xác định tên kim loại hoá trị (II). Câu 12: Có một oxit sắt chưa công thức. Chia lượng oxit này làm 2 phần bằng nhau. Để hoà tan hết phần 1 phải dùng 150ml dung dịch HCl 3M. Cho một luồng khí CO dư đi qua phần 2 nung nóng, phản ứng xong thu được 8,4 (g) sắt. Tìm công thức oxit sắt trên. Câu 13: A là một hỗn hợp bột gồm Ba, Mg, Al. Lấy m gam A cho vào nước tới khi hết phản ứng thấy thoát ra 6,94 lít H2 (đktc). Lấy m gam A cho vào dung dịch xút dư tới hết phản ứng thấy thoát ra 6,72 lít H2 (đktc). Lấy m gam A hoà tan bằng một lượng vừa đủ dung dịch axit HCl được một dung dịch và 9,184 lít H2 (đktc). Hãy tính m và % khối lượng các kim loại trong A. Câu 14: X là hỗn hợp hai kim loại Mg và Zn. Y là dung dịch H2SO4 chưa rõ nồng độ. Thí nghiệm 1: Cho 24,3 gam X vào 2 lít Y, sinh ra 8,96 lít khí H2. Thí nghiệm 2: Cho 24,3 gam X vào 3 lít Y, sinh ra 11,2 lít khí H2. (Các thể tích khí đều đo ở đktc) Chứng tỏ rằng trong thí nghiệm 1 thì X chưa tan hết, trong thí nghiệm 2 thì X tan hết. Tính nồng độ mol của dung dịch Y và khối lượng mỗi kim loại trong X. Câu 15: Tính nồng độ ban đầu của dung dịch H2SO4 và dung dịch NaOH biết rằng: Nếu đổ 3 lít dung dịch NaOH vào 2 lít dung dịch H2SO4 thì sau khi phản ứng dung dịch có tính kiềm với nồng độ 0,1 M. Nếu đổ 2 lít dung dịch NaOH vào 3 lít dung dịch H2SO4 thì sau phản ứng dung dịch có tính axit với nồng độ 0,2M. Câu 16: Hoà tan hoàn toàn a gam kim loại M có hoá trị không đổi vào b gam dung dịch HCl được dung dịch D. Thêm 240 gam dung dịch NaHCO3 7% vào D thì vừa đủ tác dụng hết với lượng HCl còn dư, thu được dung dịch E trong đó nồng độ phần trăm của NaCl và muối clorua km loại M tương ứng là 2,5% và 8,12%. Thêm tiếp lượng dư dung dịch NaOH vào E, sau đó lọc lấy kết tủa, rồi nung đến khối lượng không đổi thì thu được 16 gam chất rắn. Viết các phương trình phản ứng. Xác định kim loại và nồng độ phần trăm của dung dịch đã dùng. Câu 17: Hoà tan hoàn toàn m gam kim loại M bằng dung dịch HCl dư, thu được V lít H2 (đktc). Mặt khác hoàn tan hoàn toàn m gam kim loại M bằng dung dịch HNO3 loãng, thu được muối nitrat của M, H2O và cũng V lít khí NO duy nhất (đktc). So sánh hoá trị của M trong muối clorua và trong muối nitrat. Hỏi M là kim loại nào? biết rằng khối lượng muối nitrat tạo thành gấp 1,095 lần khối lượng muối clorua. Câu 18: Hoà tan hoàn toàn 14,2 gam hỗn hợp C gồm MgCO3 và muối cacbonat của kim loại R vào axit HCl 7,3% vừa đủ, thu được dung dịch D và 3,36 lít khí CO2 (đktc). Nồng độ MgCl2 trong dung dịch D bằng 6,028%. Xác định kim loại R và thành phần phần % theo khối lượng của mỗi chất trong C. Cho dung dịch NaOH dư vào dung dịch D, lọc lấy kết tủa rồi nung ngoài không khí đến khi phản ứng hoàn toàn. Tính số gam chất rắn còn lại sau khi nung. Câu 19: Khi cho a gam Fe vào trong 400ml dung dịch HCl, sau khi phản ứng kết thúc đem cô cạn dung dịch thu được 6,2 gam chất rắn X. Nếu cho hỗn hợp gồm a gam Fe và b gam Mg vào trong 400ml dung dịch HCl thì sau khi phản ứng kết thúc, thu được 896ml H2 (đktc) và cô cạn dung dịch thì thu được 6,68 gam chất rắn Y. Tính a, b, nồng độ mol của dung dịch HCl và thành phần khối lượng các chất trong X, Y. (Giả sử Mg không phản ứng với nước và khi phản ứng với axit Mg phản ứng trước hết Mg mới đến Fe. Cho biết các phản ứng xảy ra hoàn toàn). Câu 20: Dung dịch X là dung dịch H2SO4, dung dịch Y là dung dịch NaOH. Nếu trộn X và Y theo tỉ lệ thể tích là VX : VY = 3 : 2 thì được dung dịch A có chứa X dư. Trung hoà 1 lít A cần 40 gam KOH 20%. Nếu trộn X và Y theo tỉ lệ thể tích VX : VY = 2 : 3 thì được dung dịch B có chứa Y dư. Trung hoà 1 lít B cần 29,2 gam dung dịch HCl 25%. Tính nồng độ mol của X và Y. Chuyên đề 3: BÀI TOÁN VỀ ĐỘ TAN. @ Hướng giải: Dựa vào định nghĩa và dữ kiện bài toán ta có công thức: 1. Trong đó: S là độ tan là khối lượng chất tan 2. là khối lượng dung dịch bão hoà là khối lượng dung môi @ Bài tập: Câu 1: Xác định lượng NaCl kết tinh trở lại khi làm lạnh 548 gam dung dịch muối ăn bão hoà ở 50oC xuống OoC. Biết độ tan của NaCl ở 50oC là 37 gam và ở OoC là 35 gam. ĐS: Câu 2: Hoà tan 450g KNO3 vào 500g nước cất ở 2500C (dung dịch X). Biết độ tan của KNO3 ở 200C là32g. Hãy xác định khối lượng KNO3 tách ra khỏi dung dịch khi làm lạnh dung dịch X đến 200C. ĐS: Câu 3: Cho 0,2 mol CuO tan hết trong dung dịch H2SO4 20% đun nóng (lượng vừa đủ). Sau đó làm nguội dung dịch đến 100C. Tính khối lượng tinh thể CuSO4.5H2O đã tách khỏi dung dịch, biết rằng độ tan của CuSO4 ở 100C là 17,4g. ĐS: Chuyên đề 4: ĐIỀU CHẾ và VIẾT PHƯƠNG TRÌNH HĨA HỌC A- SƠ ĐỒ PHẢN ỨNG Câu 1: Viết phương trình phản ứng hoàn thành sơ đồ sau: Ca CaO Ca(OH)2 CaCO3 Ca(HCO3)2 CaCl2 CaCO3 2) FeCl2 FeSO4 Fe(NO3)2 Fe(OH)2 Fe Fe2O3 FeCl3 Fe2(SO4)3 Fe(NO3)3 Fe(OH)3 * Phương trình khó: - Chuyển muối clorua muối sunfat: cần dùng Ag2SO4 để tạo kết tủa AgCl. - Chuyển muối sắt (II) muối sắt (III): dùng chất oxi hoá (O2, KMnO4,) Ví dụ: 10FeSO4 + 2KMnO4 + 8H2SO4 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O 4Fe(NO3)2 + O2 + 4HNO3 4Fe(NO3)3 + 2H2O Chuyển muối Fe(III) Fe(II): dùng chất khử là kim loại (Fe, Cu,...) Ví dụ: Fe2(SO4)3 + Fe 3FeSO4 2Fe(NO3)3 + Cu 2Fe(NO3)2 + Cu(NO3)2 SO3 H2SO4 3) FeS2 SO2 SO2 NaHSO3 Na2SO3 NaH2PO4 4) P P2O5 H3PO4 Na2HPO4 Na3PO4 * Phương trình khó: 2K3PO4 + H3PO4 3K3HPO4 K2HPO4 + H3PO4 2KH2PO4 ZnO Na2ZnO2 5) Zn Zn(NO3)2 ZnCO3 CO2 KHCO3 CaCO3 * Phương trình khó: ZnO + 2NaOH Na2ZnO2 + H2O KHCO3 + Ca(OH)2 CaCO3 + KOH + H2O A 6) A Fe D G A 7) CaCl2 Ca Ca(OH)2 CaCO3 Ca(HCO3)2 Clorua vôi Ca(NO3)2 (1) (12) (11) (10) (9) (7) (6) (5) (8) Al2O3 Al2(SO4)3 NaAlO2 8) Al Al(OH)3 AlCl3 Al(NO3)3 Al2O3 Câu 2: Hãy tìm 2 chất vô cơ thoả mãn chất R trong sơ đồ sau: A B C R R R R X Y Z Câu 3: Xác định các chất theo sơ đồ biến hoá sau: A1 A2 A3 A4 A A A A A B1 B2 B3 B4 Câu 4: Hoàn thành các phản ứng sau: (1) X + A (2) X + B (3) Fe (4) X + C X + D B- ĐIỀN CHẤT VÀ HOÀN THÀNH PHƯƠNG TRÌNH PHẢN ỨNG Câu 1: Bổ túc các phản ứng sau: FeS2 + O2 A + B J B + D A + H2S C + D B + L E + D C + E F F + HCl G + H2S G + NaOH H + I H + O2 + D J Câu 2: Xác định chất và hoàn thành các phương trình phản ứng: FeS + A B (khí) + C B + CuSO4 D(đen) + E B + F Gvàng + H C + J (khí) L L + KI C + M + N Câu 3: Chọn các chất thích hợp để hoàn chỉnh các PTPƯ sau: X1 + X2 Cl2 + MnCl2 + KCl + H2O X3 + X4 + X5 HCl + H2SO4 A1 + A2 (dư) SO2 + H2O Ca(X)2 + Ca(Y)2 Ca3(PO4)2 + H2O D1 + D2 + D3 Cl2 + MnSO4 + K2SO4 + Na2SO4 + H2O KHCO3 + Ca(OH)2 dư G1 + G2 + G3 Al2O3 + KHSO4 L1 + L2 + L3 Câu 4: Xác định công thức ứng với các chữ cái sau. Hoàn thành PTPƯ: X1 + X2 BaCO3 + CaCO3 + H2O X3 + X4 Ca(OH)2 + H2 X5 + X6 + H2O Fe(OH)3 + CO2 + NaCl C- ĐIỀU CHẾ MỘT CHẤT TỪ NHIỀU CHẤT 1. Điều chế oxit. Phi kim + oxi Nhiệt phân axit (axit mất nước) Kim loại + oxi OXIT Nhiệt phân muối Oxi + hợp chất Nhiệt phân bazơ không tan Kim loại mạnh + oxit kim loại yếu 2. Điều chế axit. Oxit axit + H2O Phi kim + Hiđro AXIT Muối + axit mạnh Ví dụ: P2O5 + 3H2O 2H3PO4 ; H2 + Cl2 2HCl 2NaCl + H2SO4 Na2SO4 + 2HCl 3. Điều chế bazơ. Kim loại(Na, K, Ca, Ba..) + H2O Kiềm + dd muối BAZƠ Oxit bazơ + H2O Điện phân dd muối (có màng ngăn) Ví dụ: 2K + 2H2O 2KOH + H2 ; Ca(OH)2 + K2CO3 CaCO3 + 2KOH Na2O + H2O 2NaOH ; 2KCl + 2H2O 2KOH + H2 + Cl2 4. Điều chế hiđroxit lưỡng tính. Muối của nguyên tố lưỡng tính + NH4OH (hoăc kiềm vừa đủ) Hiđroxit lưỡng tính + Muối mới Ví dụ: AlCl3 + NH4OH 3NH4Cl + Al(OH)3 ZnSO4 + 2NaOH (vừa đủ) Zn(OH)2 + Na2SO4 5. Điều chế muối. a) Từ đơn chất b) Từ hợp chất Axit + Bzơ Kim loại + Axit Axit + Oxit bazơ Oxit axit + Oxit bazơ Kim loại + Phi kim MUỐI Muối axit + Oxit bazơ Muối axit + Bazơ Kim loại + DD muối Axit + DD muối Kiềm + DD muối DD muối + DD muối * BÀI TẬP: Câu 1: Viết các phương trình phản ứng điều chế trực tiếp FeCl2 từ Fe, từ FeSO4, từ FeCl3. Câu 2: Viết phướng trình phản ứng biểu diễn sự điều chế trực tiếp FeSO4 từ Fe bằng các cách khác nhau. Câu 3: Viết các phương trình điều chế trực tiếp: Cu CuCl2 bằng 3 cách. CuCl2 Cu bằng 2 cách. Fe FeCl3 bằng 2 cách. Câu 4: Chỉ từ quặng pirit FeS2, O2 và H2O, có chất xúc tác thích hợp. Hãy viết phương trình phản ứng điều chế muối sắt (III) sunfat. Câu 5: Chỉ từ Cu, NaCl và H2O, hãy nêu cách điều chế để thu được Cu(OH)2. Viết các PTHH xảy ra. Câu 6: Từ các chất KCl, MnO2, CaCl2, H2SO4 đặc. Hãy viết PTPƯ điều chế: Cl2, hiđroclorua. Câu 7: Từ các chất NaCl, KI, H2O. Hãy viết PTPƯ điều chế: Cl2, nước Javen, dung dịch KOH, I2, KClO3. Câu 8: Từ các chất NaCl, Fe, H2O, H2SO4 đặc. Hãy viết PTPƯ điều chế: FeCl2, FeCl3, nước clo. Câu 9: Từ Na, H2O, CO2, N2 điều chế xođa và đạm 2 lá. Viết phương trình phản ứng. Câu 10: Phân đạm 2 lá có công thức NH4NO3, phân đạm urê có công thức (NH2)2CO. Viết các phương trình điều chế 2 loại phân đạm trên từ không khí, nước và đá vôi. Câu 11: Hỗn hợp gồm CuO, Fe2O3. Chỉ dùng Al và HCl hãy nêu 2 cách điều chế Cu nguyên chất. Câu 12: Từ quặng pyrit sắt, nước biển, không khí, hãy viết các phương trình điều chế các chất: FeSO4, FeCl3, FeCl2, Fe(OH)3, Na2SO4, NaHSO4. Chuyên đề 5 : BÀI TẬP VỀ CÔNG THỨC HOÁ HỌC BÀI TẬP Câu 1: Khi hoà tan 21g một kim loại hoá trị II trong dung dịch H2SO4 loãng dư, người ta thu được 8,4 lít hiđro (đktc) và dung dịch A. Khi cho kết tinh muối trong dung dịch A thì thu được 104,25g tinh thể hiđrat hoá. Cho biết tên kim loại. Xác định CTHH của tinh thể muối hiđrat hoá đó. ĐS: a) Fe ; b) FeSO4.7H2O Câu 2: Hai thanh kim loại giống nhau (đều cùng nguyên tố R hoá trị II) và có cùng khối lượng. Cho thanh thứ nhất vào vào dung dịch Cu(NO3)2 và thanh thứ hai vào dung dịch Pb(NO3)2. Sau một thời gian, khi số mol 2 muối bằng nhau, lấy hai thanh kim loại đó ra khỏi dung dịch thấy khối lượng thanh thứ nhất giảm đi 0,2% còn khối lượng thanh thứ hai tăng 28,4%. Xác định nguyên tố R. ĐS: R (Zn) Câu 3: Một hỗn hợp kim loại X gồm 2 kim loại Y, Z có tỉ số khối lượng 1 : 1. Trong 44,8g hỗn hợp X, số hiệu mol của Y và Z là 0,05 mol. Mặt khác nguyên tử khối Y > Z là 8. Xác định kim loại Y và Z. ĐS: Y = 64 (Cu) và Z = 56 (Fe) Câu 4: Hoà tan hoàn toàn 4 gam hỗn hợp gồm 1 kim loại hoá trị II và 1 kim loại hoá trị III cần dùng hết 170 ml HCl 2M. Cô cạn dung dịch thu được bao nhiêu gam muối khô. Tính thoát ra ở đktc. Nêu biết kim loại hoá trị III là Al và số mol bằng 5 lần số mol kim loại hoá trị II thì kim loại hoá trị II là nguyên tố nào? ĐS: a) ; b) ; c) Kim loại hoá trị II là Câu 5: : Cho 15,25 gam hỗn hợp một kim loại hoá trị II có lẫn Fe tan hết trong axit HCl dư thoát ra 4,48 lít H2 (đktc) và thu được dung dịch X. Thêm NaOH dư vào X, lọc kết tủa tách ra rồi nung trong không khí đến lượng không đổi cân nặng 12 gam. Tìm kim loại hoá trị II, biết nó không tạo kết tủa với hiđroxit. ĐS: Ba Câu 6: Nguyên tố X có thể tạo thành với Fe hợp chất dạng FeaXb, phân tử này gồm 4 nguyên tử có khối lượng mol là 162,5 gam. Hỏi nguyên tố X là gì? ĐS: X là clo (Cl) Câu 7: Cho 100 gam hỗn hợp 2 muối clorua của cùng 1 kim loại M (có hoá trị II và III) tác dụng hết với NaOH dư. Kết tủa hiđroxit hoá trị 2 bằng 19,8 gam còn khối lượng clorua kim loại M hoá trị II bằng 0,5 khối lượng mol của M. Tìm công thức 2 clorua và % hỗn hợp. ĐS: Hai muối là FeCl2 và FeCl3 ; %FeCl2 = 27,94% và %FeCl3 = 72,06% Câu 8: Hoà tan 18,4 gam hỗn hợp 2 kim loại hoá trị II và III bằng axit HCl thu được dung dịch A + khí B. Chia B thành 2 phần bằng nhau : Phần B1 đem đốt cháy thu được 4,5 gam H2O. Hỏi cô cạn dd A thu được bao nhiêu gam muối khan. Phần B2 tác dụng hết clo và cho sản phẩm hấp thụ vào 200 ml dung dịch NaOH 20% (d = 1,2). Tìm C% các chất trong dung dịch tạo ra. Tìm 2 kim loại, nếu biết tỉ số mol 2 muối khan = 1 : 1 và khối lượng mol của kim loại này gấp 2,4 lần khối lượng mol của kim loại kia. ĐS: a) ; b) C% (NaOH) = 10,84% và C% (NaCl) = 11,37% c) Kim loại hoá trị II là Zn và kim loại hoá trị III là Al Câu 9: Nung 25,28 gam hỗn hợp FeCO3 và FexOy dư tới phản ứng hoàn toàn, thu được khí A và 22,4 gam Fe2O3 duy nhất. Cho khí A hấp thụ hoàn toàn vào 400ml dung dịch Ba(OH)2 0,15M thu được 7,88g kết tủa. Viết các phương trình phản ứng xảy ra. Tìm công thức phân tử của FexOy. ĐS: b) Fe2O3 Câu 10: Hoà tan hoà toàn m gam kim loại M bằng dung dịch HCl dư, thu được V lít H2 (đktc). Mặt khác hoà tan hoàn toàn m gam kim loại M bằng dung dịch HNO3 loãng, thu được muối nitrat của M, H2O và cũng V lít khí NO duy nhất (đktc). So sánh hoá trị của M trong muối clorua và trong muối nitrat. Hỏi M là kim loại nào? Biết rằng khối lượng muối nitrat tạo thành gấp 1,905 lần khối lượng muối clorua. ĐS: a) ; b) Fe Câu 11: Có 1 oxit sắt chưa biết. - Hoà tan m gam oxit cần 150 ml HCl 3M. - Khử toàn bộ m gam oxit bằng CO nóng, dư thu được 8,4 gam sắt. Tìm công thức oxit. ĐS: Fe2O3 Câu 12: Khử 1 lượng oxit sắt chưa biết bằng H2 nóng dư. Sản phẩm hơi tạo ra hấp thụ bằng 100 gam axit H2SO4 98% thì nồng độ axit giảm đi 3,405%. Chất rắn thu được sau phản ứng khử được hoà tan bằng axit H2SO4 loãng thoát ra 3,36 lít H2 (đktc). Tìm công thức oxit sắt bị khử. ĐS: Fe3O4 Câu 13: Hỗn hợp X gồm 2 kim loại A và B có tỉ lệ khối lượng 1 : 1 và khối lượng mol nguyên tử của A nặng hơn B là 8 gam. Trong 53,6 gam X có số mol A khác B là 0,0375 mol. Hỏi A, B là những kim loại nào? ĐS: B là Fe và A là Cu Câu 14: Đốt cháy hoàn toàn m gam chất A cần dùng hết 5,824 dm3 O2 (đktc). Sản phẩm có CO2 và H2O được chia đôi. Phần 1 cho đi qua P2O5 thấy lượng P2O5 tăng 1,8 gam. Phần 2 cho đi qua CaO thấy lượng CaO tăng 5,32 gam. Tìm m và công thức đơn giản A. Tìm công thức phân tử A và biết A ở thể khí (đk thường) có số C 4. ĐS: A là C4H10 Câu 15: Hoà tan 18,4g hỗn hợp 2 kim loại hoá trị II và III bằng axit HCl thu được dung dịch A + khí B. Chia đôi B Phần B1 đem đốt cháy thu được 4,5g H2O. Hỏi cô cạn dung dịch A thu được bao nhiêu gam muối khan. Phần B2 tác dụng hết clo và cho sản phẩm hấp thụ vào 200 ml dung dịch NaOH 20% (d = 1,2). Tìm % các chất trong dung dịch tạo ra. Tìm 2 kim loại, nếu biết tỉ số mol 2 muối khan = 1 : 1 và khối lượng mol kim loại này gấp 2,4 lần khối lượng mol của kim loại kia. ĐS: a) Lượng muối khan = 26,95g b) %NaOH = 10,84% và %NaCl = 11,73% c) KL hoá trị II là Zn và KL hoá trị III là Al Câu 16: Hai nguyên tố X và Y đều ở thể rắn trong điều kiện thường 8,4 gam X có số mol nhiều hơn 6,4 gam Y là 0,15 mol. Biết khối lượng mol nguyên tử của X nhỏ hơn khối lượng mol nguyên tử của Y là 8. Hãy cho biết tên của X, Y và số mol mỗi nguyên tố nói trên. ĐS: - X (Mg), Y (S) - và Câu 17: Nguyên tố R tạo thành hợp chất RH4, trong đó hiđro chiếm 25% khối lượng và nguyên tố R’ tạo thành hợp chất R’O2 trong đó oxi chiếm 69,57% khối lượng. a) Hỏi R và R’ là các nguyên tố gì? b) Hỏi 1 lít khí R’O2 nặng hơn 1 lít khí RH4 bao nhiêu lần (ở cùng điều kiện nhiệt độ, áp suất). c) Nếu ở đktc, V1 lít RH4 nặng bằng V2 lít R’O2 thì tỉ lệ V1/V2 bằng bao nhiêu lần? ĐS: a) R (C), R’(N) ; b) NO2 nặng hơn CH4 = 2,875 lần ; c) V1/V2 = 2,875 lần Câu 18: Khử hoàn toàn 4,06g một oxit kim loại bằng CO ở nhiệt độ cao thành kim loại. Dẫn toàn bộ khí sinh ra vào bình đựng Ca(OH)2 dư, thấy tạo thành 7g kết tủa. Nếu lấy lượng kim loại sinh ra hoà tan hết vào dung dịch HCl dư thì thu được 1,176 lít khí H2 (đktc). Xác định công thức phân tử oxit kim loại. Cho 4,06g oxit kim loại trên tác dụng hoàn toàn với 500 ml dung dịch H2SO4 đặc, nóng (dư) thu được dung dịch X và khí SO2
Tài liệu đính kèm:
 cac_chuyen_de_hoa_hoc_vo_co_boi_duong_hoc_sinh_gioi_thcs.doc
cac_chuyen_de_hoa_hoc_vo_co_boi_duong_hoc_sinh_gioi_thcs.doc





