Đề cương ôn tập học kì II Hóa học 8
Bạn đang xem tài liệu "Đề cương ôn tập học kì II Hóa học 8", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
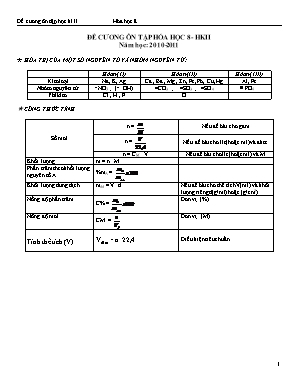
ĐỀ CƯƠNG ÔN TẬP HÓA HỌC 8- HKII Năm học: 2010-2011 Ø HÓA TRỊ CỦA MỘT SỐ NGUYÊN TỐ VÀ NHÓM NGUYÊN TỬ: Hóa trị (I) Hóa trị (II) Hóa trị (III) Kim loại Na, K, Ag Ca , Ba , Mg , Zn, Fe, Pb, Cu, Hg Al, Fe Nhóm nguyên tử -NO3 ; (- OH) =CO3 ; =SO3 ; =SO4 PO4 Phi kim Cl , H , F O Ø CÔNG THỨC TÍNH Số mol n = Nếu đề bài cho gam n = Nếu đề bài cho lít (hoặc ml) và đktc n = CM . V Nếu đề bài cho lít (hoặc ml) và M Khối lượng m = n . M Phần trăm theo khối lượng nguyên tố A %mA = Khối lượng dung dịch mdd = V. d Nếu đề bài cho thể tích V(ml) và khối lượng riêng d(g/ml) hoặc (g/cm3) Nồng độ phần trăm C% = Đơn vị (%) Nồng độ mol CM = Đơn vị (M) Tính thể tích (V) Vđktc = n. 22,4 Điều kiện tiêu chuẩn DẠNG 1: BÀI TẬP LÝ THUYẾT Câu 1a: Viết phương trình hóa học chứng minh oxi là đơn chất phi kim hoạt động mạnh, đặc biệt là ở nhiệt độ cao? Câu 1b. Cho các chất: 1) Fe3O4 2) KClO3 3) CaCO3 4) KMnO4 5) H2O Những chất được dùng để điều chế khí Oxi ở phòng thí nghiệm? Viết PTHH Câu 2: Muốn dặp tắt ngọn lửa do xăng dầu cháy người ta thường trùm vải dày hoặc phủ cát trên ngọn lửa mà không dùng nước. Giải thích việc làm này? Câu 3: Hoàn thành các phương trình phản ứng sau: to a. Al + O2 Al2O3 to b. Na2O + H2O NaOH c. CH4 + O2 CO2 + H2O to d. Fe + O2 Fe3O4 Trong các phản ứng hóa học trên, phản ứng hóa học nào thể hiện sự oxi hóa? Câu 4. Hoàn thành các phương trình hóa học sau to a. KMnO4 " K2MnO4 + MnO2 + O2 b. NO + O2 " NO2 to c. CaCO3 " CaO + CO2 d. MgO + CO2" MgCO3 Hãy cho biết các phản ứng hóa học trên thuộc loại phản ứng hóa học nào (hóa hợp hay phân hủy) Câu 5: Hoàn thành bảng sau: STT Công thức Tên gọi Phân loại 1 CO2 2 Sắt (III) oxit 3 SO2 4 Nhôm oxit Câu 6: Viết phương trình hóa học chứng minh hidro có tinh khử? Câu 7: Nêu định nghĩa phản ứng oxi hóa khử? to Cho phản ứng sau: Fe3O4 + 4CO 3Fe + 4CO2 Hãy xác định chát khử, chất oxi hóa, sự khử, sự oxi hóa? Câu 8: Khi thu khí oxi vào ống nghiệm bằng cách đẩy không khí phải để vị trí ống nghiệm như thế nào? Vì sao? Đối với khí hidro có làm thế được không? Vì sao? Câu 9: Viết phương trình hóa học điều chế hidro trong phòng thí nghiệm và trong công nghiệp? Câu 10: Hoàn thành các phương trình hóa học sau và cho biết các phản ứng trên thuộc loại phản ứng hóa học nào? to a. KClO3 → KCl + 3O2 to b. PbO + H2→ H2 O + Pb to c. CuO + CO → Cu + CO2 to d. H2 + O2 → H2O Câu 11: Cho các sơ đồ phản ứng sau: Na2O + H2O → NaOH BaO + H2O → Ba(OH)2 SO2 + H2O→ H2SO3 P2O5 + H2O → H3PO4 a. Lập phương trình hóa học của phản ứng đó và cho biết thuộc loại phản ứng hóa học nào b. Các sản phẩm tạo thành chất nào là bazo? Chất nào là axit? Cách nhận biết axit ? Bazo? Câu 12:Hoàn thành bảng sau: STT Hợp chất Phân loại Tên gọi 1 CuO 2 KHSO4 3 H2SO4 4 Fe(NO3)2 Câu 13: Hoàn thành bảng sau: STT Hợp chất Phân loại Tên gọi 1 KHCO3 2 Đồng (II) hidroxit 3 CuSO4 4 Axit clohidric Câu 14: Hoàn thành bảng sau: STT Hợp chất Phân loại Tên gọi 1 Điphotphopentaoxi 2 Mg(OH)2 3 Al2(SO4)3 4 Axit photphoric Câu 15a: Cho các sơ đổ phản ứng sau a. N2O5 + H2O →HNO3 to b. KClO3→ KCl + O2 c. Al + H2SO4 → Al2(SO4)3 + H2 d. Fe3O4 + H2 → Fe + H2O Lập phương trình hóa học của các phản ứng trên và cho biết các phương trình trên thuộc loại phản ứng nào? Câu 15b : Viết công thức hoá học các muối có tên gọi sau : a) Sắt(III) sunfat. b) Kẽm clorua. c) Natri cacbonat. Câu 16a: Viết phương trình hóa học thực hiện chuỗi biến hóa sau: a. Na →Na2O → NaOH b. H2 → H2O → H2SO4 → H2 c. KClO3 → O2 → H2O → O2 → Fe3O4. Câu 16b Trong phòng thí nghiệm người ta có thể thu một số khí như clo (Cl2), hiđro H2, amoniac NH3, oxi O2, bằng phương pháp đẩy không khí. Cho hai hình vẽ sau, hãy cho biết hình nào mô tả thu mỗi khí nói trên: Bình thu khí Ống dẫn khí Ống dẫn khí Bình thu khí Hình a: Úp ngược bình Hình b: Đặt xuôi bình A. Hình a mô tả cách thu các khí: B. Hình b mô tả cách thu các khí: Câu 16c: Viết các phương trình phản ứng theo dãy chuyển hoá sau : a) Ca → CaO → Ca(OH)2 b) S → SO2 → H2SO3 Câu 16d: Viết các phương trình phản ứng theo dãy chuyển hoá sau : a) Ba → BaO → Ba(OH)2 b) S → SO2 à SO 3 → H2SO4 c) P → P2O5 → H3PO4 DẠNG 2: DẠNG BÀI TẬP TÍNH THEO PHƯƠNG TRÌNH HÓA HỌC Câu 17: Trong phòng thí nghiệm người ta điều chế oxit sắt từ Fe3O4 bằng cách oxi hóa sắt ở nhiệt độ cao a. Tính số gam sắt và số gam oxi cần dùng để điều chế được 2,32 gam oxit sắt từ. b. Tính số gam kalipemanganat KMnO4 cần dùng để có đủ lượng oxi dùng cho phản ứng trên. (K= 39, Mn = 55, O= 16, Fe = 56) Câu 18a: Đốt cháy hoán toàn 6,2 g photpho trong bình đựng khí oxi. a. Tính khối lượng điphotphopentaoxit tạo thành sau phản ứng. b. Tính thể tích khí oxi tham gia tham gia phản ứng (đktc) c Tính thể tích không khí cần dùng để đốt cháy hết lượng photpho ở trên (biết thể tích oxi chiếm 1/5 thể tích không khí) (P= 31, O = 16) Câu 18b. Lưu huỳnh cháy trong không khí theo phương trình phản ứng: S + O2 → SO2 Biết oxi chiếm 1/5 thể tích không khí. Thể tích không khí ở đktc cần thiết đốt cháy hoàn toàn 3,2 gam lưu huỳnh. Câu 19: Cho 1,3 g kẽm tác dụng với 400ml dung dịch HCl theo sơ đồ phản ứng sau: Zn + HCl → ZnCl2 + H2 a. Lập phương trình hóa học và cho biết phản ứng trên thuộc loại phản ứng hóa học nào? b. Tính khối lượng muối kẽm clorua và thể tích khí hidro (đktc) tạo thành sau phản ứng. c. Tính nồng độ mol/l của dung dịch HCl cần dùng. (Zn =65, H= 1, Cl = 35,5) Câu 20 Cho 0,65 g kẽm tác dụng với dung dịch HCl 2M, sau phản ứng thu được khí hidro (đktc) a. Tính thể tích khí hidro tạo thành sau phản ứng (đktc) b. Tính khối lượng muối thu được sau phản ứng. c. Tính thể tích dung dịch HCl cần dùng. (Zn =65, H= 1, Cl = 35,5) Câu 21: Cho 1,95g kẽm tác dụng với 1,47g H2SO4 loãng nguyên chất. a. Viết phương trình hóa học. b. Tính khối lượng chất còn dư sau phản ứng. c. Tính thể tích khí hidro (đktc) tạo thành sau phản ứng. (Zn =65, H= 1,S =32, O= 16) Câu 22a: Cho 1,62g nhôm tác dụng với 0,15 mol H2SO4 loãng sau phản ứng thu được muối nhôm sunfat và khí hidro thoát ra. a. Viết phương trình hóa học. b. Chất nào còn dư sau phản ứng khối lượng bao nhiêu. c. Tính khối lượng muối thu được sau phản ứng. (Al= 27, S= 32, O= 16 Câu 22b: Cho 3,25 gam Zn tác dụng với dung dịch HCl vừa đủ. Dẫn toàn bộ lượng khí thu được qua CuO nung nóng. a. Viết phương trình hóa học của các phản ứng xảy ra. b. Tính khối lượng Cu thu được sau phản ứng. Cho biết chất nào là chất khử, chất nào là chất oxi hóa ? (Cu =64, H= 1, Cl =35.5, O= 16, Zn = 65) Câu 22c: Cho5,4 gam Al tác dụng với dung dịch H2SO4 lo·ng vừa đủ. Dẫn toàn bộ lượng khí thu được qua CuO nung nóng. a. Viết phương trình hóa học của các phản ứng xảy ra. b. Tính khối lượng Cu thu được sau phản ứng. Cho biết chất nào là chất khử, chất nào là chất oxi hóa ? (Al= 27, S= 32, O= 16, H=1, Cu=64) DẠNG 3: DẠNG BÀI TẬP NHẬN BIẾT Câu 23: Có 4 lọ riêng biệt : nước cất, dung dịch NaOH, dung dịch H2SO4. Bằng cách nào nhận biết được từng chất trong dung dịch. Câu 24: Có 3 lọ đựng riêng biệt 3 khí: oxi, hidro, không khí. Bằng thí nghiệm nào để nhận ra các chất khí trong mỗi lọ. Câu 25: Cho các chất rắn sau: CaO, P2O5, MgO bằng phương pháp hóa học hãy phân biệt các chất rắn trên. DẠNG 4: DẠNG BÀI TẬP DIỀU CHẾ Câu 26: Từ các chất KMnO4, Fe, Cu, dung dịch HCl điều chế các chất sau: khí hidro, khí oxi, CuO, Fe3O4. Câu 27: Từ các chất KClO3, Zn, Fe, H2SO4 loãng điều chế các chất sau: khí hidro, khí oxi, ZnO, Fe3O4. Câu 28: Từ các chất H2SO4 loãng, Zn, KMnO4, P điều chế các chất: khí hidro, khí oxi, nước, H3PO4. Câu 29: Từ các chất sau: Al, Fe, S, KClO3 viết phương trình hóa học điều chế các chất sau: Al2O3, SO2, Fe3O4. DẠNG 5: BÀI TẬP VỀ NỒNG ĐỘ PHẦN TRĂM VÀ NỒNG ĐỘ MOL Câu 30: Cho thêm nước vào 150g dung dịch axit HCl nồng độ 2,65% để tạo thành 2 lít dung dịch. Tính nồng độ mol của dung dịch hu được. Câu 31: Phải lấy bao nhiêu ml dung dịch H2SO4 96% khối lượng riêng là 1,84g/ml để trong đó có 2,45g H2SO4 Câu 32: Cần lấy bao nhiêu ml dung dịch có nồng độ 36% D= 1,19g/ml để pha 5 lít dung dịch HCl có nồng độ 0,5M.
Tài liệu đính kèm:
 DE_CUONG_HKII.doc
DE_CUONG_HKII.doc





