Tài liệu Các chuyên đề Bồi dưỡng Học sinh giỏi Hóa học Trung học cơ sở - Chuyên đề 20: Bài tập hóa bảng biểu
Bạn đang xem tài liệu "Tài liệu Các chuyên đề Bồi dưỡng Học sinh giỏi Hóa học Trung học cơ sở - Chuyên đề 20: Bài tập hóa bảng biểu", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
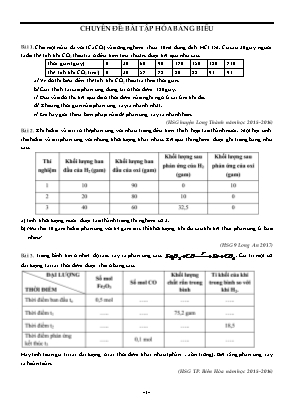
CHUYÊN ĐỀ: BÀI TẬP HÓA BẢNG BIỂU Bài 1. Cho một mẫu đá vôi (CaCO3) vào ống nghiệm chứa 10 ml dung dịch HCl 1M. Cứ sau 30 giây người ta đo thể tích khí CO2 thoát ra ở điều kiện tiêu chuẩn, được kết quả như sau: Thời gian (giây) 0 30 60 90 120 150 180 210 Thể tích khí CO2 (cm3) 0 30 52 78 80 88 91 91 a/ Vẽ đồ thị biểu diễn thể tích khí CO2 thoát ra theo thời gian. b/ Giải thích tại sao phản ứng dừng lại ở thời điểm 180 giây. c/ Dựa vào đồ thị, kết quả đo ở thời điểm nào nghi ngờ là sai lầm khi đo. d/ Khoảng thời gian nào phản ứng xảy ra nhanh nhất. e/ Em hãy giới thiệu biện pháp nào để phản ứng xảy ra nhanh hơn. (HSG huyện Long Thành năm học 2015-2016) Bài 2. Khí hidro và oxi có thểphản ứng với nhau trong điều kiện thích hợp tạo thành nước. Một học sinh cho hidro và oxi phản ứng với những khối lượng khác nhau. Kết quả thí nghiệm được ghi trong bảng như sau: a) Tính khối lượng nước được tạo thành trong thí nghiệm số 3. b) Nếu cho 10 gam hiđro phản ứng với 64 gam oxi, thì khối lượng khí dư sau khi kết thúc phản ứng là bao nhiêu? (HSG 9 Long An 2017) Bài 3. Trong bình kín ở nhiệt độ cao, xảy ra phản ứng sau: . Giá trị một số đại lượng tại các thời điểm được cho ở bảng sau: Hãy tính toán giá trị các đại lượng ở các thời điểm khác nhau (phần .còn trống). Biết rằng phản ứng xảy ra hoàn toàn. (HSG TP. Biên Hòa năm học 2015-2016) Bài 4. Cho một lá nhôm tác dụng với dung dịch axit sunfuric, nhận thấy nhiệt độ của quá trình phản ứng tăng dần. Thể tích khí hiđro thu được tương ứng với thời gian đo được như sau: Thể tích (ml) 4 15 60 80 85 89 90 90 Thời gian (phút) 1 2 3 4 5 6 7 8 a/ Thể tích khí hiđro thu được trong quá trình thí nghiệm thay đổi như thế nào? b/ Vẽ đồ thị biểu diễn thể tích hiđro thu được theo thời gian thí nghiệm (thể tích khí trên trục tung, thời gian trên trục hoành). c/ Hãy giải thích vì sao ở thời điểm từ phút thứ hai đến phút thứ tư, phản ứng hóa học xảy ra nhanh hơn so với các thời điểm khác? d/ Độ dốc của đồ thị xảy ra như thế nào kể từ phút thứ bảy trở đi? e/ Phản ứng hóa học kết thúc vào phút thứ mấy? Bài 5. Đồ thị sau biểu diễn số gam Mg mất đi trong phản ứng với axit HCl Căn cứ vào đồ thị, hãy điền chữ Đ vào câu nhận xét đúng, chữ S vào câu nhận xét sai trong các câu sau : Thời gian kết thúc phản ứng sau 5 phút. Thời gian kết thúc phản ứng sau 3 phút. Lượng magie dư. Lượng axit dư. Axit và magie vừa đủ. Bài 6. Điều chế khí oxi bằng cách phân hủy KMnO4. Kết quả thí nghiệm được ghi lại như sau: Thời gian (giây) Thể tích O2 thu được (cm3) Thời gian giây) Thể tích O2 thu được (cm3) 0 0 40 78 10 8 50 87 20 28 60 90 30 57 70 90 1/ Vẽ đồ thị biểu diễn thể tích khí oxi thu được (trục tung là thể tích khí, trục hoành là thời gian). 2/ Trong khoảng thời gian nào phản ứng là nhanh nhất? chậm nhất? 3/ Dùng đồ thị để tìm thể tích khí sinh ra sau 25 giây; sau 45 giây? 4/ Sau thời gian bao lâu thì phản ứng kết thúc? 5/ Khi phản ứng kết thúc, thể tích khí oxi thu được là bao nhiêu? Bài 7. Trong phòng thí nghiêm, bạn em khảo sát thí nghiệm dùng dung dịch HCl dư tác dụng với một khối lượng nhỏ FeS. Cứ sau một khoảng cách thời gian là 20 giây, bạn em lại ghi thể tích khí thoát ra. Kết quả ghi được như sau (xem bảng) : a) Viết PTHH của phản ứng. b) Vẽ đồ thị biểu diễn thể tích khí H2S thu được (trên trục tung) theo thời gian (trên trục hoành). c) Hãy dùng đồ thị để tìm: – Thể tích khí H2S thu được ở thời điểm 50 giây. – Khoảng cách thời gian nào thì phản ứng xảy ra nhanh nhất ? chậm nhất ? – Thời gian là bao nhiêu giây kể từ khi phản ứng xảy ra cho đến khi phản ứng kết thúc ? d) Em hãy phác hoạ trên đồ thị này một đồ thị biểu diễn thể tích khí H2S thu được, nếu bạn em thay bằng dung dịch HCl khác có cùng thể tích nhưng có nồng độ cao hơn. Bài 8. Oxi được điều chế từ H2O2 với chất xúc tác thích hợp: 2H2O2(dd) → 2H2O(l) + O2(k) Phản ứng xảy ra nhanh hay chậm được xác định theo thể tích khí oxi thu được theo thời gian ở điều kiện phòng thí nghiệm. Kết quả của phản ứng được ghi lại theo đồ thị như hình 6.2. 1. Hãy căn cứ vào đồ thị để cho biết: a) Khoảng thời gian nào khí oxi thoát ra nhiều nhất? b) Thể tích khí oxi thu được khi phản ứng kết thúc? c) Đến khi phản ứng kết thúc thì thời gian là bao nhiêu? 2. Dùng những số liệu của những thí nghiệm trên đồ thị, hãy cho biết: a) Số mol khí oxi điều chế được. b) Số mol hiđro peoxit tham gia phản ứng để điều chế lượng khí oxi đã thu được. c) Tính thể tích dung dịch H2O2 0,25M trước khi tham gia phản ứng; biết 1 mol khí ở điều kiện của phòng thí nghiệm có thể tích là 24 lít. 3. Cho biết tên và công thức hóa học của chất xúc tác đã dùng. Bài 9. Mỗi thí nghiệm được tiến hành với những khối lượng Zn bằng nhau và 50 cm3 dung dịch H2SO4 2M. Phương trình hóa học của phản ứng: Zn + H2SO4 → ZnSO4 + H2↑ Khí hiđro thu được trong mỗi thí nghiệm được ghi lại theo những khoảng cách thời gian nhất định cho đến khi phản ứng kết thúc, được biểu diễn bằng đồ thị sau: Bảng dưới đây cho biết các điều kiện của mỗi thí nghiệm: Thí nghiệm Kẽm Nhiệt độ (oC) 1 Bột 30 2 Lá 20 3 lá 30 1. Dưới đây là một số dụng cụ chính được dùng trong thí nghiệm, ngoài ra còn có ống dẫn khí bằng thủy tinh, ống cao su, Hãy vẽ sơ đồ thiết bị điều chế hiđro. 2. Dụng cụ nào nói trên có thể dùng để lấy 50 cm3 dung dịch axit sunfuric? 3. Trong phòng thí nghiệm không có cân hóa chất, làm thế nào có được những lá kẽm nhỏ với khối lượng bằng nhau để làm thí nghiệm. 4. Rút ra được những kết luận nào khi so sánh kết quả của: a) Thí nghiệm 1 và thí nghiệm 3? b) Thí nghiệm 2 và thí nghiệm 3? 5. Hãy quan sát đồ thị để cho biết đường cong a, b, c biểu thị cho những thí nghiệm nào. Giải thích. 6. Ghi thể tích khí hiđro (trên trục tung) khi phản ứng kết thúc. Biết rằng ở điều kiện phòng thí nghiệm, 1 mol khí có thể tích 24 lít và kẽm còn dư sau các thí nghiệm. Bài 10. Có 4 ống nghiệm, mỗi ống đựng một chất khí khác nhau, chúng được úp ngược trên các chậu đựng nước. Sau một thời gian, thủ pH của các dung dịch, kết quả được ghi ở hình sau: Hãy cho biết: 1. Khí nào tan trong nước nhiều nhất? 2. Khí nào không tan trong nước? 3. Khí nào tan trong nước ít nhất? 4. Khí nào có thể dự đoán là amoniac (NH3)? Biết khí này tan nhiều trong nước, tạo ra dung dịch kiềm yếu. 5. Thêm vài giọt dung dịch NaOH vào chậu B, nhận thấy mực nước trong ống nghiệm B dâng cao hơn. Vì sao lại xảy ra hiện tượng này? 6. Ta có thể dự đoán khí trong ống nghiệm B là khí nào? Vì sao? 7. Ta có thể dự đoán khí trong ống nghiệm D là khí nào? Vì sao? Bài 11. Thu 1 lít khí SO2 vào chai, đậy nút, cân để xác định khối lượng (hình 6.9). Dốc hết khí SO2 ra khỏi chai rồi đặt lên đĩa cân: có hiện tượng mất thăng bằng (hình 6.10). a) Hãy giải thích hiện tượng quan sát được. b) Để cho 2 đĩa cân trở lại vị trí thăng bằng, người ta phải thêm vào đĩa cân bên trái quả cân có tổng khối lượng là 1,5 d (hình 6.11). Biết rằng ở điều kiện của thí nghiệm, 1 lít không khí có khối lượng là 1,2 g. Hãy xác định khối lượng của 1 lít khí SO2 trong điều kiện thí nghiệm. Bài 12. Bảng dưới đây cho biết độ tan của ba muối trong nước ở những nhiệt độ khác nhau: Nhiệt độ của nước (0C) Độ tan (g/100 g nước) KClO3 NaCl Na2SO4 20 8 32 26 40 14 34 50 60 25 36 48 80 35 38 45 100 52 40 42 a) Vẽ đồ thị biểu diễn độ tan của ba muối theo nhiệt độ. Dùng trục hoành là nhiệt độ với khoảng cách 1 cm cho 100C và trục tung là độ tan các chất với khoảng cách 2 cm cho 10 g. b) Độ tan của các chất rắn trong nước thường tăng theo nhiệt độ. Có nhận xét gì về độ tan của ba chất? Chất có độ tan lớn là ở nhiệt độ nào? c) Chất nào có độ tan lớn nhất ở 300C và 900C? Bài 13. Nghiên cứu thí nghiệm hóa học giữa kim loại Mg và dung dịch H2SO4 loãng (dư) bằng cách đo thể tích khí hiđro thu được sau mỗi khoảng thời gian là 5 giây. Được các kết quả ghi trong bảng dưới đây. Thời gian (giây) Thể tích (cm3) ở đktc 0 0 5 18 10 34 15 47 20 57 25 63 30 67 35 69 40 70 45 70 1. Viết phương trình hóa học của phản ứng xảy ra? 2. Vẽ đồ thị biểu diễn thể tích khí hiđro thu được theo thời gian phản ứng (1 cm trên trục tung ứng với 10 cm3 khí H2, 2 cm trên trục hoành ứng với thời gian 10 giây). 3. Trong khoảng thời gian nào thì phản ứng xảy ra nhanh nhất? 4. Nếu dùng 0,075 g Mg cho thí nghiệm này thì: a) Ở thời điểm nào sẽ còn lại 0,025 g Mg chưa tham gia phản ứng? b) Cần thời gian bao lâu để 0,075 g Mg phản ứng hết với axit? Bài 14. Cho các chất lỏng: dd NaOH, dd HCl, dd H2SO4 và H2O được kí hiệu bằng các chữ cái: A, B, C và D (không theo trình tự trên). Kết quả của những thí nghiệm tìm hiểu về những dung dịch này được ghi trong bảng sau: Dung dịch Thuốc thử Quỳ tím Dung dịch BaCl2 A Đỏ Kết tủa trắng B Xanh Không kết tủa C Tím Không kết tủa D Đỏ Không kết tủa Hãy cho biết A, B, C và D là những chất nào. Giải thích và viết các phương trình hóa học của phản ứng. Bài 15. Cho bốn chất rắn màu trắng: AlCl3, MgCl2, Na2SO4 và MgSO4 được kí hiệu bằng các chữ cái: E, F, G và H (không theo trình tự trên). Kết quả của những thí nghiệm tìm hiểu về những chất rắn này được ghi trong bảng sau: Chất Thêm dung dịch BaCl2 vào dung dịch của từng chất Thêm dung dịch NaOH vào dung dịch của từng chất E Tạo ra kết tủa trắng Không có kết tủa F Không có kết tủa Tạo ra kết tủa trắng. Kết tủa này tan trong dung dịch NaOH dư G Không có kết tủa Tạo ra kết tủa trắng. Kết tủa này không tan trong dung dịch NaOH dư H Tạo ra kết tủa trắng Tạo ra kết tủa trắng Hãy cho biết E, F, G và H là những chất nào. Giải thích và viết các phương trình hóa học. Bài 16. Cho những hóa chất sau: Na2SO3, CaSO3, BaSO3, CuSO3 và dung dịch H2SO4. Lựa chọn những chất hóa học nào để điều chế SO2 được thuận lợi nhất? Giải thích sự lựa chọn và viết phương trình hóa học của phản ứng. Bài 17. Khi cho chất A tác dụng với H2SO4 đặc, đun nóng sinh ra chất khí B không màu. Khí B tan rất nhiều trong nước, tạo thành dung dịch axit mạnh. Nếu cho dung dịch B đậm đặc lần lượt tác dụng với mangan đioxit thì sinh ra khí C màu vàng nhạt, mùi hắc. Khi cho một mẩu natri tác dụng với khí C trong bình, lại thấy xuất hiện chất rắn A ban đầu. Ba chất A, B, C là chất nào trong các dãy sau? Chất rắn A Chất rắn B Chất rắn C - Natri cacbonat - Lưu huỳnh đioxit - Oxi - Natri clorua - Cacbon đioxit - Hiđro sunfua - Natri sunfit - Hiđro clorua - Hiđro - Canxi cacbonat - Cacbon monooxit - Clo - Natri sunfat - Hiđro sunfua - Hiđro clrua Bài 18. Cho 0,1g canxi tác dụng với 25,0cm3 nước lạnh ở nhiệt độ phòng. Thể tích khí hiđro đo được trong thời gian 4 phút, mỗi lần đo cách nhau 30 giây. Kết quả thu được như sau: Thời gian (giây) 0 30 60 90 120 150 180 210 240 Thể tích (cm3) 0 20 32 42 50 56 59 60 60 a. Dựa vào bảng số liệu cho biết: tốc độ phản ứng thay đổi thế nào và sau bao nhiêu giây phản ứng kết thúc. b. Tìm thể tích khí hiđro thu được ở nhiệt độ phòng và nồng độ phần trăm của dung dịch sau khi phản ứng kết thúc. Biết ở điều kiện nhiệt độ phòng 1,0 mol khí có thể tích 24000cm3 và khối lượng riêng của nước là 1,0g/cm3. (HSG Tỉnh Quảng Nam năm học 2011-2012)
Tài liệu đính kèm:
 tai_lieu_cac_chuyen_de_boi_duong_hoc_sinh_gioi_hoa_hoc_trung.doc
tai_lieu_cac_chuyen_de_boi_duong_hoc_sinh_gioi_hoa_hoc_trung.doc





