Kiểm tra một tiết (bài số 2) môn: Hóa học - Lớp 9
Bạn đang xem tài liệu "Kiểm tra một tiết (bài số 2) môn: Hóa học - Lớp 9", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
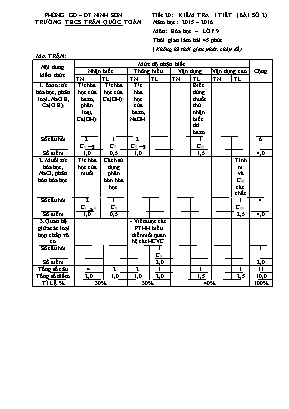
PHÒNG GD – ĐT NINH SƠN Tiết 20: KIỂM TRA 1 TIẾT (BÀI SỐ 2) TRƯỜNG THCS TRẦN QUỐC TOẢN Năm học: 2015 – 2016 Môn: Hóa học – LỚP 9 Thời gian làm bài 45 phút (Không kể thời gian phát, chép đề) MA TRẬN: Nội dung kiến thức Mức độ nhận biết Cộng Nhận biết Thông hiểu Vận dụng Vận dụng cao TN TL TN TL TN TL TN TL 1. Bazơ: t/c hóa học, phân loại; NaOH, Ca(OH)2 T/c hóa học của bazơ, phân loại, Ca(OH)2 T/c hóa học của Ca(OH)2 T/c hóa học của bazơ, NaOH. Biết dùng thuốc thử nhận biết dd bazơ Số câu hỏi 2 C12 1 C7 2 C56 1 C10 6 Số điểm 1,0 0,5 1,0 1,5 4,0 2. Muối: t/c hóa học, NaCl, phân bón hóa học T/c hóa học của muối Cách sử dụng phân bón hóa học Tính m và CM các chất Số câu hỏi 2 C34 1 C8 1 C11 4 Số điểm 1,0 0,5 2,5 4,0 3. Quan hệ giữa các loại hợp chấp vô cơ - Viết được các PTHH biểu diễn mối quan hệ các HCVC Số câu hỏi 1 C9 1 Số điểm 2,0 2,0 Tổng số câu 4 2 2 1 1 1 11 Tổng số điểm 2,0 1,0 1,0 2,0 1,5 2,5 10,0 TỈ LỆ % 30% 30% 40% 100% PHÒNG GD – ĐT NINH SƠN Tiết 20: KIỂM TRA 1 TIẾT (BÀI SỐ 2) TRƯỜNG THCS TRẦN QUỐC TOẢN Năm học: 2015 – 2016 Môn: Hóa học – LỚP 9 Thời gian làm bài 45 phút Họ và tên HS: Lớp: .. Điểm: Lời phê: ĐỀ: (Đề KT có 1 trang) Trắc nghiệm khách quan: (3 điểm) Hãy chọn 1 trong các chữ cái A hoặc B, C, D mà em cho là đúng rồi ghi vào bài làm trắc nghiệm: Câu 1: Cặp oxit phản ứng với nước ở nhiệt độ thường tạo ra dd Bazơ là: A. K2O và CuO; B. Al2O3 và CuO; C. Na2O và K2O; D. Na2O và FeO; Câu 2: Sản phẩm phản ứng phân hủy bởi nhiệt của Cu(OH)2 là: A. CuO và H2; B. Cu và H2O; C. Cu, O2 và H2; D. CuO và H2O; Câu 3: Chất khí nào được sinh ra khi cho Na2SO3 tác dụng với H2SO4 loãng? A. H2; B. O2; C. SO2; D. SO3; Câu 4: Dung dịch tác dụng được với MgCl2: A. AgNO3; B. HCl; C. K2SO4; D. CuSO4; Câu 5: Dùng dung dịch KOH phân biệt được 2 muối: A. NaCl và BaCl2 ; B. NaCl và MgCl 2; C. Na2SO4 và Na2CO3 D. NaNO3 và CaCl2; Câu 6: NaOH có thể làm khô chất khí ẩm sau: A. CO2; B. SO2; C. N2; D. HCl; B. Tự luận: (7 điểm) Câu 7: (0,5 điểm). Nước vôi trong để lâu ngày trong không khí có một lớp váng mỏng CaCO3 trên bề mặt, tại sao? Câu 8: (0,5 điểm). Trong các loại phân đạm, nông dân thường sử dụng loại nào? Vì sao? Câu 9: (2 điểm). Viết các PTHH hoàn thành chuỗi phản ứng sau: (3) (4) (2) (1) CaO --------> Ca(OH)2 --------> CaCO3 --------> CaCl2 --------> Ca(NO3)2 Câu 10: (1,5 điểm). Có 3 lọ không nhãn đựng dd các chất sau: NaOH, Ba(OH)2 , BaCl2. Bằng phương pháp hóa học, hãy nhận biết chúng. Viết PTHH. Câu 11: (2,5 điểm). Trộn 30 ml dd có chứa 3,33 gam CaCl2 với 70 ml dd có chứa 3,4 gam AgNO3. a. Tính khối lượng chất rắn sinh ra. b. Tính nồng độ mol của chất còn lại trong dd sau phản ứng. Biết rằng thể tích của dung dịch thay đổi không đáng kể. (Biết Ca = 40, Cl = 35,5, Ag = 108, N = 14, O = 16) Bài làm phần tự luận PHÒNG GD – ĐT NINH SƠN Tiết 20: KIỂM TRA 1 TIẾT (BÀI SỐ 2) TRƯỜNG THCS TRẦN QUỐC TOẢN Năm học: 2015 – 2016 Môn: Hóa học – LỚP 9 Thời gian làm bài 45 phút (Không kể thời gian phát, chép đề) ĐÁP ÁN, HƯỚNG DẪN CHẤM VÀ BIỂU ĐIỂM: A. Trắc nghiệm khách quan: (3 điểm) Chọn đúng mỗi câu được 0,5 điểm. Câu 1 2 3 4 5 6 Đáp án C D C A B C B. Tự luận: (7 điểm) Câu Đáp án Biểu điểm 7 Vì CO2 trong không khí tác dụng với Ca(OH)2 tạo ra CaCO3 và H2O. 0,5 8 Sử dụng Urê nhiều vì có chứa đạm cao hơn (46% N). 0,5 9 (1) CaO + H2O à Ca(OH)2 0,5 (2) Ca(OH)2 + CO2 à CaCO3 + H2O 0,5 (3) CaCO3 + 2HCl à CaCl2 + CO2 H2O 0,5 (4) CaCl2 + 2AgNO3 à Ca(NO3)2 + 2AgCl 0,5 10 - Dùng quì tím nhận ra BaCl2 0,5 - Dùng ddNa2SO4 nhận ra Ba(OH)2 0,25 Na2SO4 + Ba(OH)2 à BaSO4 + 2NaOH 0,5 - Chất còn lại là NaOH 0,25 11 nCaCl2 = 3,33 : 111 = 0,03 mol 0,25 nAgNO3 = 3,4 : 170 = 0,02 mol 0,25 CaCl2 + 2AgNO3 à Ca(NO3)2 + 2AgCl 1 mol 2mol 1 mol 2 mol 0,03 mol 0,02 mol Tỉ số 0,03 : 1 = 0,03 > 0,02 : 2 = 0,01 CaCl2 dư 0,25 Theo PTHH: = 0,02 mol 0,25 a) mAgCl = 0,02 . 143,5 = 1,435 (g) 0,25 b) Vdd = 30 + 70 = 100 ml = 0,1 (l) 0,25 Theo PTHH: 2 = 0,01 mol 0,25 dư = 0,03 – 0,01 = 0,02 mol 0,25 Nồng độ M các chất trong dung dịch sau phản ứng: = 0,01 : 0,1 = 0,1 M 0,25 dư = 0,02 : 0,1 = 0,2 M 0,25
Tài liệu đính kèm:
 KT HOA 9 TIET 20.doc
KT HOA 9 TIET 20.doc





