Kiểm tra học kì I môn Hóa 9
Bạn đang xem tài liệu "Kiểm tra học kì I môn Hóa 9", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
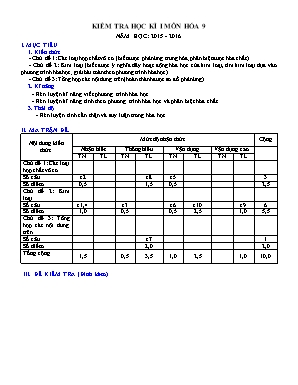
KIỂM TRA HỌC KÌ I MÔN HÓA 9 NĂM HỌC: 2015 - 2016 I. MỤC TIÊU 1. Kiến thức - Chủ đề 1: Các loại hợp chất vô cơ. (biết được phản ứng trung hòa; phân biệt được hóa chất). - Chủ đề 2: Kim loại (biết được ý nghĩa dãy hoạt động hóa học của kim loại, tìm kim loại dựa vào phương trình hóa học; giải bài toán theo phương trình hóa học). - Chủ đề 3: Tổng hợp các nội dung trên (hoàn thành được sơ đồ phản ứng). 2. Kĩ năng - Rèn luyện kĩ năng viết phương trình hóa học. - Rèn luyện kĩ năng tính theo phương trình hóa học và phân biệt hóa chất. 3. Thái độ. - Rèn luyện tính cẩn thận và suy luận trong hóa học. II. MA TRẬN ĐỀ. Nội dung kiến thức Mức độ nhận thức Cộng Nhận biết Thông hiểu Vận dụng Vận dụng cao TN TL TN TL TN TL TN TL Chủ đề 1: Các loại hợp chất vô cơ. Số câu c2 c8 c5 3 Số điểm 0,5 1,5 0,5 2,5 Chủ đề 2: Kim loại Số câu c1,4 c3 c6 c10 c9 6 Số điểm 1,0 0,5 0,5 2,5 1,0 5,5 Chủ đề 3: Tổng hợp các nội dung trên. Số câu c7 1 Số điểm 2,0 2,0 Tổng cộng 1,5 0,5 3,5 1,0 2,5 1,0 10,0 III. ĐỀ KIỂM TRA (Đính kèm) TRƯỜNG THCS VĨNH KHÁNH _______________ ĐỀ KIỂM TRA HỌC KỲ I - NH 2015 – 2016 MÔN: HOÁ HỌC, KHỐI 9 Thời gian: 45 phút (không kể thời gian phát đề) ĐỀ CHÍNH THỨC PHẦN A: TRẮC NGHIỆM (3,0 điểm). Chọn chữ cái A, B, C hoặc D trước câu trả lời đúng. Câu 1: Cặp kim loại nào sau đây đều phản ứng với nước ở điều kiện thường ? A. Na, Fe. B. K, Na. C. Mg, K. D. Al, Fe. Câu 2: Phản ứng giữa axit và bazơ thuộc loại phản ứng nào sau đây ? A. Phản ứng trung hòa. B. Phản ứng thế. C. Phản ứng hóa hợp. D. Phản ứng phân hủy. Câu 3: Khi cạo một lớp mỏng trên bề mặt đồ vật bằng nhôm dùng đã lâu, thấy lộ ra vẻ sáng lánh lánh. Lớp vỏ rất mỏng phủ ngoài bề mặt nhôm có chứa chất nào sao đây ? A. Nhôm. B. Nhôm oxit. C. Nhôm hiđroxit. D. Nhôm sunfua. Câu 4: Nhôm và sắt đều không tác dụng với dung dịch chất nào sau đây ? A. HCl. B. ZnCl2. C. Pb(NO3)2. D. H2SO4 đặc, nguội. Câu 5: Những người đau dạ dày có ợ chua là do môi trường dịch vị dạ dày có A. pH = 7. B. pH = 9. C. pH = 3 ¸4. D. pH = 10. Câu 6: Đốt cháy hết 4,8 gam kim loại R (có hóa trị II) trong khí clo dư, sau phản ứng thu được 19,0 gam muối. Kim loại R là: (cho biết: Mg = 24; Zn = 65; Fe = 56; Cu = 64) A. Mg B. Zn C. Fe D. Cu PHẦN B: TỰ LUẬN (7,0 điểm). Câu 7: (2,0 điểm) Viết phương trình hóa học cho những chuyển đổi sau: Mg MgO MgSO4 Mg(OH)2 MgO Câu 8: (1,5 điểm) Bằng phương pháp hóa học hãy phân biệt 3 dung dịch đựng riêng biệt chứa trong 3 lọ mất nhãn sau: H2SO4, HCl, NaOH. Câu 9: (1,0 điểm) Khi cho một mẫu kim loại Na vào dung dịch CuSO4 thì thấy có khí không màu bay ra đồng thời trong dung dịch có kết tủa màu xanh xuất hiện. Hãy viết phương trình hóa học để giải thích cho hiện tượng trên. Câu 10: (2,5 điểm) Cho 10 gam hỗn hợp A gồm Zn và Cu tác dụng vừa đủ với 200ml HCl, sau khi phản ứng kết thúc thấy có 2,24 lít khí H2 (đktc) thoát ra. a) Viết phương trình hóa học. b) Tính khối lượng từng kim loại có trong A. c)Tính nồng độ mol dung dịch HCl tham gia phản ứng. (Cho: Zn = 65, Cu = 64) --------Hết-------- IV. HƯỚNG DẪN CHẤM PHẦN A: TRẮC NGHIỆM (3,0 điểm). Mỗi câu trắc nghiệm chọn đúng đạt 0,5 điểm x 6 = 3,0 điểm Câu 1 2 3 4 5 6 Đáp án B A B D C A PHẦN B: TỰ LUẬN (7,0 điểm). Câu Nội dung Điểm 7. 2,0đ (1) 2Mg + O2 2MgO 0,5 (2) MgO + H2SO4 ® MgSO4 + H2O 0,5 (3) MgSO4 + 2NaOH ® Mg(OH)2 + 2Na2SO4 0,5 (4) Mg(OH)2 MgO + H2O 0,5 Chú ý: Nếu thiếu cân bằng hoặc sai điều kiện trừ một nửa số điểm phương trình. 8. 1,5đ Lấy mỗi chất một ít làm mẫu thử. Ta có bảng nhận biết sau Chất T.Thử H2SO4 HCl NaOH Quỳ tím Đỏ Đỏ xanh BaCl2 ¯ trắng Còn lại PTHH: H2SO4 + BaCl2 ® BaSO4¯ + 2HCl 0,25 0,5 0,5 0,25 9. 1,0đ 2Na + 2H2O ® 2NaOH + H2 0,5 2NaOH + CuSO4 ® Cu(OH)2¯ + 2Na2SO4 0,5 10. 2,5đ nH2 = = 0,1 (mol) 0,5 PTHH: Zn + 2HCl ® ZnCl2 + H2 0,5 mol: 0,1 ¬ 0,2 ¬ 0,1 Cu + HCl ® không phản ứng b) mZn = 0,1. 65 = 6,5 (gam) 0,5 mCu = 10 – 6,5 = 3,5gam) 0,5 c) CM (HCl) = = 1 M 0,5 *Chú ý: Học sinh làm cách khác đúng, đảm bảo tính khoa học vẫn được hưởng trọn số điểm. ------Hết------
Tài liệu đính kèm:
 de_thi_HKI_hoa_9.doc
de_thi_HKI_hoa_9.doc





