Kiểm tra 1 tiết môn Hóa học 10 cơ bản ( bài số 2)
Bạn đang xem tài liệu "Kiểm tra 1 tiết môn Hóa học 10 cơ bản ( bài số 2)", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
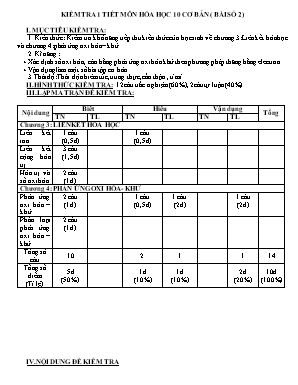
KIỂM TRA 1 TIẾT MÔN HÓA HỌC 10 CƠ BẢN ( BÀI SỐ 2) I. MỤC TIÊU KIỂM TRA: 1. Kiến thức : Kiểm tra khả năng tiếp thu kiến thức của học sinh về chương 3:Liên kết hóa học và chương 4:phản ứng oxi hóa – khử. 2. Kĩ năng : + Xác định số oxi hóa , cân bằng phản ứng oxi hóa khử theo phương pháp thăng bằng electron. + Vận dụng làm một số bài tập cơ bản. 3.Thái độ: Thái độ nhiêm túc, trung thực ,cẩn thận , tỉ mỉ. II.HÌNH THỨC KIỂM TRA: 12 câu trắc nghiệm (60%), 2câu tự luận(40%) III.LẬP MA TRẬN ĐỀ KIỂM TRA: Nội dung Biết Hiểu Vận dụng Tổng TN TL TN TL TN TL Chương 3: LIÊN KẾT HÓA HỌC Liên kết ion 1 câu (0,5đ) 1 câu (0,5đ) Liên kết cộng hóa trị 3 câu (1,5đ) Hóa trị và số oxi hóa 2 câu (1đ) Chương 4: PHẢN ỨNG OXI HÓA- KHỬ Phản ứng oxi hóa – khử. 2 câu (1đ) 1 câu (0,5đ) 1 câu (2đ) 1 câu (2đ) Phân loại phản ứng oxi hóa – khử 2 câu (1đ) Tổng số câu 10 2 1 1 14 Tổng số điểm (Tỉ lệ) 5đ (50%) 1đ (10%) 1đ (10%) 2đ (20%) 10đ (100%) IV.NỘI DUNG ĐỀ KIỂM TRA Phần I:TRẮC NGHIỆM(6 đ)(khoanh tròn vào đáp án đúng). Câu 1B: Liên kết hóa học trong NaCl được hình thành là do : A. hai hạt nhân nguyên tử hút electron rất mạnh B. mỗi nguyên tử Na, Cl góp chung 1 electron C. Na → Na+ + 1e ; Cl + 1e→ Cl- ; Na+ + Cl- → NaCl. D. mỗi nguyên tử đó nhường hoặc thu electron để trở thành các ion trái dấu hút nhau Câu 2B: Chọn định nghĩa đúng nhất về liên kết cộng hóa trị: Liên kết cộng hóa trị là liên kết A. giữa các phi kim với nhau B. trong đó cặp electron chung bị lệch về một nguyên tử C. được hình thành do sự dùng chung electron của hai nguyên tử khác nhau D. được hình thành giữa hai nguyên tử bằng một hay nhiều cặp electron chung Câu 3H: Cho X(Z=9), Y(Z= 19). Kiểu liên kết hóa học giữa X và Y là liên kết: A. cộng hóa trị không cực B. cho – nhận C. ion D. cộng hóa trị có cực Câu 4B: Dãy chất nào sau đây có liên kết cộng hóa trị phân cực: A. H2O, NH3, CO2, Cl2 B. H2, H2O, CH4, NH3 C. NaCl, PH3, HBr, H2S D. CCl4, H2O, NH3, HCl Câu 5B: Số oxi hóa của nitơ trong NH4+, NO2 -, HNO3 lần lượt là : A. +5, -3, +3 B. +3, -3, +5 C. +3, +5, -3 D. -3, +3, +5 Câu 6B: Điện hóa trị của các nguyên tố nhóm VIA, VIIA trong các hợp chất với natri có giá trị: A. 6+ và 7+ B. -2 và -1 C. 2- và 1- D. +6 và +7 Câu 7B: C«ng thøc cÊu t¹o ®óng cña CO2 lµ : A. O = O - C B. O - C = O C. O = C = O D. O ← C = O Câu 8H: Trong ph¶n øng Oxi ho¸ - khö sau: HÖ sè cña c¸c chÊt tham gia ph¶n øng lÇn l ượt lµ: A. 5, 2, 4 B. 5, 2, 3 C. 2, 2, 5 D. 3, 2, 5 Câu B9: Trong ho¸ häc v« c¬, ph¶n øng ho¸ häc nµo cã sè oxi ho¸ cña c¸c nguyªn tè lu«n kh«ng ®æi: A. Ph¶n øng trao ®æi. B. Ph¶n øng ho¸ hîp. C. Ph¶n øng ph©n hñy. D. Ph¶n øng thÕ. Câu 10B: Cho c¸c ph¶n øng : 2Fe + 3Cl2 2FeCl3 (1) 2Al(OH)3 ® Al2O3 + 3H2O (2) CaSO3 + H2SO4 ® CaSO4 + H2O + SO2↑ (3) Cu +2AgNO3 ® 2Ag¯ + Cu(NO3)2 (4) SO3 + H2O ® H2SO4 (5) Ph¶n øng oxi ho¸ - khö lµ ph¶n øng : A. (1) vµ (4) ; B. (4) vµ (5) ; C. (1) vµ (3) D. (2) vµ (4) ; Câu 11B: Ph¶n øng FexOy + HNO3 ® Fe(NO3)3 + ... kh«ng ph¶i lµ ph¶n øng oxi ho¸ – khö khi : A. x = 1 ; y = 1. B. x = 2 ; y = 3. C. x = 3 ; y = 4. D. x = 1 ; y = 0. Câu 12B: Trong ph¶n øng Zn + CuSO4 à ZnSO4 + Cu. Ion Cu2+ là: A. chÊt oxi ho¸, khö B. chÊt khö C. chÊt oxi ho¸ D. kh«ng bÞ oxi ho¸ khö Phần II: TỰ LUẬN(4 đ) Câu 1H: Cân bằng các PTHH sau theo phương pháp thăng bằng electron (ghi rõ chất khử , chất oxi hoá ,quá trình oxi hoá , quá trình khử) 1.Fe + CuSO4 FeSO4 + Cu 2. Zn + H2SO4(đ) → ZnSO4 + H2S + H2O Câu 2VD: Cho 8,7g MnO2 tác dụng với dung dịch HCl đặc,nóng thu được MnCl2 , V(lít) khí Cl2 và H2O.Tính V? V- HƯỚNG DẪN CHẤM VÀ THANG ĐIỂM Phần I: Trăc nghiệm( 0,5đ/câu) Câu 1 2 3 4 5 6 7 8 9 10 11 12 Đ.A D D C D D C C B A A B C Phần II : Tự luận Câu Nội dung Điểm 1 + Xác định đúng số oxi hóa , ghi rõ chất oxi hóa , chất khử + Viết đúng quá trình oxi hóa và quá trình khử + Cân bằng đúng 0,5đ 1đ 0,5đ 2 Số mol MnO2 là: PTPƯ: MnO2 + 4HCl MnCl2 + Cl2 + 2H2O 0,1 ------------------------> 0,1 (mol) Thể tích khí Clo thu được là: 0,5đ 1đ 0,5đ
Tài liệu đính kèm:
 DE_KIEM_TRA_HOA_10BAI_SO_2.doc
DE_KIEM_TRA_HOA_10BAI_SO_2.doc





