Kiểm tra 1 tiết - Lần 3 - Hóa học 10
Bạn đang xem tài liệu "Kiểm tra 1 tiết - Lần 3 - Hóa học 10", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
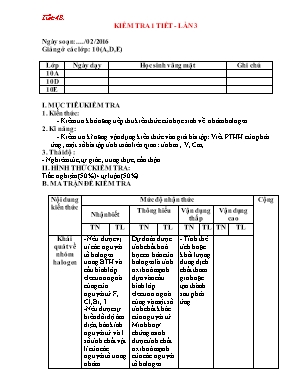
Tiết 48 . KIỂM TRA 1 TIẾT - LẦN 3 Ngày soạn: ..../ 02/2016 Giảng ở các lớp: 10(A,D,E) Lớp Ngày dạy Học sinh vắng mặt Ghi chú 10A 10D 10E I. MỤC TIÊU KIỂM TRA 1. Kiến thức: - Kiểm tra khả năng tiếp thu kiến thức của học sinh về nhóm halogen. 2. Kĩ năng: - Kiểm tra kĩ năng vận dụng kiến thức vào giải bài tập: Viết PTHH của phản ứng , một số bài tập tính toán liên qian : tính m , V, Cm, 3. Thái độ : - Nghiêm túc, tự giác , trung thực, cẩn thận. II. HÌNH THỨC KIỂM TRA: Trắc nghiệm (50%)+ tự luận(50%) B. MA TRẬN ĐỀ KIỂM TRA Nội dung kiến thức Mức độ nhận thức Cộng Nhận biết Thông hiểu Vận dụng thấp Vận dụng cao TN TL TN TL TN TL TN TL Khái quát về nhóm halogen - Nêu được vị trí các nguyên tố halogen trong BTH và cấu hình lớp electron ngoài cùng của nguyên tử F, Cl, Br, I. -Nêu được sự biến đổi độ âm điện, bán kính nguyên tử và 1 số tính chất vật lí của các nguyên tố trong nhóm -Nêu được tính chất hoá học cơ bản của các nguyên tố halogen là tính oxi hoá mạnh -Nêu được sự biến đổi tính chất hoá học của các đơn chất trong nhóm halogen Dự đoán được tính chất hoá học cơ bản của halogen là tính oxi hoá mạnh dựa vào cấu hình lớp electron ngoài cùng và một số tính chất khác của nguyên tử. Minh hoạ/ chứng minh được tính chất oxi hoá mạnh của các nguyên tố halogen bằng các PTHH, quy luật biến đổi tính chất của các nguyên tố trong nhóm - Tính thể tích hoặc khối lượng dung dịch chất tham gia hoặc tạo thành sau phản ứng Số câu 2 Số điểm 1đ Clo và hợp chất của clo -Nêu được tính chất vật lí, trạng thái tự nhiên, ứng dụng phương pháp điều chế clo và hidroclorua trong PTN và trong công nghiệp - Nêu được tính chất ứng dụng của một số muối clorua, phản ứng đặc trưng của ion clorua - nêu được dung dịch HCl là một axit mạnh có tính khử Nêu được các công thức hoá học các hợp chất có oxi của clo, số oxi hoá của clo trong các hợp chất đó, nêu được tính oxi hoá mạnh của nước Gia – Ven, clorua vôi và giải thích - Nêu được một số ứng dụng quan trọng của nước Gia Ven, clorua vôi - Nêu tóm tắt nguyên tắc và phương pháp sản xuất một số hợp chất có oxi của clo, viết được các PTHH minh hoạ(nếu có) - Mô tả được các hiện tượng thí nghiệm liên quan đến Clo và hợp chất Minh hoạ/ chứng minh được tính chất hoá học của Clo và axit HCl, các hợp chất chứa oxi của clo(nước Gia Ven, clorua vôi) bằng các PTHH Lựa chọn được hoá chất để tiến hành thí nghiệm chứng minh tính chất hoá học của clo và HCl Giải thích hiện tượng thí nghiệm về tính chất hoá học của clo và hợp chất Dự đoán tính chất hoá học, kiểm tra dự đoán bằng thí nghiệm và rút ra kết luận về tính chất hoá học của clo và HCl Tính thể tích thể tích khí ở đktc tham gia hoặc tạo thành trong phản ứng Phân biệt dung dịch HCl và muối clorua với dung dịch axit và muối khác - Tính nồng độ hoặc thể tích dung dịch axit HCl tham gia hoặc tạo thành trong phản ứng Vận dụng giải bài tập: phân biệt các chất/ dung dịch, tính % khối lượng hoặc thể tích trong hỗn hợp tính nồng độ hoặc thể tích dung dịch. Tính khối lượng nguyên liệu và sản phẩm sử dụng được nước Gia Ven, clorua vôi trong thực tế. Sử dụng dụng cụ hoá chất để tiến hành an toàn, thành công các thí nghiệm liên quan đến clo và hợp chất Vận dụng đề xuất biện pháp khử chất thải độc hại Sử dụng có hiệu quả an toàn nước Gia Ven, clorua vôi trong thực tế Giải thích một số hiện tượng thực tiễn có liên quan đến clo và hợp chất của clo Số câu 1 2 1 1 2 Số điểm 1đ 1đ 2đ 2đ 1đ 3. Flo, Brom, Iot Nêu được sơ lược về tính chất vật lí, trạng thái tự nhiên, ứng dụng điều chế flo, brom, iot Mô tả hiện tượng thí nghiệm liên quan đến flo, brom và iot Minh hoạ/ chứng minh được tính chất hoá học của flo, brom, iot là tính oxi hoá, flo có tính oxi hoá mạnh nhất, nguyên nhân tính oxi hoá giảm dần từ flo đến iot Lựa chọn được hoá chất để tiến hành thí nghiệm chứng minh tính chất của flo, brom và iot Giải thích hiện tượng thí nghiệm về tính chất hoá học của flo, brom và iot Tính toán lượng chất( khối lượng dung dịch) trong phản ứng Tính % chất trong hỗn hợp Phân biệt một số dung dịch Sử dụng dụng cụ và hoá chất tiến hành an toàn thành công các thí nghiệm liên quan đến flo, brom và iot Vận dụng đề xuất biện pháp khử chất thải độc hại Số câu 4 Số điểm 2đ Tổng số câu 6 1 2 1 1 2 Tổng số điểm 3đ 1đ 1đ 2đ 2đ 1đ 10đ Tỉ lệ 40% 30% 20% 10% 100% IV. ĐỀ KIỂM TRA: KIỂM TRA 1 TIẾT (BÀI SỐ 3) Môn : Hóa học ( Thời gian : 45 phút) Họ và tên :. Lớp : A.TRẮC NGHIỆM (5 điểm)( Khoanh tròn vào đáp án đúng) Câu 1: Các nguyên tố nhóm halogen đều có cấu hình electron lớp ngoài cùng là: A. ns1np6 B. ns2np5 C. ns3np4 D. ns2np4 Câu 2: Dãy nào thể hiện tính oxi hoá các halogen giảm dần ? A. Br2 > Cl2 > F2 > I2 . B. F2 > Cl2 > Br2 >I2 . C. I2 > Br2 > Cl2 > F2 . D. Cl2 > F2 > Br2 > I2 Câu 3: Chất nào sau đây được ứng dụng dùng để tráng phim ảnh? A. HBr. B. AgBr. C. AgCl. D. NaBr. Câu 4: Dãy nào sau đây sắp xếp đúng theo thứ tự giảm dần tính axit của các dung dịch hiđro halogenua? A. HCl > HBr > HI > HF B. HI > HBr > HCl > HF C. HF > HCl > HBr > HI D. HCl > HBr > HF > HI Câu 5: Thuốc thử để nhận ra iot là: A. phenolphthalein. B. nước brom. C. hồ tinh bột. D. Quì tím. Câu 6: Axit không thể đựng trong bình thủy tinh là: A. HNO3 B. HCl. C. H2SO4. D. HF. Câu 7: Phản ứng nào chứng tỏ HCl là chất khử? A. NH3+ HCl NH4Cl. B. HCl + NaOH NaCl + H2O. C. 2HCl + Mg MgCl2+ H2 . D. MnO2+ 4 HCl MnCl2+ Cl2 + 2H2O. Câu 8: Khi mở vòi nước máy, nếu chú ý một chút sẽ phát hiện mùi lạ. Đó là do nước máy còn lưu giữ vết tích của thuốc sát trùng. Đó chính là clo và người ta giải thích khả năng diệt khuẩn là do: A. Clo tác dụng với nước tạo ra HClO chất này có tính oxi hóa mạnh. B. Một nguyên nhân khác. C. Clo độc nên có tính sát trùng. D. Clo có tính oxi hóa mạnh. Câu 9. Cho phản ứng: SO2 + Cl2 + 2H2O 2HCl + H2SO4. Clo là chất: A oxi hóa. B. khử. C. vừa oxi hóa, vừa khử. D. Không oxi hóa khử Câu 10: Hòa tan hoàn toàn 6,72 gam một kim loại M bằng dung dịch HCl dư, thu được 2,688 lít khí (đktc). Điều khẳng định sau đây là đúng? A. M là Fe; khối lượng muối khan là 10,98 gam B. M là Al; khối lượng muối khan là 10,98 gam C. M là Fe; khối lượng muối khan là 15,24 gam D. M là Zn; khối lượng muối khan là 15,24 gam B. TỰ LUẬN Câu1 ( 1đ): Nhận biết các dung dịch sau bằng phương pháp hóa học ( Viết các phương trình phản ứng xảy ra nếu có) : HCl , NaOH , NaNO3 , NaCl Câu2 ( 2đ): Viết PTHH thực hiện sơ đồ chuyển hóa sau (ghi đầy đủ điều kiện nếu có) MnO2 Cl2 HCl FeCl2 AgCl Câu 3 ( 2đ) : Hòa tan hoàn toàn 5,65 gam hỗn hợp Mg và Zn vào dung dịch HCl 2M thu được 3,36 lít khí (đktc). Tính phần trăm theo khối lượng mỗi kim loại trong hỗn hợp ban đầu. Tính thể tích dung dịch HCl 2M đã dùng. V. ĐÁP ÁN VÀ HƯỚNG DẪN CHẤM A. TRẮC NGHIỆM (19 câu * 0,5điểm = 5 điểm) Câu 1 2 3 4 5 6 7 8 9 10 ĐA B B B B C D D A A C B. TỰ LUẬN (5điểm) Câu Nội dung Điểm 1 Thuốc thử HCl NaOH NaNO3 NaCl Qùi tím Đỏ Xanh - - DD AgNO3 - - - k.t trắng Ptpư: NaCl + AgNO3 AgCl + NaNO3 0,75đ 0,25đ 2 Mỗi pt đúng 0,5đ, thiếu cân bằng/điều kiện trừ nửa số điểm. 2đ 3 a. Phương trình phản ứng : Mg + 2HCl MgCl2 + H2 (1) x 2x x (mol) Zn + 2HCl ZnCl2 + H2 (2) y 2y y (mol) Gọi x, y là số mol của Fe và Cu Số mol : nH2 Ta có hệ phương trình sau : Vậy phần trăm khối lượng của mỗi kim loại trong hợp kim là : %Zn = 100 – 42,47=57,53% b. Theo pt ( 1 , 2) Vậy thể tích dung dịch HCl 2M đã dùng là: 0,25đ 0,25đ 0,25đ 0,25đ 0,5đ 0,5đ V.RÚT KINH NGHIỆM: ........................................................................................................................................................................................................................................................................ ........................................................................................................................................................................................................................................................................
Tài liệu đính kèm:
 Kiem_tra_1_tiet_HH_10_Bai_so_3.doc
Kiem_tra_1_tiet_HH_10_Bai_so_3.doc





