Đề thi học kì I môn: Hóa học, lớp 9 trường TH&THCS số 2 Trà Phong
Bạn đang xem tài liệu "Đề thi học kì I môn: Hóa học, lớp 9 trường TH&THCS số 2 Trà Phong", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
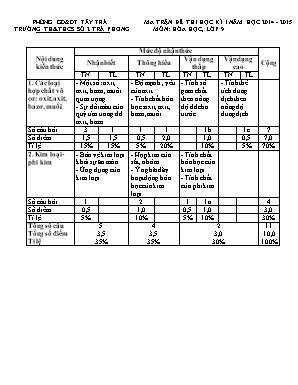
PHÒNG GD&ĐT TÂY TRÀ TRƯỜNG TH&THCS SỐ 2 TRÀ PHONG MA TRẬN ĐỀ THI HỌC KÌ I NĂM HỌC 2014 - 2015 MÔN: HÓA HỌC, LỚP 9 Nội dung kiến thức Mức độ nhận thức Cộng Nhận biết Thông hiểu Vận dụng thấp Vận dụng cao TN TL TN TL TN TL TN TL 1. Các loại hợp chất vô cơ: oxit, axit, bazơ, muối. - Một số: oxit, axit, bazơ, muối quan trọng - Sự đổi màu của quỳ tím trong dd axit, bazơ. - Độ mạnh , yếu của axit - Tính chất hóa học: oxit, axit, bazơ, muối. - Tính số gam chất theo nồng độ dd cho trước. - Tính thể tích dung dịch theo nồng độ dung dịch. Số câu hỏi 3 1 1 1 1b 1c 7 Số điểm 1,5 1,5 0,5 2,0 1,0 0,5 7,0 Tỉ lệ 15% 15% 5% 20% 10% 5% 70% 2. Kim loại - phi kim - Bảo vệ kim loại khỏi sự ăn mòn. - Ứng dụng của kim loại. - Hợp kim của sắt, nhôm. - Ý nghĩa dãy hoạt động hóa học của kim loại. - Tính chất hóa học của kim loại. - Tính chất của phi kim. Số câu hỏi 1 2 1 1a 4 Số điểm 0,5 1,0 0,5 1,0 3,0 Tỉ lệ 5% 10% 5% 10% 30% Tổng số câu Tổng số điểm Tỉ lệ 5 3,5 35% 4 3,5 35% 2 3,0 30% 11 10,0 100% PHÒNG GD&ĐT TÂY TRÀ TRƯỜNG TH&THCS SỐ 2 TRÀ PHONG ĐỀ THI HỌC KÌ I NĂM HỌC 2014 - 2015 MÔN: HÓA HỌC, LỚP 9 Thời gian: 45 phút (không kể thời gian phát đề) (Đề thi gồm có 01 trang) I /TRẮC NGHIỆM KHÁCH QUAN (4,0 điểm) Hãy khoanh tròn vào một trong các chữ cái A, B, C, D trước phương án chọn đúng: Câu 1: Oxit nào sau đây là oxit bazơ ? A. CaO B. CO2 C. P2O5 D. NO Câu 2: Trong phản ứng hóa học phân hủy Cu(OH)2 thu được chất rắn là A. Cu B. CuO C. Cu2O D. Cu(OH)2 Câu 3: Dung dịch axit làm quỳ tím chuyển sang màu A. xanh. B. đỏ C. vàng D. không đổi màu Câu 4: Cho các công thức oxit: Fe2O3 , MgO, K2O. Dãy bazơ tương ứng nào biểu diễn đúng công thức: A. Fe(OH)2 , MgOH , K(OH)2 B. Fe(OH)3 , MgOH , KOH C. Fe(OH)3 , Mg(OH)2 , KOH D. FeOH , Mg(OH)2 , KOH Câu 5: Ngâm đinh sắt trong dd CuSO4 A. Đồng bám vào đinh sắt, đinh sắt nguyên vẹn B. Không có hiện tượng gì C. Đồng bám vào đinh sắt, đinh sắt bị hoà tan một phần, màu xanh lam dd nhạt dần. D. Chỉ đinh sắt tan, không có chất mới sinh ra. Câu 6: Loại phản ứng hóa học nào xảy ra theo điều kiện: Hai chất phản ứng đều tan, sản phẩm có chất không tan. A. phản ứng thế B. phản ứng cộng C. phản ứng trao đổi D. phản ứng phân hủy Câu 7: Nước tinh khiết có pH là A. pH >7 B. pH < 7 C. pH = 7 D. cả A, B Câu 8: Dãy các kim loại nào sau đây được xếp theo thứ tự tăng dần mức độ hoạt động hóa học A. K, Mg, Cu, Zn, Fe, Al B. Fe, Cu, K, Mg, Al, Zn C. Zn, K, Mg, Cu, Al, Fe D. Cu, Fe, Zn, Al, Mg, K II . TỰ LUẬN (6 điểm) Câu 1: (2,0 điểm) Hoàn thành chuỗi phản ứng hóa học sau bằng các phản ứng hóa học: Fe2O3 Fe FeCl3 Fe(OH)3 Fe2O3 Câu 2: (1,5 điểm) Dùng phương pháp hóa học nhận biết các dung dịch mất nhãn sau: NaOH, H2SO4 , Na2SO4 , HCl. Viết các phương trình hóa học xảy ra (nếu có). Câu 3: (2,5 điểm) Cho 15,5gam hỗn hợp 2 kim loại Cu, Zn vào dung dịch H2SO4 loãng dư, người ta thu được 2,24 lit khí (đktc). a. Viết phương trình hóa học b. Tính khối lượng chất rắn còn lại trong dung dịch. c. Tính thể tích dung dịch H2SO4 20% (D= 1,14 g/ml) để tác dụng hết kim loại trên. (Cu = 64; Zn = 65; S = 32; O = 16 ; H = 1) --------------------Hết------------------- (Cán bộ coi thi không giải thích gì thêm) PHÒNG GD&ĐT TÂY TRÀ TRƯỜNG TH&THCS SỐ 2 TRÀ PHONG ĐÁP ÁN ĐỀ THI HK I NĂM HỌC 2014 - 2015 MÔN: HÓA HỌC, LỚP 9 (Đáp án gồm có 01 trang) I. TRẮC NGHIỆM KHÁCH QUAN (4,0 điểm) (Mỗi đáp án đúng 0,5 điểm) Câu 1 2 3 4 5 6 7 8 Đáp án A B B C C C C D II. TỰ LUẬN (6,0 điểm) TT Câu Ý Nội dung Số điểm 1 1 Fe2O3 + 3CO 2 Fe + 3CO2 2Fe + 3Cl2 2 FeCl3 FeCl3 + 3 NaOH Fe(OH)3 + 3NaCl 2Fe(OH)3 Fe2O3 + 3H2O 0,5 điểm 0,5 điểm 0,5 điểm 0,5 điểm 2 2 - Dùng quỳ tím nhận ra:NaOH (quỳ tím hóa xanh), Na2SO4 (quỳ tím không đổi màu), HCl, H2SO4(quỳ tím hóa đỏ) - Dùng dd BaCl2 nhận ra H2SO4 có kết tủa trắng. - Phương trình hóa học. - Còn lại HCl. 0,5 điểm 0,5 điểm 0,5 điểm 3 3 a Chỉ Zn phản ứng Số mol khí hidro thoát ra: n2 = = 0,1(mol) PTHH: Zn + H2SO4 ZnSO4 + H2 0,1 mol 0,1 mol 0,1 mol 0,25 điểm 0,25 điểm b Số gam Zn phản ứng : mZn = 0,1 x 65 = 6,5 (g) Số gam Cu (chất rắn) còn trong dung dịch: mCu = 15,5 – 6,5 = 9 (g) 0,5 điểm 0,5 điểm c Số gam H2SO4 phản ứng: mH2SO4 = 0,1 x 98 = 9,8 (g) Số gam dd H2SO4 : mdd H2SO4 = = 49 (g) Thể tích dung dịch H2SO4 20%: V == 42,98 (ml) 0,25 điểm 0,5 điểm 0,25 điểm
Tài liệu đính kèm:
 DE_KIEM_TRA_HK_I_HOA_9.doc
DE_KIEM_TRA_HK_I_HOA_9.doc





