Đề thi học kì I môn: Hóa học 9 - Trường THCS Nam Thắng
Bạn đang xem tài liệu "Đề thi học kì I môn: Hóa học 9 - Trường THCS Nam Thắng", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
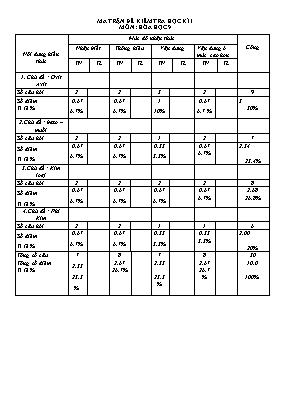
Nội dung kiến thức Mức độ nhận thức Cộng Nhận biết Thông hiểu Vận dụng Vận dụng ở mức cao hơn TN TL TN TL TN TL TN TL 1. Chủ đề : Oxit Axit Số câu hỏi 2 2 3 2 9 Số điểm Tỉ lệ % 0,67 6,7% 0,67 6,7% 1 10% 0,67 6,7 % 3 30% 2.Chủ đề : bazo – muối Số câu hỏi 2 2 1 2 7 Số điểm Tỉ lệ % 0,67 6,7% 0,67 6,7% 0,33 3,3% 0,67 6,7% 2,34 23,4% 3.Chủ đề : Kim loại Số câu hỏi 2 2 2 2 8 Số điểm Tỉ lệ % 0,67 6,7% 0,67 6,7% 0,67 6,7% 0,67 6,7% 2,68 26,8% 4.Chủ đề : Phi Kim Số câu hỏi 2 2 1 1 6 Số điểm Tỉ lệ % 0,67 6,7% 0,67 6,7% 0,33 3,3% 0,33 3,3% 2,00 20% Tổng số câu Tổng số điểm Tỉ lệ % 7 2,33 23,3% 8 2,67 26,7% 7 2,33 23,3% 8 2,67 26,7% 30 10,0 100% MA TRẬN ĐỀ KIỂM TRA HỌC KÌ I MÔN : HÓA HỌC 9 PHÒNG GIÁO DỤC VÀ ĐÀO TẠO TIỀN HẢI TRƯỜNG THCS NAM THẮNG ĐỀ THI HỌC KÌ I Môn : hóa học 9 Thời gian làm bài: 45 phút; (30 câu trắc nghiệm) Mã đề thi 132 Họ, tên thí sinh:.....................................................................Lớp: ............................. Câu 1: Cặp chất nào sau đây phản ứng với nhau tạo kết tủa trắng ? A. KCl và AgNO3 B. BaCl2 và H2SO4 C. MgSO4 và KOH D. cả A,B,C Câu 2: Cho những cặp chất sau đây:1/ K2O và CO2 2/ CO và K2O 3/ K2O và H2O 4/ KOH và CO2 5/ CaO và SO3 6/ P2O5 và H2O 7/ Fe2O3 và H2O 8/ CuO và SO2 . Những cặp chất nào tác dụng được với nhau: A. 1,2,3,4,5 B. 1,3,5,7,8 C. 3,4,5,7,8 D. 1,3,4,5,6 Câu 3: Ngâm 16,6 gam hỗn hợp bột các Al và Fe trong dung dịch HCl dư, thu được 11,2 lít khí H2 (đktc). Phần trăm khối lượng của Al và Fe trong hỗn hợp lần lượt trong hỗn hợp là: A. 30% và 70% B. 32,5% và 67,5% C. 40% và 60% D. 50% và 50% Câu 4: Chất tác dụng với nước tạo ra dung dịch bazơ là: A. CO2 B. Na2O C. SO2 D. P2O5 Câu 5: Muối đồng (II) sunfat (CuSO4) có thể phản ứng với dãy chất: A. CO2, NaOH, H2SO4,Fe B. H2SO4, AgNO3, Ca(OH)2, Al C. .NaOH, BaCl2, Fe, H2SO4 D. NaOH, BaCl2, Fe, Al Câu 6: Hãy hoàn thành đoạn sau: (1)và (2) đều là hợp kim của sắt với cacbon và một số nguyên tố khác nhưng trong gang cacbon chiếm từ (3), còn trong thép hàm lượng cacbon (4). Các số 1;2;3;4 lần lượt là: A. gang; thép; 2-5%; dưới 2%. B. gang; thép; 2-5%; trên 2%. C. gang; thép; 3-6%; dưới 2%. D. gang; thép; dưới 2%; trên 2%. Câu 7: Để so sánh mức độ hoạt động mạnh, yếu của phi kim thường được xem xét qua khả năng phản ứng của phi kim đó với A. hiđro hoặc với kim loại. B. dung dịch kiềm. C. dung dịch axit. D. dung dịch muối Câu 8: Các dạng thù hình của cacbon là A. than chì, cacbon vô định hình, vôi sống. B. than chì, kim cương, canxi cacbonat. C. cacbon vô định hình, kim cương, canxi cacbonat. D. kim cương, than chì, cacbon vô định hình. Câu 9: Cho 5,4g bột nhôm vào dung dịch bạc nitrat dư. Sau phản ứng thu được bao nhiêu gam kết tủa bạc ? A. 648g. B. 6,48g C. 64,8g D. 0, 648g Câu 10: Dãy các chất đều phản ứng với dung dịch HCl là: A. NaOH, Al, CuSO4, CuO B. Cu(OH)2, Cu, CuO, Fe C. CaO, Al2O3, Na2SO3, H2SO3 D. Al, CaCO3, Cu(OH)2, Fe, CaO, Al2O3 Câu 11: Cho bản sắt có khối lượng 50g vào dung dịch đồng sunfat. Sau một thời gian nhấc bản sắt ra và đem cân thì thấy khối lượng bản sắt là 52g. Biết rằng đồng sinh ra bám trên bề mặt của bản sắt. Số mol muối sắt tạo thành sau phản ứng là: A. 1,25 mol. B. 2,5 mol. C. 0.125 mol. D. 0,25 mol. Câu 12: Hoà tan 2,4 gam một oxit kim loại hoá trị II cần dùng 30 gam dung dịch HCl 7,3 %. Công thức của oxit kim loại là: A. CaO B. CuO C. FeO D. ZnO Câu 13: Các chất là oxit lưỡng tính? A. Mn2O7, NO B. Al2O3, ZnO C. Al2O3, CO D. ZnO, Fe2O3 Câu 14: Câu29. Trộn dung dịch có chứa 0,1mol CuSO4 và một dung dịch chứa 0,3 mol NaOH, lọc kết tủa, rửa sạch rồi đem nung đến khối lượng không đổi thu được m g chất rắn. Giá trị m là: A. 8 g B. 4 g C. 6 g D. 12 g Câu 15: Dãy chất nào đều bị nhiệt phân hủy : A. NaOH, Cu(OH)2, CaCO3, Fe(OH)3 B. KOH, Mg(OH)2, CaCO3, Al(OH)3 C. Mg(OH)2 , Cu(OH)2, CaCO3, Fe(OH)3 D. NaOH, Ca(OH)2, CaCO3, Fe(OH)3 Câu 16: Các Cặp chất nào sau đây không xảy ra phản ứng ? 1.CaCl2+Na2CO3 2. CaCO3+NaCl 3. NaOH+HCl 4.NaOH+KCl A. 1 và 2 B. 2 và 3 C. 3và 4 D. 2 và 4 Câu 17: Cho 20 gam hỗn hợp X gồm CuO và Fe2O3 tác dụng vừa đủ với 0,2 lít dung dịch HCl có nồng độ 3,5M. Thành phần phần trăm theo khối lượng của CuO và Fe2O3 trong hỗn hợp X lần lượt là: A. 25 % và 75 % B. 20 % và 80 % C. 22 % và 78 % D. 30 % và 70 % Câu 18: Cách làm nào sau đây không giúp cho việc bảo vệ kim loại khỏi bị ăn mòn? A. thả đinh sắt trong nước có hoà tan khí oxi. B. bôi dầu mỡ vào cuốc, xẻng. C. thêm vào thép một số kim loại như crom, niken. D. rửa sạch và lau khô dao làm bằng thép sau khi sử dụng. Câu 19: Cho 10 hỗn hợp gồm nhôm và đồng vào dung dịch HCl dư thu được 6,72 lít khí (đktc). Khối lượng của Cu trong hỗn hợp là A. 5,4 gam. B. 2,4 gam. C. 4,6 gam. D. 5 gam. Câu 20: Dãy chất nào đều tác dụng với nhôm: A. Cl2, O2, HCl, CuSO4, NaOH B. Cl2, O2, HNO3đ nguội , CuSO4, NaOH C. Cl2, O2,H2SO4đ nguội , CuSO4, NaOH D. Cl2, O2, HCl, MgSO4, NaOH Câu 21: Nhóm chất nào sau đây gồm các khí đều cháy được ? A. CO, CO2. B. CO, H2. C. CO2, O2. D. Cl2, CO2. Câu 22: Cho 21 gam MgCO3 tác dụng với một lượng vừa đủ dung dịch HCl 2M.Thể tích dung dịch HCl đã dùng là: Câu 23: Thuốc thử dùng để nhận biết 4 chất: HNO3, Ba(OH)2, NaCl, NaNO3 đựng riêng biệt trong các lọ mất nhãn là A. Dùng quì tím và dd Ba(NO3)2. B. Dùng dd phenolphtalein và dd AgNO3. C. Dùng quì tím và dung dịch AgNO3 . D. Dùng dd phenolphtalein và dd Ba(NO3 )2. Câu 24: Để phân biệt được kim loại nhôm với sắt, có thể sử dụng A. dung dịch kiềm. B. dung dịch muối magie. C. dung dịch muối kẽm. D. dung dịch axit sunfuric Câu 25: Đốt cháy 11,2 lít CO (đktc). Thể tích không khí cần cho phản ứng trên là (= Vkk) A. 21,4 lít. B. 24 lít. C. 26 lít. D. 28 lít. Câu 26: Dung dịch KOH phản ứng với dãy oxit: A. . CO2; SO2; P2O5; Fe2O3 B. Fe2O3; SO2; SO3; MgO C. P2O5; CO2; Al2O3 ; SO3 D. P2O5 ; CO2; CuO; SO3 Câu 27: Clo tác dụng với natri hiđroxit A. tạo thành muối natri clorua và nước. B. tạo thành nước javen. C. tạo thành hỗn hợp các axit. D. tạo thành muối natri hipoclorit và nước. Câu 28: Dãy kim loại nào sau đây có mức độ hoạt động hoá học tăng dần: A. Na, Al, Fe, Mg, Zn B. Mg, Na, Fe, Zn, Al C. Na, Mg, Al, Zn, Fe D. Fe, Zn, Al, Mg, Na. Câu 29: Đốt sắt trong khí oxi thu được oxit sắt từ. Công thức hóa học của oxit sắt từ là: A. FeO. B. Fe2O3. C. Fe3O4. D. Fe(OH)2. Câu 30: Kim loại nào sau đây có tính dẫn điện tốt nhất? A. Đồng B. Nhôm C. Sắt D. Bạc ----------------------------------------------- ----------- HẾT ---------- PHÒNG GIÁO DỤC & ĐÀO TẠO TIỀN HẢI TRƯỜNG THCS NAM THẮNG ĐỀ THI HỌC KÌ I Môn : hóa học 9 Thời gian làm bài: 45 phút; (30 câu trắc nghiệm) Mã đề thi 209 Họ, tên thí sinh:.....................................................................Lớp: ............................. Câu 1: Kim loại nào sau đây có tính dẫn điện tốt nhất? A. Đồng B. Nhôm C. Sắt D. Bạc Câu 2: Cho bản sắt có khối lượng 50g vào dung dịch đồng sunfat. Sau một thời gian nhấc bản sắt ra và đem cân thì thấy khối lượng bản sắt là 52g. Biết rằng đồng sinh ra bám trên bề mặt của bản sắt. Số mol muối sắt tạo thành sau phản ứng là: A. 1,25 mol. B. 2,5 mol. C. 0.125 mol. D. 0,25 mol. Câu 3: Hãy hoàn thành đoạn sau: (1)và (2) đều là hợp kim của sắt với cacbon và một số nguyên tố khác nhưng trong gang cacbon chiếm từ (3), còn trong thép hàm lượng cacbon (4). Các số 1;2;3;4 lần lượt là: A. gang; thép; 2-5%; dưới 2%. B. gang; thép; 2-5%; trên 2%. C. gang; thép; 3-6%; dưới 2%. D. gang; thép; dưới 2%; trên 2%. Câu 4: Nhóm chất nào sau đây gồm các khí đều cháy được ? A. CO, CO2. B. CO, H2. C. CO2, O2. D. Cl2, CO2. Câu 5: Cho 21 gam MgCO3 tác dụng với một lượng vừa đủ dung dịch HCl 2M.Thể tích dung dịch HCl đã dùng là: Câu 6: Các dạng thù hình của cacbon là A. than chì, cacbon vô định hình, vôi sống. B. than chì, kim cương, canxi cacbonat. C. cacbon vô định hình, kim cương, canxi cacbonat. D. kim cương, than chì, cacbon vô định hình. Câu 7: Dung dịch KOH phản ứng với dãy oxit: A. . CO2; SO2; P2O5; Fe2O3 B. Fe2O3; SO2; SO3; MgO C. P2O5; CO2; Al2O3 ; SO3 D. P2O5 ; CO2; CuO; SO3 Câu 8: Cách làm nào sau đây không giúp cho việc bảo vệ kim loại khỏi bị ăn mòn? A. thả đinh sắt trong nước có hoà tan khí oxi. B. bôi dầu mỡ vào cuốc, xẻng. C. thêm vào thép một số kim loại như crom, niken. D. rửa sạch và lau khô dao làm bằng thép sau khi sử dụng. Câu 9: Để so sánh mức độ hoạt động mạnh, yếu của phi kim thường được xem xét qua khả năng phản ứng của phi kim đó với A. hiđro hoặc với kim loại. B. dung dịch kiềm. C. dung dịch axit. D. dung dịch muối Câu 10: Dãy chất nào đều tác dụng với nhôm: A. Cl2, O2, HCl, CuSO4, NaOH B. Cl2, O2, HNO3đ nguội , CuSO4, NaOH C. Cl2, O2,H2SO4đ nguội , CuSO4, NaOH D. Cl2, O2, HCl, MgSO4, NaOH Câu 11: Cho 5,4g bột nhôm vào dung dịch bạc nitrat dư. Sau phản ứng thu được bao nhiêu gam kết tủa bạc ? A. 648g. B. 6,48g C. 64,8g D. 0, 648g Câu 12: Đốt sắt trong khí oxi thu được oxit sắt từ. Công thức hóa học của oxit sắt từ là: A. FeO. B. Fe2O3. C. Fe3O4. D. Fe(OH)2. Câu 13: Đốt cháy 11,2 lít CO (đktc). Thể tích không khí cần cho phản ứng trên là (= Vkk) A. 21,4 lít. B. 24 lít. C. 26 lít. D. 28 lít. Câu 14: Các chất là oxit lưỡng tính? A. Mn2O7, NO B. Al2O3, ZnO C. Al2O3, CO D. ZnO, Fe2O3 Câu 15: Muối đồng (II) sunfat (CuSO4) có thể phản ứng với dãy chất: A. CO2, NaOH, H2SO4,Fe B. H2SO4, AgNO3, Ca(OH)2, Al C. .NaOH, BaCl2, Fe, H2SO4 D. NaOH, BaCl2, Fe, Al Câu 16: Cho 20 gam hỗn hợp X gồm CuO và Fe2O3 tác dụng vừa đủ với 0,2 lít dung dịch HCl có nồng độ 3,5M. Thành phần phần trăm theo khối lượng của CuO và Fe2O3 trong hỗn hợp X lần lượt là: A. 25 % và 75 % B. 20 % và 80 % C. 22 % và 78 % D. 30 % và 70 % Câu 17: Chất tác dụng với nước tạo ra dung dịch bazơ là: A. CO2 B. Na2O C. SO2 D. P2O5 Câu 18: Hoà tan 2,4 gam một oxit kim loại hoá trị II cần dùng 30 gam dung dịch HCl 7,3 %. Công thức của oxit kim loại là: A. CaO B. CuO C. FeO D. ZnO Câu 19: Dãy kim loại nào sau đây có mức độ hoạt động hoá học tăng dần: A. Na, Al, Fe, Mg, Zn B. Mg, Na, Fe, Zn, Al C. Na, Mg, Al, Zn, Fe D. Fe, Zn, Al, Mg, Na. Câu 20: Cho 10 hỗn hợp gồm nhôm và đồng vào dung dịch HCl dư thu được 6,72 lít khí (đktc). Khối lượng của Cu trong hỗn hợp là A. 5,4 gam. B. 2,4 gam. C. 4,6 gam. D. 5 gam. Câu 21: Cho những cặp chất sau đây:1/ K2O và CO2 2/ CO và K2O 3/ K2O và H2O 4/ KOH và CO2 5/ CaO và SO3 6/ P2O5 và H2O 7/ Fe2O3 và H2O 8/ CuO và SO2 . Những cặp chất nào tác dụng được với nhau: A. 1,2,3,4,5 B. 1,3,5,7,8 C. 3,4,5,7,8 D. 1,3,4,5,6 Câu 22: Để phân biệt được kim loại nhôm với sắt, có thể sử dụng A. dung dịch kiềm. B. dung dịch muối magie. C. dung dịch muối kẽm. D. dung dịch axit sunfuric Câu 23: Clo tác dụng với natri hiđroxit A. tạo thành muối natri clorua và nước. B. tạo thành nước javen. C. tạo thành hỗn hợp các axit. D. tạo thành muối natri hipoclorit và nước. Câu 24: Dãy chất nào đều bị nhiệt phân hủy : A. NaOH, Cu(OH)2, CaCO3, Fe(OH)3 B. KOH, Mg(OH)2, CaCO3, Al(OH)3 C. Mg(OH)2 , Cu(OH)2, CaCO3, Fe(OH)3 D. NaOH, Ca(OH)2, CaCO3, Fe(OH)3 Câu 25: Ngâm 16,6 gam hỗn hợp bột các Al và Fe trong dung dịch HCl dư, thu được 11,2 lít khí H2 (đktc). Phần trăm khối lượng của Al và Fe trong hỗn hợp lần lượt trong hỗn hợp là: A. 30% và 70% B. 32,5% và 67,5% C. 40% và 60% D. 50% và 50% Câu 26: Thuốc thử dùng để nhận biết 4 chất: HNO3, Ba(OH)2, NaCl, NaNO3 đựng riêng biệt trong các lọ mất nhãn là A. Dùng quì tím và dd Ba(NO3)2. B. Dùng dd phenolphtalein và dd AgNO3. C. Dùng quì tím và dung dịch AgNO3 . D. Dùng dd phenolphtalein và dd Ba(NO3 )2. Câu 27: Câu29. Trộn dung dịch có chứa 0,1mol CuSO4 và một dung dịch chứa 0,3 mol NaOH, lọc kết tủa, rửa sạch rồi đem nung đến khối lượng không đổi thu được m g chất rắn. Giá trị m là: A. 8 g B. 4 g C. 6 g D. 12 g Câu 28: Cặp chất nào sau đây phản ứng với nhau tạo kết tủa trắng ? A. KCl và AgNO3 B. BaCl2 và H2SO4 C. MgSO4 và KOH D. cả A,B,C Câu 29: Các Cặp chất nào sau đây không xảy ra phản ứng ? 1.CaCl2+Na2CO3 2. CaCO3+NaCl 3. NaOH+HCl 4.NaOH+KCl A. 1 và 2 B. 2 và 3 C. 3và 4 D. 2 và 4 Câu 30: Dãy các chất đều phản ứng với dung dịch HCl là: A. NaOH, Al, CuSO4, CuO B. Cu(OH)2, Cu, CuO, Fe C. CaO, Al2O3, Na2SO3, H2SO3 D. Al, CaCO3, Cu(OH)2, Fe, CaO, Al2O3 ----------------------------------------------- PHÒNG GIÁO DỤC & ĐÀO TẠO TIỀN HẢI TRƯỜNG THCS NAM THẮNG ĐỀ THI HỌC KÌ I Môn : hóa học 9 Thời gian làm bài: 45 phút; (30 câu trắc nghiệm) Mã đề thi 357 Họ, tên thí sinh:.....................................................................Lớp : ............................. Câu 1: Dãy chất nào đều bị nhiệt phân hủy : A. NaOH, Cu(OH)2, CaCO3, Fe(OH)3 B. KOH, Mg(OH)2, CaCO3, Al(OH)3 C. Mg(OH)2 , Cu(OH)2, CaCO3, Fe(OH)3 D. NaOH, Ca(OH)2, CaCO3, Fe(OH)3 Câu 2: Trộn dung dịch có chứa 0,1mol CuSO4 và một dung dịch chứa 0,3 mol NaOH, lọc kết tủa, rửa sạch rồi đem nung đến khối lượng không đổi thu được m g chất rắn. Giá trị m là: A. 8 g B. 4 g C. 6 g D. 12 g Câu 3: Cho 21 gam MgCO3 tác dụng với một lượng vừa đủ dung dịch HCl 2M.Thể tích dung dịch HCl đã dùng là: Câu 4: Kim loại nào sau đây có tính dẫn điện tốt nhất? A. Đồng B. Nhôm C. Sắt D. Bạc Câu 5: Các dạng thù hình của cacbon là A. than chì, cacbon vô định hình, vôi sống. B. than chì, kim cương, canxi cacbonat. C. cacbon vô định hình, kim cương, canxi cacbonat. D. kim cương, than chì, cacbon vô định hình. Câu 6: Dung dịch KOH phản ứng với dãy oxit: A. . CO2; SO2; P2O5; Fe2O3 B. Fe2O3; SO2; SO3; MgO C. P2O5; CO2; Al2O3 ; SO3 D. P2O5 ; CO2; CuO; SO3 Câu 7: Đốt sắt trong khí oxi thu được oxit sắt từ. Công thức hóa học của oxit sắt từ là: A. FeO. B. Fe2O3. C. Fe3O4. D. Fe(OH)2. Câu 8: Nhóm chất nào sau đây gồm các khí đều cháy được ? A. CO, CO2. B. CO, H2. C. CO2, O2. D. Cl2, CO2. Câu 9: Dãy các chất đều phản ứng với dung dịch HCl là: A. NaOH, Al, CuSO4, CuO B. Cu(OH)2, Cu, CuO, Fe C. CaO, Al2O3, Na2SO3, H2SO3 D. Al, CaCO3, Cu(OH)2, Fe, CaO, Al2O3 Câu 10: Cho 20 gam hỗn hợp X gồm CuO và Fe2O3 tác dụng vừa đủ với 0,2 lít dung dịch HCl có nồng độ 3,5M. Thành phần phần trăm theo khối lượng của CuO và Fe2O3 trong hỗn hợp X lần lượt là: A. 25 % và 75 % B. 20 % và 80 % C. 22 % và 78 % D. 30 % và 70 % Câu 11: Chất tác dụng với nước tạo ra dung dịch bazơ là: A. CO2 B. Na2O C. SO2 D. P2O5 Câu 12: Đốt cháy 11,2 lít CO (đktc). Thể tích không khí cần cho phản ứng trên là (= Vkk) A. 21,4 lít. B. 24 lít. C. 26 lít. D. 28 lít. Câu 13: Hãy hoàn thành đoạn sau: (1)và (2) đều là hợp kim của sắt với cacbon và một số nguyên tố khác nhưng trong gang cacbon chiếm từ (3), còn trong thép hàm lượng cacbon (4). Các số 1;2;3;4 lần lượt là: A. gang; thép; 2-5%; dưới 2%. B. gang; thép; 2-5%; trên 2%. C. gang; thép; 3-6%; dưới 2%. D. gang; thép; dưới 2%; trên 2%. Câu 14: Muối đồng (II) sunfat (CuSO4) có thể phản ứng với dãy chất: A. CO2, NaOH, H2SO4,Fe B. H2SO4, AgNO3, Ca(OH)2, Al C. .NaOH, BaCl2, Fe, H2SO4 D. NaOH, BaCl2, Fe, Al Câu 15: Cho bản sắt có khối lượng 50g vào dung dịch đồng sunfat. Sau một thời gian nhấc bản sắt ra và đem cân thì thấy khối lượng bản sắt là 52g. Biết rằng đồng sinh ra bám trên bề mặt của bản sắt. Số mol muối sắt tạo thành sau phản ứng là: A. 1,25 mol. B. 2,5 mol. C. 0.125 mol. D. 0,25 mol. Câu 16: Các Cặp chất nào sau đây không xảy ra phản ứng ? 1.CaCl2+Na2CO3 2. CaCO3+NaCl 3. NaOH+HCl 4.NaOH+KCl A. 1 và 2 B. 2 và 3 C. 3và 4 D. 2 và 4 Câu 17: Hoà tan 2,4 gam một oxit kim loại hoá trị II cần dùng 30 gam dung dịch HCl 7,3 %. Công thức của oxit kim loại là: A. CaO B. CuO C. FeO D. ZnO Câu 18: Cho 5,4g bột nhôm vào dung dịch bạc nitrat dư. Sau phản ứng thu được bao nhiêu gam kết tủa bạc ? A. 648g. B. 6,48g C. 64,8g D. 0, 648g Câu 19: Dãy kim loại nào sau đây có mức độ hoạt động hoá học tăng dần: A. Na, Al, Fe, Mg, Zn B. Mg, Na, Fe, Zn, Al C. Na, Mg, Al, Zn, Fe D. Fe, Zn, Al, Mg, Na. Câu 20: Cho những cặp chất sau đây:1/ K2O và CO2 2/ CO và K2O 3/ K2O và H2O 4/ KOH và CO2 5/ CaO và SO3 6/ P2O5 và H2O 7/ Fe2O3 và H2O 8/ CuO và SO2 . Những cặp chất nào tác dụng được với nhau: A. 1,2,3,4,5 B. 1,3,5,7,8 C. 3,4,5,7,8 D. 1,3,4,5,6 Câu 21: Để phân biệt được kim loại nhôm với sắt, có thể sử dụng A. dung dịch kiềm. B. dung dịch muối magie. C. dung dịch muối kẽm. D. dung dịch axit sunfuric Câu 22: Clo tác dụng với natri hiđroxit A. tạo thành muối natri clorua và nước. B. tạo thành nước javen. C. tạo thành hỗn hợp các axit. D. tạo thành muối natri hipoclorit và nước. Câu 23: Dãy chất nào đều tác dụng với nhôm: A. Cl2, O2, HCl, CuSO4, NaOH B. Cl2, O2, HNO3đ nguội , CuSO4, NaOH C. Cl2, O2,H2SO4đ nguội , CuSO4, NaOH D. Cl2, O2, HCl, MgSO4, NaOH Câu 24: Ngâm 16,6 gam hỗn hợp bột các Al và Fe trong dung dịch HCl dư, thu được 11,2 lít khí H2 (đktc). Phần trăm khối lượng của Al và Fe trong hỗn hợp lần lượt trong hỗn hợp là: A. 30% và 70% B. 32,5% và 67,5% C. 40% và 60% D. 50% và 50% Câu 25: Thuốc thử dùng để nhận biết 4 chất: HNO3, Ba(OH)2, NaCl, NaNO3 đựng riêng biệt trong các lọ mất nhãn là A. Dùng quì tím và dd Ba(NO3)2. B. Dùng dd phenolphtalein và dd AgNO3. C. Dùng quì tím và dung dịch AgNO3 . D. Dùng dd phenolphtalein và dd Ba(NO3 )2. Câu 26: Để so sánh mức độ hoạt động mạnh, yếu của phi kim thường được xem xét qua khả năng phản ứng của phi kim đó với A. hiđro hoặc với kim loại. B. dung dịch kiềm. C. dung dịch axit. D. dung dịch muối Câu 27: Cặp chất nào sau đây phản ứng với nhau tạo kết tủa trắng ? A. KCl và AgNO3 B. BaCl2 và H2SO4 C. MgSO4 và KOH D. cả A,B,C Câu 28: Các chất là oxit lưỡng tính? A. Mn2O7, NO B. Al2O3, ZnO C. Al2O3, CO D. ZnO, Fe2O3 Câu 29: Cho 10 hỗn hợp gồm nhôm và đồng vào dung dịch HCl dư thu được 6,72 lít khí (đktc). Khối lượng của Cu trong hỗn hợp là A. 5,4 gam. B. 2,4 gam. C. 4,6 gam. D. 5 gam. Câu 30: Cách làm nào sau đây không giúp cho việc bảo vệ kim loại khỏi bị ăn mòn? A. thả đinh sắt trong nước có hoà tan khí oxi. B. bôi dầu mỡ vào cuốc, xẻng. C. thêm vào thép một số kim loại như crom, niken. D. rửa sạch và lau khô dao làm bằng thép sau khi sử dụng. ----------------------------------------------- PHÒNG GIÁO DỤC & ĐÀO TẠO TIỀN HẢI TRƯỜNG THCS NAM THẮNG ĐỀ THI HỌC KÌ I Môn : hóa học 9 Thời gian làm bài: 45 phút; (30 câu trắc nghiệm) Mã đề thi 485 Họ, tên thí sinh:..................................................................... Lớp: ............................. Câu 1: Kim loại nào sau đây có tính dẫn điện tốt nhất? A. Đồng B. Nhôm C. Sắt D. Bạc Câu 2: Ngâm 16,6 gam hỗn hợp bột các Al và Fe trong dung dịch HCl dư, thu được 11,2 lít khí H2 (đktc). Phần trăm khối lượng của Al và Fe trong hỗn hợp lần lượt trong hỗn hợp là: A. 30% và 70% B. 32,5% và 67,5% C. 40% và 60% D. 50% và 50% Câu 3: Chất tác dụng với nước tạo ra dung dịch bazơ là: A. CO2 B. Na2O C. SO2 D. P2O5 Câu 4: Các dạng thù hình của cacbon là A. than chì, cacbon vô định hình, vôi sống. B. than chì, kim cương, canxi cacbonat. C. cacbon vô định hình, kim cương, canxi cacbonat. D. kim cương, than chì, cacbon vô định hình. Câu 5: Cho 21 gam MgCO3 tác dụng với một lượng vừa đủ dung dịch HCl 2M.Thể tích dung dịch HCl đã dùng là: Câu 6: Clo tác dụng với natri hiđroxit A. tạo thành muối natri clorua và nước. B. tạo thành nước javen. C. tạo thành hỗn hợp các axit. D. tạo thành muối natri hipoclorit và nước. Câu 7: Để so sánh mức độ hoạt động mạnh, yếu của phi kim thường được xem xét qua khả năng phản ứng của phi kim đó với A. hiđro hoặc với kim loại. B. dung dịch kiềm. C. dung dịch axit. D. dung dịch muối Câu 8: Đốt sắt trong khí oxi thu được oxit sắt từ. Công thức hóa học của oxit sắt từ là: A. FeO. B. Fe2O3. C. Fe3O4. D. Fe(OH)2. Câu 9: Cho 20 gam hỗn hợp X gồm CuO và Fe2O3 tác dụng vừa đủ với 0,2 lít dung dịch HCl có nồng độ 3,5M. Thành phần phần trăm theo khối lượng của CuO và Fe2O3 trong hỗn hợp X lần lượt là: A. 25 % và 75 % B. 20 % và 80 % C. 22 % và 78 % D. 30 % và 70 % Câu 10: Cặp chất nào sau đây phản ứng với nhau tạo kết tủa trắng ? A. KCl và AgNO3 B. BaCl2 và H2SO4 C. MgSO4 và KOH D. cả A,B,C Câu 11: Đốt cháy 11,2 lít CO (đktc). Thể tích không khí cần cho phản ứng trên là (= Vkk) A. 21,4 lít. B. 24 lít. C. 26 lít. D. 28 lít. Câu 12: Muối đồng (II) sunfat (CuSO4) có thể phản ứng với dãy chất: A. CO2, NaOH, H2SO4,Fe B. H2SO4, AgNO3, Ca(OH)2, Al C. .NaOH, BaCl2, Fe, H2SO4 D. NaOH, BaCl2, Fe, Al Câu 13: Nhóm chất nào sau đây gồm các khí đều cháy được ? A. CO, CO2. B. CO, H2. C. CO2, O2. D. Cl2, CO2. Câu 14: Cho bản sắt có khối lượng 50g vào dung dịch đồng sunfat. Sau một thời gian nhấc bản sắt ra và đem cân thì thấy khối lượng bản sắt là 52g. Biết rằng đồng sinh ra bám trên bề mặt của bản sắt. Số mol muối sắt tạo thành sau phản ứng là: A. 1,25 mol. B. 2,5 mol. C. 0.125 mol. D. 0,25 mol. Câu 15: Hoà tan 2,4 gam một oxit kim loại hoá trị II cần dùng 30 gam dung dịch HCl 7,3 %. Công thức của oxit kim loại là: A. CaO B. CuO C. FeO D. ZnO Câu 16: Dãy các chất đều phản ứng với dung dịch HCl là: A. NaOH, Al, CuSO4, CuO B. Cu(OH)2, Cu, CuO, Fe C. CaO, Al2O3, Na2SO3, H2SO3 D. Al, CaCO3, Cu(OH)2, Fe, CaO, Al2O3 Câu 17: Cho 5,4g bột nhôm vào dung dịch bạc nitrat dư. Sau phản ứng thu được bao nhiêu gam kết tủa bạc ? A. 648g. B. 6,48g C. 64,8g D. 0, 648g Câu 18: Dãy kim loại nào sau đây có mức độ hoạt động hoá học tăng dần: A. Na, Al, Fe, Mg, Zn B. Mg, Na, Fe, Zn, Al C. Na, Mg, Al, Zn, Fe D. Fe, Zn, Al, Mg, Na. Câu 19: Cho những cặp chất sau đây:1/ K2O và CO2 2/ CO và K2O 3/ K2O và H2O 4/ KOH và CO2 5/ CaO và SO3 6/ P2O5 và H2O 7/ Fe2O3 và H2O 8/ CuO và SO2 . Những cặp chất nào tác dụng được với nhau: A. 1,2,3,4,5 B. 1,3,5,7,8 C. 3,4,5,7,8 D. 1,3,4,5,6 Câu 20: Các chất là oxit lưỡng tính? A. Mn2O7, NO B. Al2O3, ZnO C. Al2O3, CO D. ZnO, Fe2O3 Câu 21: Dung dịch KOH phản ứng với dãy oxit: A. . CO2; SO2; P2O5; Fe2O3 B. Fe2O3; SO2; SO3; MgO C. P2O5; CO2; Al2O3 ; SO3 D. P2O5 ; CO2; CuO; SO3 Câu 22: Hãy hoàn thành đoạn sau: (1)và (2) đều là hợp kim của sắt với cacbon và một số nguyên tố khác nhưng trong gang cacbon chiếm từ (3), còn trong thép hàm lượng cacbon (4). Các số 1;2;3;4 lần lượt là: A. gang; thép; 2-5%; dưới 2%. B. gang; thép; 2-5%; trên 2%. C. gang; thép; 3-6%; dưới 2%. D. gang; thép; dưới 2%; trên 2%. Câu 23: Trộn dung dịch có chứa 0,1mol CuSO4 và một dung dịch chứa 0,3 mol NaOH, lọc kết tủa, rửa sạch rồi đem nung đến khối lượng không đổi thu được m g chất rắn. Giá trị m là: A. 8 g B. 4 g C. 6 g D. 12 g Câu 24: Dãy chất nào đều bị nhiệt phân hủy : A. NaOH, Cu(OH)2, CaCO3, Fe(OH)3 B. KOH, Mg(OH)2, CaCO3, Al(OH)3 C. Mg(OH)2 , Cu(OH)2, CaCO3, Fe(OH)3 D. NaOH, Ca(OH)2, CaCO3, Fe(OH)3 Câu 25: Cách làm nào sau đây không giúp cho việc bảo vệ kim loại khỏi bị ăn mòn? A. thả đinh sắt trong nước có hoà tan khí oxi. B. bôi dầu mỡ vào cuốc, xẻng. C. thêm vào thép một số kim loại như crom, niken. D. rửa sạch và lau khô dao làm bằng thép sau khi sử dụng. Câu 26: Các Cặp chất nào sau đây không xảy ra phản ứng ? 1.CaCl2+Na2CO3 2. CaCO3+NaCl 3. NaOH+HCl 4.NaOH+KCl A. 1 và 2 B. 2 và 3 C. 3và 4 D. 2 và 4 Câu 27: Thuốc thử dùng để nhận biết 4 chất: HNO3, Ba(OH)2, NaCl, NaNO3 đựng riêng biệt trong các lọ mất nhãn là A. Dùng quì tím và dd Ba(NO3)2. B. Dùng dd phenolphtalein và dd AgNO3. C. Dùng quì tím và dung dịch AgNO3 . D. Dùng dd phenolphtalein và dd Ba(NO3 )2. Câu 28: Cho 10 hỗn hợp gồm nhôm và đồng vào dung dịch HCl dư thu được 6,72 lít khí (đktc). Khối lượng của Cu trong hỗn hợp là A. 5,4 gam. B. 2,4 gam. C. 4,6 gam. D. 5 gam. Câu 29: Để phân biệt được kim loại nhôm với sắt, có thể sử dụng A. dung dịch kiềm. B. dung dịch muối magie. C. dung dịch muối kẽm. D. dung dịch axit sunfuric Câu 30: Dãy chất nào đều tác dụng với nhôm: A. Cl2, O2, HCl, CuSO4, NaOH B. Cl2, O2, HNO3đ nguội , CuSO4, NaOH C. Cl2, O2,H2SO4đ nguội , CuSO4, NaOH D. Cl2, O2, HCl, MgSO4, NaOH ---------------------------------------------- - MA TRẬN ĐỀ KIỂM TRA HỌC KÌ I MÔN : HÓA HỌC 8 Nội dung kiến thức Mức độ nhận thức Cộng Nhận biết Thông hiểu Vận dụng Vận dụng ở mức cao hơn TN TL TN TL TN TL TN TL Chủ đề 1 : Chất – nguyên tử phân tử Số câu hỏi 4 2 1 7 Số điểm Tỉ lệ % 1,33 13,3% 0,67 6,7% 0,33 3,3% 2,33 23,3% Chủ đề 2 ;Phản ứng hóa học Số câu hỏi 3 5 8 Số điểm Tỉ lệ % 0,67 6,7% 0,67 6,7% 2,67 26,7% Chủ đề 3 : Mol và tính toán hóa học Số câu hỏi 2 2 5 6 15 Số điểm Tỉ lệ % 0,67 6,7% 0,67 6,7% 1,67 16,7% 2,0 20% 3,67 36,7% Tổng số câu Tổng số điểm Tỉ lệ % 9 30 30% 9 30 30% 6 20 20% 6 20 20% 30 10,0 100% PHÒNG GIÁO DỤC & ĐÀO TẠO TIỀN HẢI TRƯỜNG THCS NAM THẮNG ĐỀ THI HỌC KÌ I Môn :hóa học 8 Thời gian làm bài: 45 phút; (30 câu trắc nghiệm) Mã đề thi 109 Họ, tên thí sinh:..................................................................... Lớp: ............................. Câu 1: Muèn thu khÝ NH3 vµo b×nh th× cã thÓ thu b»ng c¸ch nµo sau ®©y? A. Lóc ®Çu óp ng îc b×nh, khi gÇn ®Çy råi th× ®Ó ®øng b×nh B. §Ó ®øng b×nh C. §Æt óp ng îc b×nh D. C¸ch nµo còng ® îc Câu 2: Cho natri(Na) t¸c dông víi H2O thu ® îc xót( NaOH) vµ khÝ H2. Ph ¬ng tr×nh ph¶n øng nµo sau ®©y ®· viÕt ®óng? A. 2Na + 2H2O -> 2NaOH + H2 B. 3Na + 3H2O -> 3NaOH + 3H2 C. 2Na + H2O -> 2NaOH + H2 D. Na + H2O -> NaOH + H2 Câu 3: Sè nguyªn tö s¾t cã trong 280g s¾t lµ: A. 30,.1023 B. 25,1.1023 C. 35,1.1023 D. 20,1.1023 Câu 4: Hîp chÊt lµ nh÷ng chÊt ® îc t¹o nªn tõ bao nhiªu nguyªn tè ho¸ häc? A. ChØ tõ 2 nguyªn tè B. Tõ 2 nguyªn tè trë lªn C. ChØ tõ 3 nguyªn tè D. ChØ cã 1 nguyªn tè Câu 5: Khèi l îng C ®· ch¸y lµ 2,8kg vµ khèi l îng CO 2 thu ® îc lµ 11kg. Khèi l îng O2 ®· ph¶n øng lµ: A. 8,0kg B. 8,3kg C. 8,2kg D. 8,4kg Câu 6: §èt ch¸y quÆng pirit s¾t(FeS2) thu ® îc s¾t (III) oxit Fe2O3 vµ khÝ sunfuar¬ SO2. Ph ¬ng tr×nh ph¶n øng nµo sau ®©y ®· viÕt ®óng? A. 2FeS2 + O2 -> Fe2O3 + SO2 B. FeS2 + O2 -> Fe2O3 + SO2 C. FeS2 + O2 -> Fe2O3 + 2SO2 D. 4FeS2 +11 O2 ->2 Fe2O3 + 8SO2 Câu 7: Thµnh phÇn cÊu t¹o cña hÇu hÕt cña c¸c lo¹i nguyªn tö gåm: A. p vµ n B. N¬tron vµ electron C. Pr«ton vµ electron D. p, n vµ e Câu 8: C«ng thøc ho¸ häc nµo sau ®©y viÕt ®óng? A. K(SO4)2 B. K2S C. KCl2 D. KSO3 Câu 9: C©u nµo sau ®©y dóng? Trong ph¶n øng ho¸ häc, c¸c nguyªn tö bÞ ph¸ vì Trong ph¶n øng ho¸ häc, liªn kÕt trong c¸c ph©n tö bÞ ph¸ vì Trong ph¶n øng ho¸ häc, liªn kÕt trong c¸c ph©n tö kh«ng bÞ ph¸ vì D. Trong ph¶n øng ho¸ häc c¸c ph©n tö ®ư îc b¶o toµn Câu 10: Cho s¬ ®å ph¶n øng: Al(OH)y + H2SO4 -> Alx(SO4)y + H2O.Víi x # y th× gi¸ trÞ thÝch hîp cña x, y lÇn l ît lµ: A. 2 vµ 3 B. 2 vµ 4 C. 1 vµ 2 D. 3 vµ 4 Câu 11: Khèi l îng hçn hîp khÝ ë ®ktc gåm 11,2 lÝt H2 vµ 5,6 lÝt O2 lµ: A. 10g B. 12g C. 9g D. 8g Câu 12: Trong ph¶n øng ho¸ häc, h¹t vi m« nµo ® îc b¶o toµn? A. Kh«ng lo¹i h¹t nµo ® îc B. H¹t ph©n tö C. C¶ hai lo¹i h¹t trªn D. H¹t nguyªn tö Câu 13: §èt ch¸y khÝ amoni¨c (NH3) trong khÝ oxi O2 thu ® îc khÝ nit¬ oxit(NO) vµ n íc. Ph ¬ng tr×nh ph¶n øng nµo sau ®©y viÕt ®óng? A. 4NH3 + O2 -> 4NO + 6H2O B. 2NH3 + O2 -> 2NO + 3H2O C. NH3 + O2 -> NO + H2O D. 4NH3 + 5O2 -> 4NO + 6H2O Câu 14: Chän c©u ph¸t biÓu ®óng: N íc cất lµ: A. mét hçn hîp B. mét ®¬n chÊt C. mét hîp chÊt D. mét chÊt tinh khiÕt Câu 15: Oxit cã c«ng thøc ho¸ häc RO2, trong ®ã mçi nguyªn tè chiÕm 50% khèi l îng. Khèi l îng cña R trong 1 mol oxit lµ: A. 32g B. 64g C. 48g D. 16g Câu 16: Nguyªn tè X cã ho¸ trÞ III, c«ng thøc cña muèi sunfat lµ: A. X(SO4)3 B. X3SO4 C. X2(SO4)3 D. XSO4 Câu 17: Khèi l îng axit sunfuaric (H2SO4) trong ®ã sè ph©n tö b»ng sè ph©n tö cã trong 11,2 lÝt khÝ hi®ro H2 ë ®ktc lµ: A. 98g B. 40g C. 80g D. 49g Câu 18: Cho c¸c oxit: CO2, NO2, SO2,PbO2, . Oxit cã phÇn tr¨m khèi l îng oxi nhá nhÊt lµ: H·y lùa chon b»ng c¸ch suy luËn, kh«ng dïng ®Õn tÝnh to¸n. A. CO2 B. NO2 C. SO2 D. PbO2 Câu 19: Đốt cháy hoàn toàn 1,92g kim loại A thu được 2,4g AxOy .A là kim loại : Câu 20: Cho 5,6g Fe t¸c dông víi dung dÞch axit clohi®ric HCl t¹o ra 12,7g s¾t (II) clorua FeCl2 vµ 0,2g khÝ H2. Khèi l îng HCl ®· dïng lµ: A. 7,3g B. 14,2g C. 9,2g D. 8,4g Câu 21: Hîp chÊt cña nguyªn tè X víi nhãm PO4 ho¸ trÞ III lµ XPO4. Hîp chÊt cña nguyªn tè Y víi H lµ H3Y. VËy hîp chÊt cña X víi Y cã c«ng thøc lµ: A. XY2 B. X2Y3 C. XY D. X2Y Câu 22: Trong líp vá cña nguyªn tö cã g×? A. Electron B. N¬tron C. C¶ Pr«ton vµ N¬tron D. Pr«ton Câu 23: BiÕt N cã ho¸ trÞ IV, h·y chän c«ng thøc ho¸ häc phï hîp víi qui t¸c ho¸ trÞ trong ®ã cã c¸c c«ng thøc sau: A. NO B. NO2 C. N2O3 D. N2O Câu 24: TØ khèi cña khÝ A ®èi víi kh«ng khÝ lµ dA/KK < 1. Lµ khÝ nµo trong c¸c khÝ sau: A. N2 B. CO2 C. O2 D. H2S Câu 25: Cho 3,2g Fe2O3 tác dụng với dung dịch H2SO4 theo sơ đồ : Fe2O3 + H2SO4 → Fe2(SO4 )3 + H2O.Khối lượng Fe2(SO4)3 tạo ra là : A. 0,8g B. kết quả khác C. 4g D. 8g Câu 26: §èt photpho(P) trong khÝ oxi(O2) thu ® îc ®iphotphopentaoxit (P2O5). Ph ¬ng tr×nh ph¶n øng nµo sau ®©y ®· viÕt ®óng? A. 2P + 5O2 -> P2O5 B. 2P + O2 -> P2O5 C. 4P + 5O2 -> 2P2O5 D. 2P + 5O2 -> 2P2O5 Câu 27: Nguyªn tö khèi lµ khèi l ưîng cña mét nguyªn tö tÝnh b»ng ®¬n vÞ nµo? A. §¬n vÞ cacbon (®vC) B. C¶ 3 ®¬n vÞ trªn C. Kil«gam D. Gam Câu 28: §èt ch¸y mét chÊt trong oxi thu ® îc n íc vµ khÝ cacbonic. ChÊt ®ã ® îc cÊu t¹o bëi nh÷ng nguyªn tè nµo? A. Cacbon vµ hi®ro B. Cacbon, hi®ro vµ cã thÓ cã oxi C. Hi®ro D. C¸cbon Câu 29: KhÝ nµo nhÑ nhÊt trong tÊt c¶ c¸c khÝ? A. KhÝ Hi®ro (H2) B. KhÝ Mªtan(CH4) C. KhÝ oxi (O2) D. KhÝ cacbon oxit( CO) Câu 30: §Ó t¹o thµnh ph©n tö cña mét hîp chÊt th× tèi thiÓu cÇn ph¶i cã bao nhiªu lo¹i nguyªn tö? A. 4 lo¹i B. 1 lo¹i C. 2 lo¹i D. 3 lo¹i ----------------------------------------------- ----------- HẾT ---------- PHÒNG GIÁO DỤC & ĐÀO TẠO TIỀN HẢI TRƯỜNG THCS NAM THẮNG ĐỀ THI HỌC KÌ I Môn : hóa học 8 Thời gian làm bài: 45 phút; (30 câu trắc nghiệm) Mã đề thi 271 Họ, tên thí sinh:..................................................................... Lớp: ............................. Câu 1: KhÝ nµo nhÑ nhÊt tro
Tài liệu đính kèm:
 de_thi_hoc_ki_1_hoa_89_trac_nghiem_100.docx
de_thi_hoc_ki_1_hoa_89_trac_nghiem_100.docx





