Đề tham khảo học kì II (2015 - 2016) môn hóa học 9 thời gian: 60 phút
Bạn đang xem tài liệu "Đề tham khảo học kì II (2015 - 2016) môn hóa học 9 thời gian: 60 phút", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
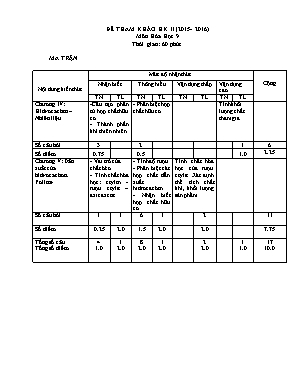
Nội dung kiến thức Mức độ nhận thức Cộng Nhận biết Thông hiểu Vận dụng thấp Vận dụng cao TN TL TN TL TN TL TN TL Chương IV: Hidrocacbon – Nhiên liệu -Cấu tạo phân tử hợp chất hữu cơ - Thành phần khí thiên nhiên - Phân biệt hợp chất hữu cơ Tính khối lượng chất tham gia. Số câu hỏi 3 2 1 6 Số điểm 0.75 0.5 1.0 2.25 Chương V: Dẫn xuất của hidrocacbon. Polime - Vai trò của chất béo - Tính chất hóa học: etylen - rượu etylic – axit axetic. - Tính độ rượu - Phân biệt các hợp chất dẫn xuất hidrocacbon - Nhận biết hợp chất hữu cơ Tính chất hóa học của rượu etylic. Xác định thể tích chất khí, khối lượng sản phẩm Số câu hỏi 1 1 6 1 2 11 Số điểm 0.25 2.0 1.5 2.0 2.0 7.75 Tổng số câu Tổng số điểm 4 1.0 1 2.0 8 2.0 1 2.0 2 2.0 1 1.0 17 10.0 ĐỀ THAM KHẢO HK II (2015- 2016) Môn Hóa Học 9 Thời gian: 60 phút MA TRẬN ĐỀ THI THAM KHẢO HK II (2015- 2016) Môn Hóa Học 9 Thời gian: 60 phút PHẦN TRẮC NGHIỆM (3 điểm) Học sinh chọn câu đúng nhất, mỗi câu 0.25 điểm. Câu 1: Có 100ml rượu 400 . Số ml rượu nguyên chất là: A. 20ml B. 40ml C. 60ml D. 80ml Câu 2: Những cặp chất nào làm mất màu dung dịch brom? A.C2H4, CH4. B.C2H4, C2H6. C.CH4, C6H6. D.C2H4, C2H2. Câu 3: Chất nào sau đây có tính axit: A.. C2H4 B. CH3COOH C. C2H2 D. C2H5OH Câu 4: Este là sản phẩm của phản ứng giữa: A. Axit và bazơ B. Kim loại và axit C. Natri và rượu etylic D. Rượu etylic và axitaxetic Câu 5: Để sử dụng nhiên liệu có hiệu quả cần phải cung cấp không khí hoặc oxi như thế nào? A.Vừa đủ. B.Dư. C.Thiếu. D.Vừa đủ và phải dư. Câu 6: Dãy nào gồm toàn là là chất hữu cơ? A.C2H6, C2H5OH, H2CO3. B.Na2CO3, C3H8, CH3COOH. C.C2H5OH, C2H6, CH4. D.C2H4, CaCO3, C2H5OH. Câu 7: Chất làm đổi màu quỳ tím thành đỏ: A. Metan B. Rượu etylic C. Axit axetic D. Benzen Câu 8: Dung dịch Ca(OH)2 dùng để nhận biết: A. H2 B. CH4 C. O2 D. CO2 Câu 9: Công thức cấu tạo của phân tử Metan có: A. 1 liên kết đôi B. 2 liên kết đơn C. 4 liên kết đơn D. 1 liên kết ba Câu 10: Có thể dùng dung dịch Brom để nhận biết: A. Metan B. Etilen C. Cacbon đioxit D. Hidro Câu 11: Thành phần chủ yếu của khí thiên nhiên là: A. Metan B. Etilen C. Axetilen D. Benzen Câu 12: Chất nào sau đây khi cháy cho năng suất tỏa nhiệt cao nhất: A. Than gầy B. Than bùn C. Than mỡ D. Than non II. PHẦN TỰ LUẬN: (7điểm) Câu 1:(2điểm) Viết phương trình hóa học hoàn thành dãy chuyển đổi sau (ghi điều kiện nếu có) C2H4 à C2H5OH à CH3COOH à CH3COONa C2H5ONa (Chuỗi PU cần ghi số thứ tự) Câu 2:(2điểm) Có ba lọ mất nhãn, mỗi lọ chứa một trong ba chất sau: rượu etylic, benzen, axit axetic. Hãy nhận biết mỗi chất lỏng bằng phương pháp hóa học.Viết phương trình hóa học (nếu có) Câu 3:(3điểm) Đốt cháy hết 5,6 lit khí metan (ĐKTC) a.Viết phương trình hóa học. b. Tính khối lượng khí metan đã tham gia phản ứng? c. Tính thể tích khí oxi tham gia phản ứng? ĐÁP ÁN- BIỂU ĐIỂM I. PHẦN TRẮC NGHIỆM (3 điểm) M ỗ i câu đúng đạt 0,25 điểm 1B 2D 3B 4D 5A 6C 7C 8D 9C 10B 11A 12.A II. PHẦN TỰ LUẬN: (7 điểm) axit Câu 1: a. C2H4 + H2O à C2H5OH (0,5) Men giấm b. C2H5OH + O2 à CH3COOH + H2O (0,5) H2SO4 (đ), t0 c. CH3COOH + NaOH à CH3COONa + H2O (0,5) d. 2C2H5OH + 2 Na à 2C2H5ONa + H2 (0,5) Câu 2: Đánh dấu mỗi lọ theo thứ tự 1, 2, 3 rồi lấy ra ở mỗi lọ một ít để làm thuốc thử (0.25 ) Chất nhận diện Thuốc thử Rượu Etylic Benzen Axit Axetic Quì tím Không đổi màu Không đổi màu Hóa đỏ (0.5 ) Kim loại Na Khí bay ra (0.5) Không hiện tượng à Còn lại (0.5 ) / PTHH: 2C2H5OH + 2Na à 2C2H5ONa + H2 (0,25) t0 Câu 3: a. CH4 + 2O2 à CO 2 + 2H2O (0,25) 1mol 2mol 1mol 2mol 0,25mol 0,5mol 0,25mol 0,5mol (0,25) Số mol của metan: n CH4 = V : 22,4 = 5,6 : 22,4 = 0,25 (mol) (0,5) b. Khối lượng của metan: m = n.M = 0,25 . 16 = 4 (g) (1.0) c. Thể tích khí oxi tham gia đktc: V = n . 22,4 = 0,5 . 22,4 = 11,2 (lit) (1,0)
Tài liệu đính kèm:
 ĐỀ SỐ 2.doc
ĐỀ SỐ 2.doc





