Đề kiểm tra tiết – tuần 28 môn: Hóa học 8
Bạn đang xem tài liệu "Đề kiểm tra tiết – tuần 28 môn: Hóa học 8", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
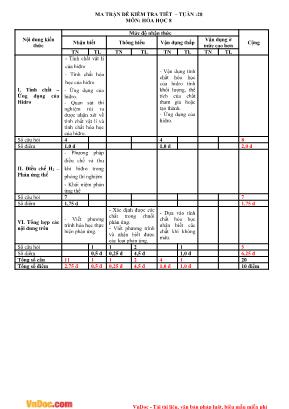
VnDoc - Tải tài liệu, văn bản pháp luật, biểu mẫu miễn phí MA TRẬN ĐỀ KIỂM TRA TIẾT – TUẦN :28 MÔN: HÓA HỌC 8 Nội dung kiến thức Mức độ nhận thức CộngNhận biết Thông hiểu Vận dụng thấp Vận dụng ởmức cao hơn TN TL TN TL TN TL TN TL I. Tính chất – Ứng dụng của Hiđro - Tính chất vật lí của hiđro - Tính chất hóa học của hiđro - Ứng dụng của hiđro. - Quan sát thí nghiệm rút ra được nhận xét về tính chất vật lí và tính chất hóa học của hiđro. - Vận dụng tính chất hóa học của hidro tính khối lượng, thể tích của chất tham gia hoặc tạo thành. - Ứng dụng của hidro. Số câu hỏi 4 4 8 Số điểm 1,0 đ 1,0 đ 2,0 đ II. Điều chế H2 – Phản ứng thế - Phương pháp điều chế và thu khí hiđro trong phòng thí nghiệm - Khái niệm phản ứng thế Số câu hỏi 7 7 Số điểm 1,75 đ 1,75 đ VI. Tổng hợp các nội dung trên - Viết phương trình hóa học thực hiện phản ứng. - Xác định được các chất trong chuỗi phản ứng. - Viết phương trình và nhận biết được các loại phản ứng. - Dựa vào tính chất hóa học nhận biết các chất khí không màu. Số câu hỏi 1 1 2 1 5 Số điểm 0,5 đ 0,25 đ 4,5 đ 1,0 đ 6,25 đ Tổng số câu 11 1 1 2 4 1 20 Tổng số điểm 2,75 đ 0,5 đ 0,25 đ 4,5 đ 1,0 đ 1,0 đ 10 điểm VnDoc - Tải tài liệu, văn bản pháp luật, biểu mẫu miễn phí Trường THCS Thành Thới A Họ tên: Lớp: Kiểm tra 1 tiết Môn: Hóa học 8 Tuần tiết Điểm Lời phê của giáo viên ĐỀ I Phần I: Trắc nghiệm (4 điểm) Hãy khoanh tròn vào một trong các chữ cái A, B, C hoặc D đứng trước câu trả lời đúng nhất Câu 1: Khí H2 có tính khử vì A. khí H2 là khí nhẹ nhất. B. khí H2 chiếm Oxi của chất khác khi tham gia phản ứng hóa học. C. khí H2 là đơn chất. D. khí H2 được điều chế bằng phản ứng của kim loại tác dụng với dung dịch axit. Câu 2: Phản ứng giữa khí H2 với khí O2 gây nổ khi A. tỉ lệ về khối lượng của Hiđro và Oxi là 2 : 1 B. tỉ lệ về số nguyên tử Hiđro và số nguyên tử Oxi là 4 : 1 C. tỉ lệ về số mol Hiđro và Oxi là 1 : 2 D. tỉ lệ về thể tích Hiđro và Oxi là 2 : 1 Câu 3: Hỗn hợp khí nhẹ hơn không khí là A. H2 và CO2 B. H2 và N2 C. H2 và SO2 D. H2 và Cl2 (Cho biết: H=1; C=12; O=16; N=14; S=32; Cl=35,5) Câu 4: Phản ứng hóa học dùng để điều chế khí Hidro trong phòng thí nghiệm là A. Zn + H2SO4loãng ZnSO4 + H2 B. 2H2O ñieänphaân 2H2 + O2 C. 2Na + 2H2O 2NaOH + H2 D. C + H2O CO + H2 Câu 5: Nhóm các chất đều phản ứng được với khí Hidro là A. CuO, ZnO, H2O B. CuO, ZnO, O2 C. CuO, ZnO, H2SO4 D. CuO, ZnO, HCl Câu 6: Đốt khí Hiđro trong không khí sẽ có A. khói trắng B. ngọn lửa màu đỏ C. ngọn lửa màu xanh nhạt D. khói đen và hơi nước tạo thành Câu 7: Phản ứng thế là phản ứng trong đó A. có chất mới được tạo thành từ 2 hay nhiều chất ban đầu. B. nguyên tử của đơn chất thay thế nguyên tử của 1 nguyên tố trong hợp chất. C. từ 1 chất ban đầu sinh ra nhiều chất mới. D. phản ứng xảy ra đồng thời sự oxi hóa và sự khử. Câu 8: Điều chế 2,4 gam Cu bằng cách dùng H2 khử CuO. Khối lượng CuO cần dùng là A. 3 g B. 4,5 g C. 6 g D. 1,5 g (Cho Cu = 64; O = 16) Câu 9: Khí Hidro được bơm vào khinh khí cầu, bóng thám không vì Hidro là khí A. không màu. B. khí nhẹ nhất trong các loại khí. C. có tác dụng với Oxi trong không khí. D. ít tan trong nước. Câu 10: Khí Hidro cháy trong khí Oxi tạo ra nước. Muốn thu được 22,5 gam nước thì thể tích khí H2 (đktc) cần phải đốt là A. 24 lít B. 25 lít C. 26 lít D. 28 lít (Cho H = 1 ; O = 16) Câu 11: Dùng H2 để khử Fe2O3 thành Fe. Để điều chế được 3,5 gam Fe thì thể tích H2 (đktc) cần dùng là A. 4,2 lít B. 1,05 lít C. 2,6 lít D. 2,1 lít (Cho H = 1 ; O = 16 ; Fe = 56) Câu 12: Cho sơ đồ chuyển hóa: KMnO4 ot A Cu CuO B Cu. A và B lần lượt là A. MnO2 và H2O B. CO và O2 C. H2 và O2 D. O2 và H2 Câu 13: Thu khí Hidro bằng cách đẩy không khí ta phải úp ngược bình thu vì A. khí Hidro nặng hơn không khí. B. khí Hidro nhẹ hơn không khí. C. khí Hidro nặng bằng không khí. D. khí Hidro tác dụng với không khí. Câu 14: Phản ứng KHÔNG PHẢI phản ứng thế là A. CuO + H2 Cu + H2O B. Mg + 2HClMgCl2 + H2 C. Ca(OH)2 + CO2 CaCO3 + H2O D. Zn + CuSO4 ZnSO4 + Cu Câu 15: Phản ứng thế là A. 3Fe +2O2 ot Fe3O4 B. 2Al + 6HCl 2AlCl3 + 3H2 C. 2KMnO4 otK2MnO4 + MnO2 + O2 D. BaO + H2O Ba(OH)2 Câu 16: Kim loại thường được dùng để điều chế khí Hidro trong phòng thí nghiệm là A. Zn và Cu B. Al và Ag C. Fe và Hg D. Zn và Fe Phần II: Tự luận (6 điểm) Câu 1 (2 điểm): Hoàn thành các phương trình hóa học sau và cho biết mỗi phản ứng thuộc loại nào? A. Fe + O2 ot Fe2O3 B. Cu + AgNO3 Cu(NO3)2 + Ag C. Al(OH)3 ot Al2O3 + H2O D. Fe2O3 + CO ot Fe + CO2 VnDoc - Tải tài liệu, văn bản pháp luật, biểu mẫu miễn phí Câu 2 (1 điểm): Có 3 lọ đựng riêng biệt các khí không màu là O2, N2, H2. Hãy trình bày cách nhận biết các chất khí trong mỗi lọ. Câu 3 (3 điểm): Cho 19,5 gam Kẽm vào bình chứa dung dịch axit clohidric. a. Viết phương trình hóa học của phản ứng. b. Tính khối lượng các sản phẩm tạo thành? c. Nếu dùng toàn bộ lượng chất khí toàn vừa sinh ra ở phản ứng trên để khử 128 gam sắt (III) oxit thì sau phản ứng chất nào còn dư và dư bao nhiêu gam? (Cho Zn = 65 ; H = 1 ; Cl = 35,5 ; Fe = 56 ; O= 16) ĐÁP ÁN KIỂM TRA VIẾT HÓA HỌC 8 TIẾT 53 TUẦN 28 NĂM HỌC 2012-2013 ĐỀ I I. Trắc nghiệm (4 điểm) Mỗi lựa chọn đúng đạt 0,25 điểm 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 B D B A B C B A B D D D A C B D II. Tự luận (6 điểm) Câu Đáp án Điểm Câu 1 (2 điểm) A. 4Fe + 3O2 ot 2Fe2O3 : phản ứng hóa hợp ; oxi hoá – khử (0,5đ) B. Cu + 2AgNO3 Cu(NO3)2 + 2Ag : phản ứng thế (0,5đ) C. 2Al(OH)3 ot Al2O3 + 3H2O : phản ứng phân huỷ (0,5đ) D. Fe2O3 + 3CO ot 2Fe + 3CO2 : phản ứng oxi hoá – khử (0,5đ) Câu 2 (1 điểm) Cho tàn đóm đang cháy lần lượt vào từng lọ: (0,25đ) - Khí ở lọ nào làm que đóm tắt ngay là lọ chứa khí N2 (0,25đ) - Khí ở lọ nào làm que đóm bùng cháy là lọ chứa khí O2 (0,25đ) - Khí ở lọ nào làm que đóm cháy với ngọn lửa màu xanh nhạt là lọ chứa khí H2 (0,25đ) Câu 3 (3 điểm) a. Zn + 2HCl ZnCl2 + H2 (0,25đ)b. Zn + 2HCl ZnCl2 + H2 1mol 2mol 1mol 1mol 0,3mol nZn phản ứng = 19,5 65 = 0,3 mol (0,25đ) 2ZnCln tạo thành = 2Hn tạo thành = nZn phản ứng = 0,3 mol (0,25đ) 2ZnClm tạo thành = 0,3 . 136 = 40,8 g (0,25đ) 2Hm tạo thành = 0,3 .2 = 0,6 g (0,25đ) c. Fe2O3 + 3H2 ot 2Fe + 3H2O (0,25đ) 1mol 3mol 2mol 3mol 0,3mol 2 3Fe On ban đầu = 128160 = 0,8 mol (0,25đ) 2Hn ban đầu = 0,3mol Ta có tỉ lệ: 0,8 1 > 0,3 3 (0,25đ) Fe2O3 dư (0,25đ) 2 3Fe On phản ứng = 0,33 = 0,1mol (0,25đ) 2 3Fe On còn thừa = 0,8 – 0,1 = 0,7mol (0,25đ) 2 3Fe Om còn thừa = 0,7 . 160 = 112 g (0,25đ) VnDoc - Tải tài liệu, văn bản pháp luật, biểu mẫu miễn phí ĐỀ II Phần I: Trắc nghiệm (4 điểm) Hãy khoanh tròn vào một trong các chữ cái A, B, C hoặc D đứng trước câu trả lời đúng nhất Câu 1: Đốt khí Hiđro trong không khí sẽ có A. khói trắng B. ngọn lửa màu đỏ C. ngọn lửa màu xanh nhạt D. khói đen và hơi nước tạo thành Câu 2: Khí Hidro được bơm vào khinh khí cầu, bóng thám không vì Hidro là khí A. không màu. B. khí nhẹ nhất trong các loại khí. C. có tác dụng với Oxi trong không khí. D. ít tan trong nước. Câu 3: Khí Hidro cháy trong khí Oxi tạo ra nước. Muốn thu được 22,5 gam nước thì thể tích khí H2 (đktc) cần phải đốt là A. 24 lít B. 25 lít C. 26 lít D. 28 lít (Cho H = 1 ; O = 16) Câu 4: Phản ứng thế là phản ứng trong đó A. có chất mới được tạo thành từ 2 hay nhiều chất ban đầu. B. nguyên tử của đơn chất thay thế nguyên tử của 1 nguyên tố trong hợp chất. C. từ 1 chất ban đầu sinh ra nhiều chất mới. D. phản ứng xảy ra đồng thời sự oxi hóa và sự khử. Câu 5: Điều chế 2,4 gam Cu bằng cách dùng H2 khử CuO. Khối lượng CuO cần dùng là A. 3 g B. 4,5 g C. 6 g D. 1,5 g (Cho Cu = 64; O = 16) Câu 6: Dùng H2 để khử Fe2O3 thành Fe. Để điều chế được 3,5 gam Fe thì thể tích H2 (đktc) cần dùng là A. 4,2 lít B. 1,05 lít C. 2,6 lít D. 2,1 lít (Cho H = 1 ; O = 16 ; Fe = 56) Câu 7: Cho sơ đồ chuyển hóa: KMnO4 ot A Cu CuO B Cu. A và B lần lượt là A. MnO2 và H2O B. CO và O2 C. H2 và O2 D. O2 và H2 Câu 8: Thu khí Hidro bằng cách đẩy không khí ta phải úp ngược bình thu vì A. khí Hidro nặng hơn không khí. B. khí Hidro nhẹ hơn không khí. C. khí Hidro nặng bằng không khí. D. khí Hidro tác dụng với không khí. Câu 9: Nhóm các chất đều phản ứng được với khí Hidro là A. CuO, ZnO, H2O B. CuO, ZnO, O2 C. CuO, ZnO, H2SO4 D. CuO, ZnO, HCl Câu 10: Phản ứng KHÔNG PHẢI phản ứng thế là A. CuO + H2 Cu + H2O B. Mg + 2HClMgCl2 + H2 C. Ca(OH)2 + CO2 CaCO3 + H2O D. Zn + CuSO4 ZnSO4 + Cu Câu 11: Phản ứng thế là A. 3Fe +2O2 ot Fe3O4 B. 2Al + 6HCl 2AlCl3 + 3H2 C. 2KMnO4 otK2MnO4 + MnO2 + O2 D. BaO + H2O Ba(OH)2 Câu 12: Hỗn hợp khí nhẹ hơn không khí là A. H2 và CO2 B. H2 và N2 C. H2 và SO2 D. H2 và Cl2 (Cho biết: H=1; C=12; O=16; N=14; S=32; Cl=35,5) Câu 13: Phản ứng hóa học dùng để điều chế khí Hidro trong phòng thí nghiệm là A. Zn + H2SO4loãng ZnSO4 + H2 B. 2H2O ñieänphaân 2H2 + O2 C. 2Na + 2H2O 2NaOH + H2 D. C + H2O CO + H2 Câu 14: Kim loại thường được dùng để điều chế khí Hidro trong phòng thí nghiệm là A. Zn và Cu B. Al và Ag C. Fe và Hg D. Zn và Fe Câu 15: Khí H2 có tính khử vì A. khí H2 là khí nhẹ nhất. B. khí H2 chiếm Oxi của chất khác khi tham gia phản ứng hóa học. C. khí H2 là đơn chất. D. khí H2 được điều chế bằng phản ứng của kim loại tác dụng với dung dịch axit. Câu 16: Phản ứng giữa khí H2 với khí O2 gây nổ khi A. tỉ lệ về khối lượng của Hiđro và Oxi là 2 : 1 B. tỉ lệ về số nguyên tử Hiđro và số nguyên tử Oxi là 4 : 1 C. tỉ lệ về số mol Hiđro và Oxi là 1 : 2 D. tỉ lệ về thể tích Hiđro và Oxi là 2 : 1 Phần II: Tự luận (6 điểm) Câu 1 (2 điểm): Hoàn thành các phương trình hóa học sau và cho biết mỗi phản ứng thuộc loại nào? A. Al + O2 ot Al2O3 B. Al + H2SO4 Al2(SO4)3 + H2 C. KClO3 ot KCl + O2 D. Fe3O4 + CO ot Fe + CO2 Câu 2 (1 điểm): Có 3 lọ đựng riêng biệt các khí không màu là CO2, H2, O2. Hãy trình bày cách nhận biết các chất khí trong mỗi lọ. Câu 3 (3 điểm): Cho 33,6 gam Sắt vào bình chứa dung dịch axit clohđric. a. Viết phương trình hóa học của phản ứng. b. Tính khối lượng các sản phẩm tạo thành? VnDoc - Tải tài liệu, văn bản pháp luật, biểu mẫu miễn phí c. Nếu dùng toàn bộ lượng chất khí toàn vừa sinh ra ở phản ứng trên để khử 80 gam sắt (III) oxit thì sau phản ứng chất nào còn thừa và thừa bao nhiêu gam? (Cho Fe = 56 ; H = 1 ; Cl = 35,5 ; O= 16) ĐÁP ÁN KIỂM TRA VIẾT HÓA HỌC 8 TIẾT 53 TUẦN 28 NĂM HỌC 2012-2013 ĐỀ II I. Trắc nghiệm (4 điểm) Mỗi lựa chọn đúng đạt 0,25 điểm 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 C B D B A D D A B C B B A D B D II. Tự luận (6 điểm) Câu Đáp án Điểm Câu 1 (2 điểm) A. 4Al + 3O2 ot 2Al2O3 : phản ứng hóa hợp ; oxi hoá – khử (0,5đ) B. 2Al + 3H2SO4 Al2(SO4)3 + 3H2 : phản ứng thế (0,5đ) C. 2KClO3 ot 2KCl + 3O2 : phản ứng phân huỷ (0,5đ) D. Fe3O4 + 4CO ot 3Fe + 4CO2 : phản ứng oxi hoá – khử (0,5đ) Câu 2 (1 điểm) Cho tàn đóm đang cháy lần lượt vào từng lọ: (0,25đ) - Khí ở lọ nào làm que đóm tắt ngay là lọ chứa khí CO2 (0,25đ) - Khí ở lọ nào làm que đóm bùng cháy là lọ chứa khí O2 (0,25đ) - Khí ở lọ nào làm que đóm cháy với ngọn lửa màu xanh nhạt là lọ chứa khí H2 (0,25đ) Câu 3 (3 điểm) a. Fe + 2HCl FeCl2 + H2 (0,25đ)b. Fe + 2HCl FeCl2 + H2 1mol 2mol 1mol 1mol 0,6mol nFe phản ứng = 33,6 56 = 0,6 mol (0,25đ) 2FeCln tạo thành = 2Hn tạo thành = nFe phản ứng = 0,6 mol (0,25đ) 2FeClm tạo thành = 0,6 . 127 = 76,2 g (0,25đ) 2Hm tạo thành = 0,6 . 2 = 1,2 g (0,25đ) c. Fe2O3 + 3H2 ot 2Fe + 3H2O (0,25đ) 1mol 3mol 2mol 3mol 0,6mol 2 3Fe On ban đầu = 80160 = 0,5 mol (0,25đ) 2Hn ban đầu = 0,6mol Ta có tỉ lệ: 0,5 1 > 0,6 3 (0,25đ) Fe2O3 dư (0,25đ) 2 3Fe On phản ứng = 0,63 = 0,2mol (0,25đ) 2 3Fe On còn dư = 0,5 – 0,2 = 0,3mol (0,25đ) 2 3Fe Om còn dư = 0,3 . 160 = 48 g (0,25đ) ĐỀ III I. Phần trắc nghiệm. (3,0đ) Chọn và ghi ra giấy kiểm tra chữ cái đứng trước đáp án đúng. Câu 1. Trong không khí, khí nitơ chiếm tỉ lệ về thể tích là bao nhiêu? A. 1% B. 21% C. 49% D. 78% Câu 2. Khi thu khí hidro bằng cách đẩy không khí, người ta đặt bình như thế nào? VnDoc - Tải tài liệu, văn bản pháp luật, biểu mẫu miễn phí A. Miệng bình hướng lên, B. Miệng bình nằm ngang, C. Miệng bình úp xuống. Câu 3. Khi thu khí oxi bằng cách đẩy không khí, người ta đặt bình như thế nào? A. Miệng bình úp xuống, B. Miệng bình hướng lên, C. Miệng bình nằm ngang. Câu 4. Hợp chất tạo ra do oxitaxit tác dụng với nước thuộc loại chất nào? A. Axit B. Bazơ C. Muối Câu 5. Hợp chất tạo ra do oxitbazơ tác dụng với nước thuộc loại chất nào? A. Axit B. Bazơ C. Muối Câu 6. Ở nhiệt độ xác định, dung dịch muối ăn bão hòa có thể hòa tan thêm đường ăn không? A.Có B. Không. II. Phần tự luận. (7,0đ) Câu 7. Phát biểu các định nghĩa: phản ứng hóa hợp, phản ứng thế, phản ứng phân hủy. (1,5đ) Câu 8. Hoàn thành các sơ đồ phản ứng sau: (2,0đ) H2O H2 + O2 O2 + P P2O5 H2 +` Fe2O3 Fe + H2O H2O + Na NaOH + H2 Câu 9. a) Phát biểu định nghĩa axit, bazơ. Mỗi chất cho 1 ví dụ. (1,0đ) b) Hãy viết công thức tính khối lượng chất và thể tích chất khí ở đktc khi biết số mol.(1,0đ) Câu 10. Cho sơ đồ phản ứng: Al + HCl AlCl3 + H2 a) Hoàn thành sơ đồ phản ứng trên. (0,5đ) b) Nếu có 10,8 gam nhôm đã phản ứng thì thu được bao nhiêu lít khí hidro (ở đktc)?(1,0đ) Hết (Học sinh được sử dụng bảng hệ thống tuần hoàn) ĐÁP ÁN VÀ BIỂU ĐIỂM ĐỀ DỰ BỊ I. Phần trắc nghiệm. (3,0đ) Câu 1 2 3 4 5 6 Chọn D C B A B A Điểm 0,5 0,5 0,5 0,5 0,5 0,5 II. Phần tự luận. (7,0đ) Câu 7. – Phản ứng hóa hợp là phản ứng hóa học, trong đó có hai hay nhiều chất tham gia phản ứng nhưng chỉ tạo thành một chất mới (sản phẩm). (0,5đ) - Phản ứng phân hủy là phản ứng hóa học, trong đó có hai hay nhiều chất mới được tạo thành từ một chất ban đầu. (0,5đ) - Phản ứng thế là phản ứng hóa học giữa đơn chất và hợp chất, trong đó nguyên tử của đơn chất thay thế cho một nguyên tử của nguyên tố khác trong hợp chất. (0,5đ) (Có thể thay đổi cách diễn đạt nhưng vẫn đảm bảo nội dung của định nghĩa thì vẫn cho điểm). Câu 8. Hoàn thành các sơ đồ phản ứng: (2,0đ) 2H2O 2H2 + O2 5O2 + 4P 2P2O5 3H2 +` Fe2O3 2Fe + 3H2O VnDoc - Tải tài liệu, văn bản pháp luật, biểu mẫu miễn phí 2H2O+ 2Na 2NaOH + H2 Mỗi phương trình chọn hệ số đúng được 0,5 đ. Nếu chọn hệ số đúng nhưng chưa đầy đủ cho 0,25 đ. Nếu sai hoặc chưa làm thì không cho điểm. Câu 9. a) – Axit là hợp chất, phân tử gồm một hay nhiều nguyên tử hidro liên kết với gốc axit. Ví dụ: HCl (0,5đ) - Bazơ là hợp chất, phân tử gồm một nguyên tử kim loại liên kết với một hay nhiều nhóm hidroxit. Ví dụ: NaOH (0,5đ) b) Công thức tính khối lượng khi biết số mol: Công thức tính thể tích khi biết số mol: Câu 10. a) Hoàn thành sơ đồ phản ứng. (0,5đ) 2Al + 6HCl 2AlCl3 + 3H2 Nếu chọn hệ số đúng, đầy đủ cho 0,5 đ. Nếu chọn hệ số đúng nhưng chưa đầy đủ cho 0,25 đ. Nếu sai hoặc chưa làm thì không cho điểm. b) Thể tích khí hidro sinh ra ở đktc khi có 10,8 gam nhôm đã phản ứng. (1,0đ) Số mol của 10,8 gam nhôm = 27 8,10 = 0,4 mol (0,5đ) Theo phương trình phản ứng, số mol H2 = 3/2 số mol nhôm = 2 34,0 x = 0,6 mol (0,25đ) Thể tích của 0,6 mol khí hidro ở đktc = 0,6 x 22,4 = 13,44 lít. (0,25đ) (Học sinh có thể giải bài toán bằng cách khác, nếu đúng thì vẫn cho điểm tối đa). ĐỀ SỐ IV I. Tr¾c nghiÖm (3 ®). §iÒn vµo chç trèng nh÷ng c«ng thøc thÝch hîp. C©u 1 ( 2®): Trong c¸c hîp chÊt sau: Ca0, H2S04, Fe(0H)2; FeS04, HCl, Li0H, CaCl2, Al(0H)3 Mn02, S02, KHS04, HN03, nh÷ng hîp chÊt thuéc lo¹i a, «xit lµ: ....................................................... b, baz¬ lµ: ..................................................... c, muèi lµ: .................................................... d, axit lµ:....................................................... C©u 2(1®): Công thức hóa học của a/ Natri sunphat là :.. b/ Canxi hiđroxit là: c/ Axit photphoric là:... d/ Magie clorrua là:.. II. tù luËn ( 7 ®). C©u 1 (3 ®): ViÕt c¸c ph¬ng tr×nh thùc hiÖn chuyÓn hãa sau vµ cho biÕt mỗi ph¶n øng ®ã thuéc lo¹i ph¶n øng ho¸ häc nµo? a, Fe2O3 1 Fe 2 FeCl2. b, P 3 P205 4 H3P04 m = n x M V = n x 22,4 VnDoc - Tải tài liệu, văn bản pháp luật, biểu mẫu miễn phí ... ................................................................................................... C©u 2 (4®) : Cho mét hỗn hîp gåm 13g Zn vµ 5,4g Al t¸c dông hoµn toµn víi dung dÞch H2SO4. a, Viết các phương trình hóa học b, TÝnh thÓ tÝch khÝ H2 thu ®îc ë ®ktc. c, Tính thể tích dung dịch H2SO4 nồng độ 0,5M vừa đủ để hòa tan hỗn hợp trên. Cho Zn = 65; Al = 27 C©u 1 ( 2®): §iÒn ®óng mỗi lo¹i hîp chất ®îc 0,5 ® a, «xit lµ: Ca0, Mn02, S02. b, baz¬ lµ : Fe(0H)2, Li0H, Al(0H)3 . c, muèi lµ: FeS04, CaCl2,.KHS04. d, axit lµ: H2S04, HCl, HN03. C©u 2( 1®): §iÒn ®óng mỗi công thức được 0,25 ® a/ Natri sunphat là : Na2SO4 b/ Canxi hiđroxit là: Ca(OH)2 c/ Axit photphoric là: H3PO4 d/ Magie clorrua là: MgCl2 II. tù luËn ( 7 ®) C©u 1 (3®): ViÕt ®óng mỗi ph¶n øng 0,5 ® ph©n lo¹i ®óng 0,25 ®. NÕu c©n b»ng sai trõ 0,25 ® a, Fe203 1 Fe 2 FeCl2. b, P 3 P205 4 H3P04 1; Fe203 +3 H22 Fe +3 H20 P¦ thế 3; 4 P + 502 2P205 P¦ ho¸ hîp 2; Fe + 2 HCl FeCl2 + H2 P¦ thÕ 4; P205 +3 H202 H3P04 P¦ ho¸ hîp C©u 2(4®) : a/ Zn + H2SO4 ZnSO4 + H2 (1) 2 Al +3 H2SO4 Al2(SO4)3 +3 H2 (2) mỗi ptrhh ®óng 0,5 ® 1® b/ nZn = 13 : 65= 0,2( mol) nAl= 5,4 : 27 = 0,2 (mol) tÝnh ®óng nZn , nAl 0,25®0,5® nH 2 = nZn = 0,2 ( mol) nH 2 = 3/2. nAl = 0,3 ( mol) tÝnh ®óng nH 2 ë mỗi ptr 0,5 ®1® tæng sè mol H2: 0,2 +0,3 = 0,5 VH 2 = 0,5 . 22,4 = 11,2 lÝt 0,5® c; Tính thể tích dung dịch HCl nồng độ 0,5M vừa đủ để hòa tan hỗn hợp trên. - Tính đúng : nH2SO4 (ở 1)=0,2 mol 0,25® nH2SO4 (ở 2)=0,3 mol 0,25® tổng nH2SO4 (ở 1)=0,5 mol Vdd = n: CM= 0,5: 0,5 = 1(lít) 0,5® ĐỀ SỐ V I. tr¾c nghiÖm (3 ®). C©u 1(2®): §iÒn vµo chç trèng nh÷ng c«ng thøc thÝch hîp. Trong c¸c hîp chÊt sau: H3P04, Na20, H2S, Na0H, BaCl2, Al203, C02, Al(0H)3, Ca(HC03)2, Na3P04, Ca(0H)2, H2Si03 nh÷ng chÊt thuéc lo¹i a, «xit lµ: ....................................................... b, baz¬ lµ :................................................. c, muèi lµ: ..................................................... d, axit lµ:................................................... VnDoc - Tải tài liệu, văn bản pháp luật, biểu mẫu miễn phí C©u 2(1®): Công thức hóa học của a/ Kali hiđroxit là :.. b/ Canxi sunphat là: c/ Bari clorrua là:.. d/ Axit clohiđric là:.... II. tù luËn (7 ®). C©u 1(3 ®): ViÕt c¸c ph¬ng tr×nh thùc hiÖn chuyÓn hãa sau vµ cho biÕt mỗi ph¶n øng ®ã thuéc lo¹i ph¶n øng ho¸ häc nµo? a, Ca 1 Ca0 2 Ca(0H)2. b, Fe304 3 Fe 4 FeS04 C©u 2 (4 ®): Cho mét hỗn hîp gåm 4,8 gam Mg vµ 2,7g Al t¸c dông hoµn toµn víi dung dÞch H2SO4. a, ViÕt các ph¬ng tr×nh hãa häc. b, TÝnh thÓ tÝch khÝ H2 thu ®îc ë ®ktc. c, Tính thể tích dung dịch H2SO4 nồng độ 1M vừa đủ để hòa tan hỗn hợp trên. Cho Fe = 56 Al = 27 Cu = 64 O = 16 I. bµi tËp tr¾c nghiÖm (3 đ) C©u 1(2®): §iÒn ®óng mỗi lo¹i hîp chất ®îc 0,5 ® a, «xit lµ: Na20, Al203, C02. b, baz¬ lµ :Na0H, Al(0H)3, Ca(0H)2. c, muèi lµ BaCl2, Ca(HC03)2, Na3P04. d, axit lµ: H3P04, H2S, H2Si03 . C©u 2( 1®): §iÒn ®óng mỗi công thức được 0,25 ® a/ Kali hiđroxit là : KOH b/ Canxi sunphat là: CaSO4 c/ Bari clorrua là: BaCl2 d/ Axit clohiđric là: HCl II. tù luËn (7 ®) C©u 1(3 ®): ViÕt ®óng mçi ph¶n øng 0,5 ®, ph©n lo¹i ®óng 0,25 ®. NÕu c©n b»ng sai trõ 0,25 ® a, Ca 1 Ca0 2 Ca(0H)2. b, Fe304 3 Fe 4 FeS04 1; 2 Ca + 02 2Ca0 P¦ hãa hîp 3; 3 Fe +2 02 Fe304 P¦ hãa hîp 2; Ca0 + H20 Ca(0H)2 P¦ hãa hîp 4; Fe + H2S04 FeS04 + H2 P¦ thÕ C©u 2 (4 đ) a/ Mg + H2SO4MgSO4 + H2 (1) 2 Al +3 H2SO4 Al2(SO4)3 +3 H2 (2) mỗi ptrhh ®óng 0,5 ® 1® b/ nMg = 4,8 : 24= 0,2( mol) nAl= 2,7 : 27 = 0,1 (mol) tÝnh ®óng nFe , nAl 0,25 ®0,5® nH 2 = nMg = 0,2 ( mol) nH 2 = 3/2. nAl = 0,15 ( mol) tÝnh ®óng nH 2 ë mỗi ptr 0,5 ®1® tæng sè mol H2: 0,2 +0,15 = 0,35 VH 2 = 0,35 . 22,4 = 7,84 lÝt 0,5® c; Tính thể tích dung dịch HCl nồng độ 1M vừa đủ để hòa tan hỗn hợp trên. - Tính đúng : nH2SO4 (ở 1)=0,2 mol 0,25® nH2SO4 (ở 2)=0,15 mol 0,25® tổng nH2SO4 (ở 1)=0,35 mol Vdd = n: CM= 0,35: 1 = 0,35(lít) 0,5®
Tài liệu đính kèm:
 KIEM_TRA_HOA_HOC_8_KI_2.pdf
KIEM_TRA_HOA_HOC_8_KI_2.pdf





