Đề kiểm tra tiết 53, môn Hóa học 8
Bạn đang xem tài liệu "Đề kiểm tra tiết 53, môn Hóa học 8", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
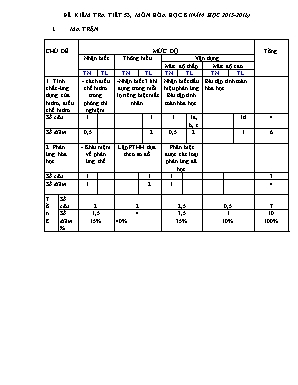
ĐỀ KIỂM TRA TIẾT 53, MÔN HÓA HỌC 8 (NĂM HỌC 2015-2016) MA TRẬN CHỦ ĐỀ MỨC ĐỘ Tổng Nhận biết Thông hiểu Vận dụng Mức độ thấp Mức độ cao TN TL TN TL TN TL TN TL 1. Tính chất -ứng dụng của hidro, điều chế hidro - cách điều chế hidro trong phòng thí nghiệm. -Nhận biết 3 khí đựng trong mỗi lọ riêng biệt mất nhãn Nhận biết dấu hiệu phản ứng Bài tập tính toán hóa học. Bài tập tính toán hóa học. Số câu 1 1 1 1a, b, c 1d 4 Số điểm 0,5 2 0,5 2 1 6 2. Phản ứng hóa học - Khái niệm về phản ứng thế Lập PTHH dựa theo sơ đồ Phân biệt được các loại phản ứng đã học Số câu 1 1 1 3 Số điểm 1 2 1 4 T ổ n g Số câu 2 2 2,5 0,5 7 Số điểm % 1,5 15% 4 40% 3,5 35% 1 10% 10 100% Họ và tên: . Môn: Hóa học 8 Lớp: 8A Bài kiểm tra một tiết( Tiết 53) Đề bài I/ TRẮC NGHIỆM (3đ) Câu 1: ( 0,5đ ) Dẫn khí hidro qua ống nghiệm đựng bột đồng II oxit đun nóng: Hiện tượng quan sát được trong ống nghiệm là: Chất rắn màu đen chuyển dần thàng màu nâu đỏ. Chất rắn màu đen chuyển dần thành màu nâu đỏ, hơi nước sinh ra trên thành ống nghiệm. Không có gì thay đổi. Câu 2: ( 0,5đ ) Cho các chất sau: : a, HCl và Zn . ; b, CO và H2O. ; c, H2SO4 và Fe . ; d, CH4 và H2O . Những cặp chất dùng để điều chế khí hidro trong phòng thí nghiệm là: A. a , b . B. b , c . C. a ,c . D. b, d . Câu 3: ( 1đ ) Nối ý ở cột A với ý ở cột B để được kết luận đúng A B to a/ Fe3O4 + 4H2 3Fe + 4H2O b/ Mg + 2HCl MgCl2 + H2 to c/ CaO + CO2 CaCO3 d/ 2KNO3 2KNO2 + 3O2 1/ Phản ứng phân hủy 2/ Phản ứng thế 3/Phản ứng hóa hợp Câu 4: ( 1đ ) Chọn từ hoặc cụm từ thích hợp điền vào chỗ trống: Phản ứng thế là phản ứng hóa học giữa (1) và .(2) Trong đó.(3) thay thế nguyên tử của nguyên tố trong..(4) II/ TỰ LUẬN : (7đ) Câu 1: (2đ) Cho các sơ đồ phản ứng chữ sau: t0 a/ Khí Hiđrô + Đồng (II) oxit 4 Đồng + Nước b/ Nhôm + Axit sunfuric 4 Nhôm sufat Al2(SO4)3 + Khí Hiđrô t0 c/ Photpho + Oxi 4 Điphotphopentaoxit b/ Canxicacbonat CaCO3 + Cacbon đioxit + Nước 4 Canxihiđrôcacbonat Ca(HCO3)2 Hãy lập PTHH của các phản ứng trên? Câu 2: (2đ) Có 3 lọ đựng riêng biệt các chất khí sau: không khí, khí Oxi, khí Hiđrô. Làm thế nào có thể nhận biết chất khí trong mỗi lọ? Câu 3( 3 điểm): Cho 13 gam kẽm phản ứng hoàn toàn với dung dịch axit clohiđric (HCl)dư, thu được muối kẽm clorua(ZnCl2) và khí hiđrô a, Viết phương trình hóa học Cho phản ứng trên. b, Xác định khối lượng muối kẽm clorua tạo thành. c, Tính thể tích hiđrô sinh ra ( đktc ). d, Nếu dùng toàn bộ lượng hiđrô thu được dùng để khử 12 gam bột CuO ở nhiệt độ cao thì chất nào còn dư ? dư bao nhiêu gam ? Biết Zn =65; Cl= 35,5; O= 16; H=1, Cu = 64. ĐÁP ÁN VÀ HƯỚNG DẪN CHẤM I/ TRẮC NGHIỆM (3đ) Câu 1: Chọn B (0,5đ) Câu 2: Chọn C (0,5đ) Câu 3: (1đ) Nối a-2 b-2 c-3 d-1 Câu 4: Đơn chất –hợp chất - nguyên tử của đơn chất – hợp chất (1đ) II/BÀI TẬP (7đ) Câu 1: (Mỗi câu đúng được 0,5đ) t0 a/ H2 + CuO -> Cu + H2O t0 b/ 2Al + 3H2SO4 -> Al2(SO4)3 + 3 H2 t0 c/ 4P + 5O2 -> 2P2O5 b/ CaCO3 + CO2 + H2O -> Ca(HCO3)2 Câu 2: Đưa que đóm đang cháy lên thành miệng của mỗi mẫu thử rồi quan sát Nếu thấy: (0,5đ) - Mẫu nào cháy có ngọn lửa màu xanh nhạt là khí H2 (0,5đ) - Đưa đóm cháy to hơn là khí O2(0,5đ) - Mẫu nào không có gì thay đổi là không khí (0,5đ) Câu 3: a. PTHH: Zn + 2HCl -> ZnCl2 + H2 (0,5đ) 0,2 0,4 0,2 0,2 (mol) nZn = 13/65 = 0,2 mol (0,5đ) b. mZnCl2 = 0,2. 136 = 27,2 g (0,5đ) c. vH2 = 0,2.22,4 = 4,48 lit (0,5đ) d. HS làm đúng được (1đ) ------------²²²²@&?²²²²-------------
Tài liệu đính kèm:
 DKT_HOA_8_TIET_53_20152016.doc
DKT_HOA_8_TIET_53_20152016.doc





