Đề kiểm tra cuối học kì I môn Hóa học Lớp 8 - Năm học 2022-2023 - Trường THCS Xuân Phương (Có đáp án)
Bạn đang xem tài liệu "Đề kiểm tra cuối học kì I môn Hóa học Lớp 8 - Năm học 2022-2023 - Trường THCS Xuân Phương (Có đáp án)", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
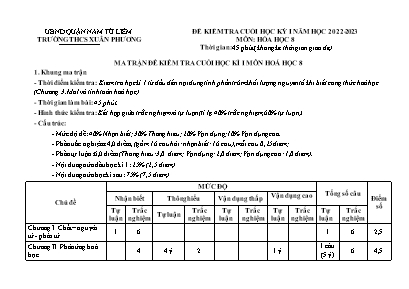
UBND QUẬN NAM TỪ LIÊM TRƯỜNG THCS XUÂN PHƯƠNG ĐỀ KIỂM TRA CUỐI HỌC KỲ I NĂM HỌC 2022-2023 MÔN: HÓA HỌC 8 Thời gian: 45 phút (không kể thời gian giao đề) MA TRẬN ĐỀ KIỂM TRA CUỐI HỌC KÌ I MÔN HOÁ HỌC 8 1. Khung ma trận - Thời điểm kiểm tra: Kiểm tra học kì 1 từ đầu đến nội dung tính phần trăm khối lượng nguyên tố khi biết công thức hoá học (Chương 3. Mol và tính toán hoá học) - Thời gian làm bài: 45 phút. - Hình thức kiểm tra: Kết hợp giữa trắc nghiệm và tự luận (tỉ lệ 40% trắc nghiệm, 60% tự luận). - Cấu trúc: - Mức độ đề: 40% Nhận biết; 30% Thông hiểu; 20% Vận dụng; 10% Vận dụng cao. - Phần trắc nghiệm: 4,0 điểm, (gồm 16 câu hỏi: nhận biết: 16 câu), mỗi câu 0,25 điểm; - Phần tự luận: 6,0 điểm (Thông hiểu: 3,0 điểm; Vận dụng: 2,0 điểm; Vận dụng cao: 1,0 điểm). - Nội dung nửa đầu học kì 1: 25% (2,5 điểm) - Nội dung nửa học kì sau: 75% (7,5 điểm) Chủ đề MỨC ĐỘ Tổng số câu Điểm số Nhận biết Thông hiểu Vận dụng thấp Vận dụng cao Tự luận Trắc nghiệm Tự luận Trắc nghiệm Tự luận Trắc nghiệm Tự luận Trắc nghiệm Tự luận Trắc nghiệm Chương I. Chất – nguyên tử - phân tử 1 6 1 6 2,5 Chương II. Phản ứng hoá học 4 4 ý 2 1 ý 1 câu (5 ý) 6 4,5 Chương III. Mol – tính toán hoá học 2 2 3 ý 1 câu (3 ý) 4 3,0 Số câu TN/ Số ý tự luận – số yêu cầu cần đạt 1 12 4 ý 4 3 ý 0 1 ý 0 3 câu (8 ý) 16 10 Điểm số 1,0 3,0 2,0 1,0 2,0 0 1,0 0 10 điểm 10 Tổng số điểm 4,0 điểm 3,0 điểm 2,0 điểm 1,0 điểm 10 điểm 10 điểm UBND QUẬN NAM TỪ LIÊM TRƯỜNG THCS XUÂN PHƯƠNG MÃ ĐỀ 01 ĐỀ KIỂM TRA CUỐI HỌC KỲ I NĂM HỌC 2022 - 2023 MÔN: HÓA HỌC 8 Thời gian: 45 phút (không kể thời gian giao đề) (Đề kiểm tra gồm:04 trang) Họ và tên học sinh: .. Lớp: 8A Phòng thi: I. Trắc nghiệm (4,0 điểm) Ghi đáp án đúng vào bảng dưới đây, mỗi câu đúng được 0,25 điểm Câu Đáp án Câu Đáp án Câu Đáp án Câu Đáp án 1 5 9 13 2 6 10 14 3 7 11 15 4 8 12 16 Câu 1. Cho phương trình hóa học A + B + C D + E. Biểu thức định luật bảo toàn khối lượng cho phản ứng trên là A. mA + mB = mC + mD + mE. B. mA + mB + mC + mD = mE. C. mA + mB + mC = mD + mE. D. mA = mB + mC + mD + mE. Câu 2. Điều nào sau đây là đúng khi nói về diễn biến của phản ứng hóa học? A. Số lượng nguyên tử thay đổi, liên kết giữa các phân tử nào thay đổi. B. Liên kết giữa các nguyên tử thay đổi làm cho phân tử này biến đổi thành phân tử khác còn số lượng nguyên tử mỗi nguyên tố không đổi. C. Phản ứng hóa học cần chất xúc tác để phản ứng xảy ra. D. Phản ứng hóa học là quá trình chất này biến đổi thành chất khác. Câu 3. Cho các hiện tượng: 1. Hòa tan mực vào nước. 2. Để sắt ngoài không khí, sau một thời gian thấy xuất hiện lớp chất rắn màu nâu đỏ bên ngoài thanh sắt. 3. Thanh đồng được kéo thành sợi nhỏ để làm dây điện. 4. Nung đá vôi trong lò vôi thu được khí cacbonđioxit và vôi sống (Canxi oxit) 5. Thuỷ tinh được đun nóng chảy ở to cao rồi thổi thành bóng đèn, lọ hoa, cốc. Hiện tượng hóa học là A. 1 và 4. B. 1 và 2. C. 2 và 5. D. 2 và 4. Câu 4. Hòa tan magie trong dung dịch axit clohiđric thu được magie clorua và khí hiđro. Phương trình chữ cho phản ứng trên là A. magie + axit clohiđric " magie clorua + khí hiđro B. axit clohiđric " magie clorua + khí hiđro C. magie " magie clorua + khí hiđro D. magie + axit clohiđric + magie clorua " khí hiđro Câu 5. Hiđro và oxi tác dụng với nhau tạo thành nước. Phương trình hoá học ở phương án nào dưới đây đã viết đúng? A. 2H + O H2O. B. H2 + O H2O. C. H2 + O2 2H2O. D. 2H2 + O2 2H2O Câu 6. Cho PTHH : Cacbon + khí Oxi khí Cacbonic. Cho biết phản ứng xảy ra hoàn toàn. Khối lượng của cacbon là 6 kg, khối lượng khí oxi là 16 kg. Khối lượng khí cacbonic là A. 18 kg. B. 10 kg. C. 22 kg. D. 12 kg. Câu 7. Để điều chế khí A, người ta lắp dụng cụ như hình vẽ: Khí A là khí nào trong số các khí sau (thì cách thu được cho là đúng)? A. O2. B. CO2. C. H2. D. SO2. Câu 8. Cho PTHH: 2Mg + O2 2MgO. Tỉ lệ giữa số nguyên tử Mg: số phân tử oxi (O2): số phân tử magie oxit (MgO) là A. 1:2:1. B. 2:1:2. C. 2:1:1. D. 2:2:1. Câu 9. Đá vôi có thành phần chính là canxi cacbonat (CaCO3), chất này có phân tử khối bằng A. 120đvC. B . 84đvC. C. 160đvC. D. 100đvC. Câu 10. Thể tích mol của chất khí phụ thuộc vào A. khối lượng mol của chất khí. B. nhiệt độ và áp suất của chất khí. C. bản chất, áp suất của chất khí. D. khối lượng riêng của chất khí. Câu 11. Cho các dãy chất sau: H2, NaOH, Cl2, CaCO3, CO2, N2, SO3, H2SO4, Fe, KCl. Dãy chất trên gồm có A. 5 đơn chất, 5 hợp chất. B. 7 đơn chất, 3 hợp chất. C. 4 đơn chất, 6 hợp chất. D. 3 đơn chất, 7 hợp chất. Câu 12. Natri hiđrocacbonat (A) còn gọi là “thuốc muối” là một trong những chất có mặt trong thành phần của thuốc chữa đau dạ dày. Khi phân tích A, người ta xác định trong A gồm có: 1Na, 1H, 1C, 3O. Công thức hóa học và phân tử khối của A lần lượt là? (Biết Na =23; H=1; C=12; O =16) A. NAHCO3; 84đvC. B. NaHCO3; 106đvC. C. NaHCO3; 84đvC. D. Na1H1C1O3; 106đvC Câu 13. Cho bảng sau Tên chất Đặc điểm cấu tạo Công thức hóa học Bari clorua 1Ba, 2Cl (1) Nhôm oxit 2Al, 3O (2) Kali sunfat 2K, 1S, 4O (3) Công thức hóa học của (1) ; (2) ; (3) là A. Ba2Cl, Al2O3, K2SO4. B. BaCl2, 2AlO3, K2SO4. C. 2BaCl, 2AlO3, K2SO4. D. BaCl2, Al2O3, K2SO4. Câu 14. Ký hiệu hoá học của nguyên tố Bari, Nitơ, Argon, Mangan lần lượt là A. K, O, Ne, Cl. B. C, S, Al, Cl. C. Ba, Ni, Ar, Zn. D. Ba, N , Ar, Mn. Câu 15. Cách viết 5Ag, 15O có ý nghĩa A. 5 nguyên từ Nhôm và 15 nguyên tử Oxi. B. 5 nguyên tử Bạc và 15 nguyên tử Oxi. C. 5 nguyên tử Agon và 15 nguyên tử Oxi. D. 5 nguyên tử Chì và 15 nguyên tử Oxi. Câu 16. Biểu thức quy tắc hóa trị khi có công thức hóa học A. x.a=y.b B. x.y= a.b. C. x.b= y.a D. a.y= b.x. II. Tự luận (6,0 điểm) Câu 1 (1,0 điểm). Hoàn thiện bảng sau: Tên chất Đặc điểm cấu tạo Công thức hoá học Phân tử khối (đvC) Bari sunfat 1Ba, 1S, 4O Nhôm oxit Al2O3 Biết H= 1; O= 16; C= 12; S= 32; Ba= 137 Câu 2 (3,0 điểm). Lập phương trình hoá học: 2.1. (2,0 điểm) Cân bằng PTHH cho các sơ đồ phản ứng sau: a. Fe2O3 + H2 4 Fe + H2O . . . b. Al2O3 + H2SO4 4 Al2(SO4)3 + H2O . . . c. Cu + O2 4 CuO . . . d. FeO + HCl 4 FeCl2 + H2O . . . 2.2. (1,0 điểm) Cho sơ đồ phản ứng sau: Al + H2SO4 4 Alx(SO4)y + H2. 1. Dựa vào quy tắc hoá trị xác định chỉ số x, y 2. Lập phương trình hoá học cho phản ứng trên . . . .. . . . . . . Câu 2 (2,0 điểm). 1. Tính thể tích ở đktc của: 0,44 g khí cacbonic (CO2). . . . . . . 2. Tính số phân tử NO2 có trong: 44,8 lít khí NO2 (ở đktc). . . . . . . 3. Tính tổng khối lượng của: 0,3 x 1023 phân tử FeCl2 và 0,1 mol MgCl2. . . . . . . . . (Cho: H = 1; C = 12 ; N=14; O = 16 ; Na = 23; Mg= 24; Al = 27; Si =28; P =31; S = 32; N = 14; Cl = 35,5; Fe= 56; Cu=64; Zn = 65) ---------------Hết--------------- (Giám thị coi thi không giải thích gì thêm) UBND QUẬN NAM TỪ LIÊM TRƯỜNG THCS XUÂN PHƯƠNG MÃ ĐỀ 02 ĐỀ KIỂM TRA CUỐI HỌC KỲ I NĂM HỌC 2022 - 2023 MÔN: HÓA HỌC 8 Thời gian: 45 phút (không kể thời gian giao đề) (Đề kiểm tra gồm: 04 trang) Họ và tên học sinh: .. Lớp: 8A Phòng thi: I. Trắc nghiệm (4,0 điểm) Ghi đáp án đúng vào bảng dưới đây, mỗi câu đúng được 0,25 điểm Câu Đáp án Câu Đáp án Câu Đáp án Câu Đáp án 1 5 9 13 2 6 10 14 3 7 11 15 4 8 12 16 Câu 1. Cho phương trình hóa học A + B D + C + E. Biểu thức định luật bảo toàn khối lượng cho phản ứng trên là A. mA + mB = mC + mD + mE. B. mA + mB + mC + mD = mE. C. mA + mB + mC = mD + mE. D. mA = mB + mC + mD + mE. Câu 2. Cho sơ đồ tượng trưng phản ứng giữa nguyên tử Magie (Mg) và axit clo hiđric (HCl) như sau: → + Liên kết nào bị cắt đứt là A. H-Cl B. Mg-Mg C. H-H D. Cl-Mg-Cl Câu 3. Hiện tượng nào là hiện tượng hoá học trong các hiện tương thiên nhiên sau đây? A. Sáng sớm, khi mặt trời mọc sương mù tan dần. B. Hơi nước trong các đám mây ngưng tụ và rơi xuống tạo ra mưa. C. Nạn cháy rừng tạo khói đen dày đặc gây ô nhiễm môi trường. D. Khi mưa giông thường có sấm sét. Câu 4. Hòa tan hoàn toàn kẽm trong dung dịch axit clohiđric thu được kẽm clorua và khí hiđro. Phương trình chữ cho phản ứng trên là A. Kẽm + axit clohiđric " Kẽm clorua + khí hiđro B. axit clohiđric " Kẽm clorua + khí hiđro C. Kẽm " Kẽm clorua + khí hiđro D. Kẽm + axit clohiđric + Kẽm clorua " khí hiđro Câu 5. Đốt photpho(P) trong khí oxi(O2) thu được điphotphopentaoxit (P2O5). Phương trình phản ứng nào sau đây đã viết đúng? A. 2P + 5O2 P2O5. B. 2P + O2 P2O5. C. 2P + 5O2 2P2O5. D. 4P + 5O2 2P2O5. Câu 6. Cho PTHH : Lưu huỳnh + khí Oxi khí Lưu huỳnh đioxit. Cho biết phản ứng xảy ra hoàn toàn và khối lượng của lưu huỳnh là 16 kg, khối lượng khí lưu huỳnh đioxit là 32kg. Khối lượng khí oxi là A. 16 kg. B. 8kg. C. 64 kg. D. 12 kg. Câu 7. Để điều chế khí T, người ta lắp dụng cụ như hình vẽ: Khí T là khí nào trong số các khí sau (thì cách thu được cho là đúng)? A. O2. B. CO2. C. H2. D. SO2. Câu 8. Cho PTHH: 2Cu + O2 2CuO. Tỉ lệ giữa số nguyên tử Cu: số phân tử oxi (O2): số phân tử đồng (II) oxit (CuO) là A. 1:2:1. B. 2:1:2. C. 2:1:1. D. 2:2:1. Câu 9. Quặng Đôlômit có thành phần chính là magie cacbonat (MgCO3), chất này có phân tử khối bằng A. 106g. B . 84g. C. 106đvC. D. 84đvC. Câu 10. Thể tích mol của chất khí phụ thuộc vào A. khối lượng mol của chất khí. B. nhiệt độ và áp suất của chất khí. C. bản chất, áp suất của chất khí. D. khối lượng riêng của chất khí. Câu 11. Cho các dãy chất sau: H2, NaOH, Cl2, CaCO3, CO2, N2, SO3, H2SO4, Fe, O2. Dãy chất trên gồm có A. 5 đơn chất, 5 hợp chất. B. 7 đơn chất, 3 hợp chất. C. 4 đơn chất, 6 hợp chất. D. 3 đơn chất, 7 hợp chất. Câu 12. Bột thạch cao khan được dùng trong công nghiệp xi măng, tấm thạch cao, gạch men, giấy kĩ thuậtBiết thành phần chính của thạch cao khan là canxi sunfat, trong phân tử gồm có 1Ca. 1S, và 4O. Hãy xác định CTHH của canxi sunfat và phân tử khối của hợp chất? (Biết O = 16; S = 32; Ca = 40) A. CaSO4; 156đvC. B. Ca1S1O4; 126đvC. C. Ca1S2O4; 136đvC. D. CaSO4; 136đvC. Câu 13. Cho bảng sau Tên chất Đặc điểm cấu tạo Công thức hóa học Sắt (III) clorua 1Fe, 3Cl (1) Natri oxit 1Na, 2O (2) Kali sunfat 2K, 1S, 4O (3) Công thức hóa học của (1) ; (2) ; (3) là A. Fe3Cl, Na2O3, K2SO4. B. FeCl2, NaO2, K2SO4. C. FeCl3, 2NaO, K2SO4. D. FeCl3, Na2O, K2SO4. Câu 14. Ký hiệu hoá học của nguyên tố Bari, Neon, đồng, Magie lần lượt là A. Be, Ne, Cu, Mn. B. B, S, Ni, Mg. C. Ba, Ne, Cu, Mg. D. Ba, Na , Cu, Mg. Câu 15. Cách viết 8O, 14Mn có ý nghĩa A. 8 nguyên tử Chì và 14 nguyên tử Oxi. B. 8 nguyên tử Oxi và 14 nguyên tử Magie. C. 8 nguyên tử Oxi và 14 nguyên tử Mangan. D. 8 nguyên tử Oxi và 14 nguyên tử Bạc. Câu 16. Ý nghĩa của công thức hóa học không cho biết A. nguyên tố tạo nên chất. B. phân tử khối. C. tính chất của chất. D. số lượng nguyên tử mỗi nguyên tố trong một phân tử. II. Tự luận (6,0 điểm) Câu 1 (1,0 điểm). Hoàn thiện bảng sau: Tên chất Đặc điểm cấu tạo Công thức hoá học Phân tử khối (đvC) Canxi cacbonat CaCO3 Sắt (III) oxit 2Fe, 3O Biết H= 1; O= 16; C= 12; Ca = 40 ; Fe = 56 Câu 2 (3,0 điểm). Lập phương trình hoá học 2.1. (2,0 điểm) Cân bằng PTHH cho các sơ đồ phản ứng sau: a. Fe3O4 + H2 4 Fe + H2O . . . b. Fe2O3 + H2SO4 4 Fe2(SO4)3 + H2O . . . c. Mg + O2 4 MgO . . . d. ZnO + HCl 4 ZnCl2 + H2O . . . 2.2. (1,0 điểm) Cho sơ đồ phản ứng sau: Al + HCl 4 AlxCly + H2. 1. Dựa vào quy tắc hoá trị xác định chỉ số x, y 2. Lập phương trình hoá học cho phản ứng trên . . . .. . . . . . . Câu 2 (2,0 điểm). 1. Tính thể tích ở đktc của: 0,64 g khí lưu huỳnh đioxit (SO2). . . . . . . 2. Tính số phân tử CO2 có trong: 44,8 lít khí CO2 (ở đktc). . . . . 3. Tính tổng khối lượng của: 0,6 x 1023 phân tử FeCl2 và 0,2 mol MgCl2. . . . . . . . . . (Cho: H = 1; C = 12 ; N=14; O = 16 ; Na = 23; Mg= 24; Al = 27; Si =28; P =31; S = 32; N = 14; Cl = 35,5; Fe= 56; Cu=64; Zn = 65) ---------------Hết--------------- (Giám thị coi thi không giải thích gì thêm) UBND QUẬN NAM TỪ LIÊM TRƯỜNG THCS XUÂN PHƯƠNG ĐÁP ÁN ĐỀ KT CUỐI HỌC KỲ I NĂM HỌC 2022 - 2023 MÔN: HÓA HỌC 8 Đáp án đề kiểm tra gồm 03 trang Đáp án và thang điểm: MÃ ĐỀ 01 I. Trắc nghiệm khách quan (5,0 điểm) Mỗi câu đúng: 0,25 điểm (20*0,25 = 5 điểm) Câu Đáp án Câu Đáp án Câu Đáp án Câu Đáp án 1 C 5 D 9 D 13 D 2 B 6 C 10 B 14 D 3 D 7 C 11 C 15 B 4 A 8 B 12 C 16 A II. Tự luận (5,0 điểm) Câu Ý Đáp án Điểm 1 (1,0 điểm) Tên chất Đặc điểm cấu tạo Công thức hoá học Phân tử khối (đvC) Bari sunfat 1Ba, 1S, 4O BaSO4 233 Nhôm oxit 2Al ; 3O Al2O3 120 - Mỗi chỗ trống điền đúng 0,25 điểm 0,25 *4 = 1,0 2 (3,0 điểm) 2.1 Cân bằng đúng 4 PTHH: a. Fe2O3 + 3H2 " 2 Fe + 3H2O b. Al2O3 + 3H2SO4 " Al2(SO4)3 + 3H2O c. 2Cu + O2 " 2 CuO d. FeO + 2HCl " FeCl2 + H2O Cân bằng chưa rút gọn hệ số - 0,25 điểm; chưa chuyển mũi tên đứt thành liền – 0,25 điểm 0,5*4 = 2,0 2.2 Al + H2SO4 4 Alx(SO4)y + H2. - Có Al (III) và nhóm (SO4) (II). Theo quy tắc hoá trị xác định được x = 2; y =3. CTHH là Al2(SO4)3 0,5 - PTHH: 2Al + 3H2SO4 " Al2(SO4)3 + 3H2 0,5 3 (2,0 điểm) a Tính số mol CO2 = 0,01 mol 0,25 Thể tích = 0,01 * 22,4 = 0,224 lít (đktc) 0,25 b Tính số mol NO2 = 2 mol Tính số phân tử NO2 = 2x6.1023 = 12. 1023 phân tử 0,25 0,25 c Tính số mol FeCl2 = 0,05 mol Tính khối lượng FeCl2 = 0,05 * 127 = 6,35 gam 0,25 0,25 nMgCl2 = 0,1 mol "mMgCl2 = 0,1 * 95 = 9,5 gam Tổng khối lượng = 6,35+9,5 = 15,85g 0,25 0.25 Đáp án và thang điểm: MÃ ĐỀ 02 I. Trắc nghiệm khách quan (5,0 điểm) Mỗi câu đúng: 0,25 điểm (20*0,25 = 5 điểm) Câu Đáp án Câu Đáp án Câu Đáp án Câu Đáp án 1 A 5 D 9 D 13 D 2 A 6 A 10 B 14 C 3 C 7 C 11 A 15 C 4 A 8 B 12 D 16 C II. Tự luận (5,0 điểm) Câu Ý Đáp án Điểm 1 (1,0 điểm) Tên chất Đặc điểm cấu tạo Công thức hoá học Phân tử khối (đvC) Canxi cacbonat 1Ca, 1C, 3O CaCO3 100 Sắt (III) oxit 2Fe, 3O Fe2O3 160 0,25 *4 = 1,0 2 (3,0 điểm) 2.1 Cân bằng đúng 4 PTHH và ghi đúng tỉ lệ a. Fe3O4 + 4H2 " 3Fe + 4H2O b. Fe2O3 + 3H2SO4 " Fe2(SO4)3 + 3H2O c. 2Mg + O2 " 2 MgO d. ZnO + 2HCl " ZnCl2 + H2O Cân bằng chưa rút gọn hệ số - 0,25 điểm; chưa chuyển mũi tên đứt thành liền – 0,25 điểm 0,5*4 = 2,0 2.2 Al + HCl 4 AlxCly + H2. - Có Al (III) và Cl (I). Theo quy tắc hoá trị xác định được x = 1; y =3. CTHH là AlCl3 0,5 - PTHH: 2Al + 6HCl " 2AlCl3 + 3H2 0,5 2 (2,0 điểm) a Tính số mol SO2 = 0,01 mol 0,25 Tính thể tích = 0,01 * 22,4 = 0,224 lít (đktc) 0,25 b Tính số mol CO2 = 2 mol Tính số phân tử CO2 = 2x6.1023 = 12. 1023 phân tử 0,25 0,25 c Tính số mol FeCl2 = 0,1 mol Tính khối lượng FeCl2 = 0,1 * 127 = 12,7gam 0,25 0,25 số mol MgCl2 = 0,2 mol " Tính khối lượng MgCl2 = 0,2 * 95 = 19 gam Tổng khối lượng là = 12,7 + 19 = 31,7gam 0,25 0,25 Ngày tháng năm 2022 BGH TTCM Phí Thị Kim Oanh NHÓM GIÁO VIÊN Trần Thị Thu Huyền Nghiêm Thị Thuỳ Lương Nguyễn Thanh Hậu
Tài liệu đính kèm:
 de_kiem_tra_cuoi_hoc_ki_i_mon_hoa_hoc_lop_8_nam_hoc_2022_202.doc
de_kiem_tra_cuoi_hoc_ki_i_mon_hoa_hoc_lop_8_nam_hoc_2022_202.doc






