Đề kiểm tra một tiết số 4 môn: Hóa học khối 10
Bạn đang xem tài liệu "Đề kiểm tra một tiết số 4 môn: Hóa học khối 10", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
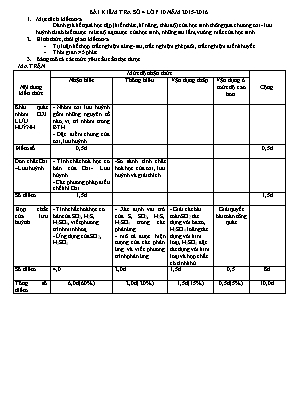
BÀI KIỂM TRA SỐ 4 LỚP 10 NĂM 2015-2016 Mục đích kiểm tra Đánh giá kết quả học tập (kiến thức, kĩ năng, thái độ) của học sinh thông qua chương oxi- lưu huỳnh từ đó biết được mức độ đạt được của học sinh, những sai lầm, vướng mắc của học sinh Hình thức, thời gian kiểm tra Tự luận kết hợp trắc nghiệm đúng- sai, trắc nghiệm ghép đôi, trắc nghiệm điền khuyết Thời gian: 45 phút Bảng mô tả các mức yêu cầu cần đạt được MA TRẬN Nội dung kiến thức Mức độ nhận thức Cộng Nhận biết Thông hiểu Vận dụng thấp Vận dụng ở mức độ cao hơn Khái quát nhóm OXI LƯU HUỲNH - Nhóm oxi lưu huỳnh gồm những nguyên tố nào; vị trí nhóm trong BTH - Đặc điểm chung của oxi, lưu huỳnh Điểm số 0,5đ 0,5đ Đơn chất Oxi –Lưu huỳnh - Tính chất hoá học cơ bản của Oxi- Lưu hùynh - Các phương pháp điều chế khí Oxi -So sánh tính chất hoá học của oxi, lưu huỳnh và giải thích Số điểm 1,5đ 1,5đ Hợp chất của lưu huỳnh - Tính chất hoá học cơ bản của SO2, H2S, H2SO4, viết phương trình minh hoạ - Ứng dụng của SO2, H2SO4 - Xác định vai trò của S, SO2, H2S, H2SO4 trong các phản ứng - mô tả được hiện tượng của các phản ứng và viết phương trình phản ứng - Giải các bài toán SO2 tác dụng với bazơ, H2SO4 loãng tác dụng với kim loại, H2SO4 đặc tác dụng với kim loại và hợp chất có tính khử Giải quyết bài toán tổng quát Số điểm 4,0 2,0đ 1,5đ 0,5 8đ Tổng số điểm 6,0đ(60%) 2,0đ( 20%) 1,5đ(15%) 0,5đ(5%) 10,0đ Sở Giáo Dục và Đào Tạo Đăklăk ĐỀ KIỂM TRA MỘT TIẾT SỐ 4 NĂM HỌC 2015-2016 Trường PTTH Quang Trung Môn: Hóa Học Khối 10 ------***------ Thời gian 45 phút (Đề có 02 trang) Họ và Tên: Lớp: . Điểm Chữ kí GT: ( Học làm trực tiếp vào đề và không được sử dụng bảng hệ thống tuần hoàn) (1đ) Viết công thức hoá học của những chất có tên sau: a. Khí sunfurơ: .. c. Natri sunfat: ... b. Axit sunfuhiđric: ... d. Lưu huỳnh trioxit: .. (2,5đ) Hoàn thành các phương trình hoá học sau: S + O2 Fe + H2SO4 loãng H2S + SO2 Fe3O4 + H2SO4đặc SO2 + Br2 + H2O (2,0đ) Viết phương trình hoá học xảy ra trong các trường hợp sau: Phản ứng điều chế oxi trong phòng thí nghiệm . Khi nhỏ dung dịch bari nitrat vào dung dịch axit sunfuric . Khi nhỏ dung dịch chì nitrat vào dung dịch natri sunfua . Cho kim loại đồng vào axit sunfuric đặc nóng . (0,75đ) Hoà tan hoàn toàn 5,4g kim loại nhôm vào dd H2SO4 loãng dư, sau phản ứng thu được V lít khí H2 (đktc). Viết phương trình hoá học xảy ra. b. Tính giá trị V. . . . . (0,75đ) Trong 4 chất: S, SO2, H2S, H2SO4. Chất chỉ thể hiện tính oxi hoá là .. Chất chỉ thể hiện tính khử là Chất có tính oxi hoá và tính khử là . (1đ) Sục khí A vào dung dịch muối Na2SO3, thu được dung dịch chứa một muối B duy nhất. Cho B tác dụng với dung dịch axit D, lại tạo ra khí A. Khi cho khí A tác dụng với dung dịch brom cũng tạo ra axit D. Tìm A, B, D và viết các phương trình hóa học của các phản ứng đã xảy ra. . . . . . . (0,5đ) Có 3 bình, mỗi bình đựng một chất khí là H2S, SO2 và O2. Hãy trình bày phương pháp hoá học phân biệt chất khí đựng trong mỗi bình., viết phương trình hoá học nếu có. . . . . (0,5đ)Khi cho kim loại tác dụng với H2SO4 đặc, nóng, nếu sản phẩm khử chỉ là SO2 thì luôn có biểu thức: . Chứng minh biểu thức đã cho. . . . . (0,5đ) Hấp thụ hoàn toàn V lít SO2 (đktc) vào 400ml dd NaOH 1M thu được dd X chứa 22,9 gam chất tan. Tính giá trị V. . . . . . . . . . (0,5đ) Cho 16 gam hỗn hợp A gồm Fe, FeO, Fe3O4, Fe2O3 tác dụng hoàn toàn với dung dịch H2SO4 đặc nóng dư thu được 5,6 lít khí SO2 ( đktc ) và dung dịch X. Tính số mol H2SO4 đã phản ứng ? (trình bày ngắn gọn, không cần viết phương trình hoá học) . . . . . . . . ĐÁP ÁN HOÁ 10 LẦN 4 (1đ) Viết công thức hoá học của những chất có tên sau: a. Khí sunfurơ: SO2 (0,25đ).. c. Natri sunfat: Na2SO4... (0,25đ) b. Axit sunfuhiđric: H2S...(0,25đ) d. Lưu huỳnh trioxit: SO3 ..(0,25đ) (2,5đ) Hoàn thành các phương trình hoá học sau: S + O2 SO2 (0,5đ) Fe + H2SO4 loãng FeSO4 + H2 (0,5đ) 2H2S + SO2 3S + 2H2O (0,5đ) 2Fe3O4 + 10 H2SO4đặc 3Fe2(SO4)3 + SO2 + 10 H2O (0,5đ) SO2 + Br2 + 2H2O H2SO4 + 2 HBr (0,5đ) (2,0đ) Viết phương trình hoá học xảy ra trong các trường hợp sau: Phản ứng điều chế oxi trong phòng thí nghiệm 2KMnO4 K2MnO4 + O2 + MnO2 . (0,5đ) Khi nhỏ dung dịch bari nitrat vào dung dịch axit sunfuric Ba(NO3)2 + H2SO4 BaSO4 + 2HNO3 . (0,5đ) Khi nhỏ dung dịch chì nitrat vào dung dịch natri sunfua Pb(NO3)2 +Na2S PbS + 2NaNO3. (0,5đ) Cho kim loại đồng vào axit sunfuric đặc nóng Cu + 2H2SO4 CuSO4 + SO2 + 2H2O. (0,5đ) (0,75đ) Hoà tan hoàn toàn 5,4g kim loại nhôm vào dd H2SO4 loãng dư, sau phản ứng thu được V lít khí H2 (đktc). Viết phương trình hoá học xảy ra. b. Tính giá trị V. Giải: 2Al + 3 H2SO4 Al2(SO4)3 + 3H2 . (0,25đ) (0,5đ) (0,75đ) Trong 4 chất: S, SO2, H2S, H2SO4. Chất chỉ thể hiện tính oxi hoá là H2SO4.. (0,25đ) Chất chỉ thể hiện tính khử là H2S (0,25đ) Chất có tính oxi hoá và tính khử là S, SO2. (0,25đ) (1đ) Sục khí A vào dung dịch muối Na2SO3, thu được dung dịch chứa một muối B duy nhất. Cho B tác dụng với dung dịch axit D, lại tạo ra khí A. Khi cho khí A tác dụng với dung dịch brom cũng tạo ra axit D. Tìm A, B, D và viết các phương trình hóa học của các phản ứng đã xảy ra. Giải SO2 + Na2SO3 + H2O NaHSO3 (0,25đ) 2NaHSO3 + H2SO4 Na2SO4 + 2SO2 + 2H2O (0,25đ) SO2 + Br2 + 2H2O H2SO4 + 2 HBr (0,25đ) Vậy A là SO2; B là NaHSO3 ; D là H2SO4 (0,25đ) (0,5đ) Có 3 bình, mỗi bình đựng một chất khí là H2S, SO2 và O2. Hãy trình bày phương pháp hoá học phân biệt chất khí đựng trong mỗi bình., viết phương trình hoá học nếu có. Giải: Cho quì tím ẩm vào các mẫu thử, mẫu khí làm quì tím hoá hồng là SO2, còn lại H2S và O2. (0,25đ) Dẫn 2 khí còn lại vào dd Pb(NO3)2, nếu thấy kết tủa đen là H2S, còn lại là O2 (0,25đ) Pb(NO3)2 +H2S PbS + 2HNO3. (0,5đ)Khi cho kim loại tác dụng với H2SO4 đặc, nóng, nếu sản phẩm khử chỉ là SO2 thì luôn có biểu thức: . Chứng minh biểu thức đã cho. (0,25đ) Bảo toàn nguyên tố lưu huỳnh: (0,25đ) ( HS có thể viết phương trình tổng quát và rút ra biểu thức trên thì cũng cho điểm tối đa) (0,5đ) Hấp thụ hoàn toàn V lít SO2 (đktc) vào 400ml dd NaOH 1M thu được dd X chứa 22,9 gam chất tan. Tính giá trị V. Nếu sản phẩm là Na2SO3 thì Nếu sản phẩm là NaHSO3 thì Theo gt: khối lượng chẩt rắn bằng 22,9g nên sản phẩm là Na2SO3 (x mol) và NaOH dư (y mol) (0,25đ) BT Natri: 2x+ y =0,4 và 126x + 40y= 22,9 x=0,15 ; y= 0,1 (0,25đ) (0,5đ) Cho 16 gam hỗn hợp A gồm Fe, FeO, Fe3O4, Fe2O3 tác dụng hoàn toàn với dung dịch H2SO4 đặc nóng dư thu được 5,6 lít khí SO2 ( đktc ) và dung dịch X. Tính số mol H2SO4 đã phản ứng ? (trình bày ngắn gọn, không cần viết phương trình hoá học) Giải: Giả sử hỗn hợp là Fe (x mol) và O (ymol) 56x + 16y = 16 Bảo toàn e: 3x – 2y= 0,25.2 (0,25đ) x= 0,25 và y= 0,125 Vậy (0,25đ)
Tài liệu đính kèm:
 kt_10.doc
kt_10.doc





