Đề kiểm tra học kỳ II môn: Hóa học lớp: 8
Bạn đang xem tài liệu "Đề kiểm tra học kỳ II môn: Hóa học lớp: 8", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
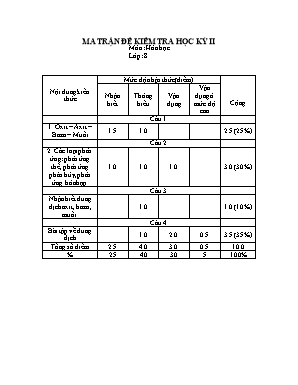
MA TRẬN ĐỀ KIỂM TRA HỌC KỲ II Môn: Hóa học Lớp: 8 Nội dung kiến thức Mức độ nhận thức(điểm) Cộng Nhận biết Thông hiểu Vận dụng Vận dụng ở mức độ cao Câu 1 1. Oxit – Axit – Bazo – Muối 1.5 1.0 2.5 (25%) Câu 2 2. Các loại phản ứng: phản ứng thế, phản ứng phân hủy, phản ứng hóa hợp 1.0 1.0 1.0 3.0 (30%) Câu 3 Nhận biết dung dịch axit, bazo, muối. 1.0 1.0 (10%) Câu 4 Bài tập về dung dịch 1.0 2.0 0.5 3.5 (35%) Tổng số điểm 2.5 4.0 3.0 0.5 10.0 % 25 40 30 5 100% ĐỀ KIỂM TRA HỌC KỲ II – NĂM 2011-2012 Môn: Hóa học – Lớp 8 Thời gian: 45 phút Đề 01 Câu 1: (2,5đ) Hãy đánh dấu vào bảng phân loại các hợp chất có CTCT sau và gọi tên chúng: TT CTHH Phân loại Tên gọi Oxit Axit Bazo Muối 1 Fe(OH)3 2 CO2 3 CaO 4 H2SO4 5 CuCl2 Câu 2: (2đ) Điền chất thích hợp rồi hoàn thành các phương trình phản ứng theo sơ đồ sau: a. CaCO3 CaO + CO2 b. Zn + HCl ZnCl2 + . c. . + O2 CuO d. Na + H2O . + H2 Các phương trình phản ứng trên thuộc loại phản ứng thế, phản ứng hóa hợp, hay phản ứng phân hủy? Câu 3: (1đ) Bằng phương pháp hóa học, hãy nhận biết các dung dịch đựng trong các lọ mất nhãn sau: H2SO4, NaOH, BaCl2. Câu 4: ( 4,5đ) Hòa tan hoàn toàn 6,2g Natri oxit vào 100ml nước cất (d = 1g/ml), thu dược dung dịch X . Viết PTHH xảy ra? Tính CM các chất trong dung dịch X? Tính C% các chất trong dung dịch X? Nếu thay 6,2 gam Na2O bằng 6,2g Na thì C% của các chất trong dd X có thay đổi không? Vì sao? ĐỀ KIỂM TRA HỌC KỲ II – NĂM 2011-2012 Môn: Hóa học – Lớp 8 Thời gian: 45 phút Đề 02 Câu 1: (2,5đ) Hãy đánh dấu vào bảng phân loại các hợp chất có CTCT sau và gọi tên chúng: TT CTHH Phân loại Tên gọi Oxit Axit Bazo Muối 1 Fe(OH)2 2 SO2 3 BaO 4 H2SO3 5 AgNO3 Câu 2: (2đ) Điền chất thích hợp rồi hoàn thành các phương trình phản ứng theo sơ đồ sau: a. KClO3 KCl + O2 b. Fe + HCl FeCl2 + . c. . + O2 Fe3O4 d. K + H2O . + H2 Các phương trình phản ứng trên thuộc loại phản ứng thế, phản ứng hóa hợp, hay phản ứng phân hủy? Câu 3: (1đ) Bằng phương pháp hóa học, hãy nhận biết các dung dịch đựng trong các lọ mất nhãn sau: HCl, Ba(OH)2, K2SO4. Câu 4: ( 4,5đ) Hòa tan hoàn toàn 9,4g Kali oxit vào 100ml nước cất (d = 1g/ml), thu dược dung dịch A. Viết PTHH xảy ra? Tính CM các chất trong dung dịch A? Tính C% các chất trong dung dịch A? Nếu thay 9,4 gam Kali oxit bằng 9,4g Kali thì C% của các chất trong dd A có thay đổi không? Vì sao? ĐÁP ÁN VÀ BIỂU ĐIỂM Đề 01: TT CTHH Phân loại Tên gọi Oxit Axit Bazo Muối 1 Fe(OH)3 x Sắt(III) hidroxit 2 CO2 x Cacbon đioxit 3 CaO x Canxi oxit 4 H2SO4 x Axit sunfuric 5 CuCl2 x Đồng(II) Clorua Mỗi đáp án đúng được 0,25điểm Câu Nội dung Điểm 2 a. CaCO3 CaO + CO2 - Phản ứng phân hủy b. Zn + 2HCl ZnCl2 + H2 - Phản ứng thế c. 2Cu + O2 2CuO - Phản ứng hóa hợp d. 2Na + 2H2O 2NaOH + H2 - Phản ứng thế 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 3 - Trích mấu thử và đánh số thứ tự. - Cho quỳ tím vào các mẫu thử: + Mẫu thử làm quỳ tím hóa xanh là: NaOH + Mẫu thử làm quỳ tím hóa xanh là: H2SO4 + Mẫu thử không làm đổi màu quỳ tím là: BaCl2 0,25đ 0,25đ 0,25đ 0,25đ 4 PTHH: Na2O + H2O 2NaOH nNa2O = 6,2/62 = 0,1 mol Theo PTHH: nNaOH = 2nNa2O = 0,2 mol CM = c. mNaOH = 0,2.40 = 8 gam mH2O = d.V = 100.1 = 100 gam mdd = mH2O + mNa = 100 + 6,2 = 106,2 gam C% = d. Thay Na2O bằng Na, ta có PTHH: 2Na + 2H2O 2NaOH + H2 nNa = 6,2/23 = 0,27 mol Theo PTHH: nNaOH = nNa = 0,27 mol mNaOH = 0,27.40 = 10,8 gam mH2O = d.V = 100.1 = 100 gam mH2 = mdd sau phản ứng = mH2O + mNa – mH2= 100 + 6,2 – 0,27 = 105,93 gam C% = Vậy C% đã thay đổi. 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,5đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ Đề 02: TT CTHH Phân loại Tên gọi Oxit Axit Bazo Muối 1 Fe(OH)2 x Sắt(II) hidroxit 2 SO2 x Lưu huỳnh đioxit 3 BaO x Bari oxit 4 H2SO3 x Axit sunfuro 5 AgNO3 x Bạc Nitrat Mỗi đáp án đúng được 0,25điểm Câu Nội dung Điểm 2 a. 2KClO3 2KCl + 3O2 - Phản ứng phân hủy b. Fe + 2HCl FeCl2 + H2 - Phản ứng thế c. 3Fe + 2O2 Fe3O4 - Phản ứng hóa hợp d. 2K + 2H2O 2KOH + H2 - Phản ứng thế 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 3 - Trích mấu thử và đánh số thứ tự. - Cho quỳ tím vào các mẫu thử: + Mẫu thử làm quỳ tím hóa xanh là: Ba(OH)2 + Mẫu thử làm quỳ tím hóa xanh là: HCl + Mẫu thử không làm đổi màu quỳ tím là: K2SO4 0,25đ 0,25đ 0,25đ 0,25đ 4 PTHH: K2O + H2O 2KOH nNa2O = 9,4/94 = 0,1 mol Theo PTHH: nKOH = 2nK2O = 0,2 mol CM = c. mKOH = 0,2.56 = 11,2 gam mH2O = d.V = 100.1 = 100 gam mdd = mH2O + mK = 100 + 9,4 = 109,4 gam C% = d. Thay K2O bằng K, ta có PTHH: 2K + 2H2O 2KOH + H2 nK = 9,4/39 = 0,24 mol Theo PTHH: nKOH = nK = 0,24 mol MKOH = 0,24.56 = 13,44 gam mH2O = d.V = 100.1 = 100 gam mH2 = mdd sau phản ứng = mH2O + mK – mH2= 100 + 9,4 – 0,24 = 109,16 gam C% = Vậy C% đã thay đổi. 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,5đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ 0,25đ
Tài liệu đính kèm:
 de_kiem_tra_hoc_ki_II_new.doc
de_kiem_tra_hoc_ki_II_new.doc





