Đề kiểm tra học kỳ I lớp 10 năm học: 2012 – 2013 môn: Hóa chương trình: nâng cao - chuẩn thời gian làm bài: 45 phút (không kể thời gian phát, chép đề)
Bạn đang xem tài liệu "Đề kiểm tra học kỳ I lớp 10 năm học: 2012 – 2013 môn: Hóa chương trình: nâng cao - chuẩn thời gian làm bài: 45 phút (không kể thời gian phát, chép đề)", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
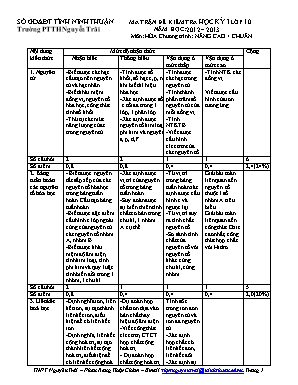
SỞ GD&ĐT TỈNH NINH THUẬN MA TRẬN ĐỀ KIỂM TRA HỌC KỲ I LỚP 10 Trường PTTH Nguyễn Trãi NĂM HỌC: 2012 – 2013 Môn: HÓA Chương trình: NÂNG CAO + CHUẨN Nội dung kiến thức Mức độ nhận thức Cộng Nhận biết Thông hiểu Vận dụng ở mức thấp Vận dụng ở mức cao 1. Nguyên tử -Biết được các hạt cấu tạo nên nguyên tử và hạt nhân -Biết khái niệm đồng vị, nguyên tố hóa học, công thức tính số khối -Thứ tự các mức năng lượng của e trong nguyên tử -Tính được số khối, số hạt e, p, n khi biết kí hiệu hóa học -Xác định được số e tối đa trong 1 lớp, 1 phân lớp -Xác định được nguyên tố kim loại, phi kim và nguyên tố s, p, d,f -Tính được các hạt trong nguyên tử. -Tính thành phần trăm số nguyên tử của mỗi đồng vị . -Tính NTKTB -Viết được cấu hình electron của các nguyên tố -Tính NTK các đồng vị. Viết được cấu hình của ion tương ứng Số câu hỏi 2 2 1 1 6 Số điểm 0,8 0,8 0,4 0,4 2,4(24%) 2. Bảng tuần hoàn các nguyên tố hóa học - Biết được nguyên tắc sắp xếp của các nguyên tố hóa học trong bảng tuần hoàn. Cấu tạo bảng tuần hoàn -Biết được đặc điểm cấu hình e lớp ngoài cùng của nguyên tử các nguyên tố nhóm A, nhóm B. -Biết được khái niệm độ âm điện, tính kim loại, tính phi kim và quy luật tính biến đổi trong 1 nhóm, 1 chu kì -Xác định được vị trí của nguyên tố trong bảng tuần hoàn -Suy đoán được sự biến thiên tính chất cơ bản trong chu kì, 1 nhóm A cụ thể -Từ vị trí trong bảng tuần hoàn xác định được cấu hình e và ngược lại. -Từ vị trí suy ra tính chất nguyên tố -So sánh tính chất của nguyên tố với nguyên tố khác cùng chu kì, cùng nhóm Giải bài toán liên quan đến nguyên tố thuộc 1 số nhóm A tiêu biểu Giải bài toán liên quan đến công thức Oxit cao nhất, công thức hợp chất với Hidro Số câu hỏi 2 1 1 1 5 Số điểm 0,8 0,4 0,4 0,4 2,0(20%) 3.Liên kết hoá học -Định nghĩa ion, liên kết ion, sự tạo thành liên kết ion,điều kiện để có liên kết ion -Định nghĩa, liên kết cộng hoá trị, sự tạo thành liên kết cộng hoá trị,điều kiện để có liên kết cộng hoá trị. -Khái niệm lai hoá, các dạng lai hoá sp, sp2, sp3. -Khái niệm sự xen phủ trục, xen phủ bên. -Sự hình thành liên kết đơn, liên kết đôi, liên kết ba. -Dự đoán hợp chất ion dựa vào bản chất hay hiệu độ âm điện. -Viết công thức electron, CTCT hợp chất cộng hoá trị. - Dự đoán hợp chất cộng hoá trị dựa vào bản chất hay hiệu độ âm điện. -Xác định hợp chất có cực, không cực. Tính số e trong ion đơn nguyên tử và ion đa nguyên tử -Xác định hợp chất có liên kết đơn, liên kết đôi. -Xác định sự xen phủ s-s, s-p, p-p . -Xác định số oxi hoá của các nguyên tố trong hợp chất, trong ion. Số câu hỏi 2 2 2 6 Số điểm 10,8 0,8 0,8 2,4(24%) 4.Phản ứng hoá học -Các khái niệm chất oxi hoá,chất khử ,sự oxi hoá,sự khử,phản ứng oxi hoá - khử - Khái niệm phản ứng toả nhiệt và phản ứng thu nhiệt. ý nghĩa của phương trình nhiệt hoá học. - Phân biệt được chất oxi hóa và chất khử, sự oxi hoá và sự khử trong phản ứng oxi hoá - khử cụ - Xác định được một phản ứng thuộc loại phản ứng oxi hoá- khử dựa vào sự thay đổi số oxi hoá của các nguyên tố. - Lập được phương trình hoá học của phản ứng oxi hoá - khử theo phương pháp thăng bằng electron Số câu hỏi 2 1 1 4 Số điểm 0,8 0,4 0,4 1,6(16%) 5.Bài tâp tổng hợp Số câu hỏi 1 1 2 4 Số điểm 0,4 0,4 0,8 1,6(16%) Tổng số câu 8 7 6 4 25 Tổng số điểm 3,2 (50%) 2,8 (22,5%) 2,4 (20%) 1,6 (7,5%) 10 (100%) SỞ GD&ĐT TỈNH NINH THUẬN ĐỀ KIỂM TRA HỌC KỲ I LỚP 10 Trường PTTH Nguyễn Trãi NĂM HỌC: 2012 – 2013 Môn: HÓA Chương trình: NÂNG CAO + CHUẨN Thời gian làm bài: 45 phút (Không kể thời gian phát, chép đề) Đề: (Đề kiểm tra có 03 trang) PHẦN CHUNG : ( 20 câu từ câu 1 đến câu 20 ) Câu 1: Nguyên tử X có 19 proton và nguyên tử Y có 9 electron. Hợp chất hình thành giữa 2 nguyên tố này có thể là : A. X2Y với liên kết cộng hóa trị. B. XY với liên kết ion C. X2Y với liên kết ion. D. XY với liên kết cộng hóa trị. Câu 2: Những ion Cl- , K+ , Ca2+ cùng có số electron (18e). Dãy sắp xếp nào sau đây theo trình tự bán kính ion tăng dần? A. Cl- < K+ < Ca2+ B. Ca2+ < K+ < Cl- C. K+ < Ca2+ < Cl- D. Cl- < Ca2+ < K+ Câu 3: Cho 10 gam ACO3 tác dụng với dung dịch HCl dư thì thu được 2,24 lít khí CO2(đktc). Cấu hình electron của A là ( biết A có số hạt proton bằng số hạt nơtron) A. 1s2 2s2 2p6 B. 1s2 2s2 2p6 3s2 C. 1s2 2s2 2p6 3s2 3p64s2 D. 1s2 2s2 2p6 3s2 3p4 Câu 4: Cho 1,82 g một kim loại kiềm tác dụng hết với 48,44 gam nước , sau phản ứng thu được 2,912 lít khí H2 (đktc) và dung dịch X . Kim loại kiềm và nồng độ phần trăm dung dịch X là : A. Li , 12,48 %. B. Li , 44%. C. Na , 31,65 %. D. Na , 44%. Câu 5: Trong tự nhiên đồng có 2 đồng vị vị và . Nguyên tử khối trung bình của Cu là 63,54. Biết MCl =35,5. Thành phần phần trăm về khối lượng của trong CuCl2 là A. 27% B. 34,18% C. 12,64% D. 26,77% Câu 6: Trong tự nhiên Oxi có 3 đồng vị 16O(x1%) , 17O(x2%) , 18O(4%), nguyên tử khối trung bình của Oxi là 16,14. Phần trăm đồng vị 16O và 17O lần lượt là: A. 35% & 61% B. 90% & 6% C. 80% & 16% D. 25% & 71% Câu 7: Tổng số hạt mang điện trong ion AB32- bằng 82. Số hạt mang điện trong hạt nhân của nguyên tử A nhiều hơn số hạt mang điện trong hạt nhân của nguyên tử B là 8. Số hiệu nguyên tử của hai nguyên tố A và B là: A. 16 và 8 B. 13 và 9 C. 15 và 7 D. 14 và 10 Câu 8: Trong một nguyên tử, điều khẳng định sau đây bao giờ cũng đúng: A. Số hiệu nguyên tử bằng điện tích hạt nhân B. Bán kính proton bằng bán kính electron C. Số proton trong hạt nhân bằng số electron ở lớp vỏ D. Số proton bằng số nơtron Câu 9: Có bao nhiêu electron trong ion Cr3+? A. 21 B. 24 C. 27 D. 52 Câu 10: Sắp xếp các nguyên tố sau: P(Z=15), N(Z=7), O(Z=8), Si(Z=14) theo thứ tự tính phi kim tăng dần từ trái sang phải. A. Si ; P ; N ; O. B. N ; P ; O ; Si. C. N ; O ; Si ; P. D. Si ; N ; P ; O. Câu 11: Phân tử chất nào sau đây có chứa liên kết ion . A. HNO3 B. H2O C. C2H4 D. NaOH Câu 12: Ở phân lớp 3d số electron tối đa là: A. 14 B. 6 C. 18 D. 10 Câu 13: Cho số hiệu nguyên tử của Clo, Oxi, Natri và Hiđro lần lượt là 17, 8, 11 và 1. Hãy xét xem kí hiệu nào sau đây không đúng ? A. B. C. D. Câu 14: Anion X2- có cấu hình electron của phân lớp ngoài cùng là 3p6. Vị trí của X trong bảng tuần hoàn là: A. Chu kì 4, nhóm II A. B. Chu kì 4, nhóm II B. C. Chu kì 3, nhóm VI A. D. Chu kì 3, nhóm IVA. Câu 15: Cho 6 nguyên tố có phân mức năng lượng cao nhất là: 1s2, 3s2, 3p1, 3p2, 3p6, 4p4. Số nguyên tử kim loại, phi kim, khí hiếm trong số các nguyên tử trên lần lượt là A. 3, 2, 1 B. 4, 1, 4 C. 2, 2, 2 D. 2, 3, 1 Câu 16: Số hiệu nguyên tử nitơ bằng 7, hidro bằng 1. Tổng số hạt mang điện trong ion NH4+ bằng bao nhiêu? A. 18 B. 20 C. 22 D. 21 Câu 17: Khi tạo thành liên kết ion, nguyên tử cho e hóa trị để trở thành A. Ion âm có số proton không thay đổi . B. Ion dương có số proton không thay đổi . C. Ion âm có nhiều proton hơn . D. Ion dương có nhiều proton hơn . Câu 18: Chọn câu trả lời đúng trong các câu sau: Trong một chu kì, theo chiều tăng của điện tích hạt nhân nguyên tử: A. Tính kim loại và tính phi kim giảm. B. Tính kim loại giảm, tính phi kim tăng. C. Tính kim loại tăng, tính phi kim giảm. D. Tính kim loại và tính phi kim tăng. Câu 19: Nhóm chất nào sau đây chỉ chứa liên kết cộng hóa trị? A. KCl, AgNO3, NaOH B. NaCl, H2O, HCl C. H2S, CO2, HCN D. CO2, H2SO4, MgCl2 Câu 20: Cho các phát biểu sau: a) Nguyên tử có cấu trúc đặc khít, gồm vỏ nguyên tử và hạt nhân nguyên tử. b) Đồng vị là những nguyên tử có cùng số proton và khác số nơtron. c) Trong nguyên tử số nơtron luôn luôn bằng số proton. d) Số thứ tự nhóm bằng số electron lớp ngoài cùng. e) Số thứ tự của chu kì bằng số lớp electron. Số phát biểu đúng là A. 5. B. 2. C. 4. D. 3. PHẦN RIÊNG : [5 câu] Phần A . Theo chương trình Nâng cao ( 5 câu , từ câu 21 đến câu 25) Câu 21: Chất nào sau đây có cấu tạo tứ diện A. C2H2 B. C2H4 C. NH3 D. H2S Câu 22: Nhận xét nào sau đây sai? A. Các obitan khác nhau trong cùng một lớp có cùng mức năng lượng nhưng sự định hướng trong không gian khác nhau. B. Các e trong nguyên tử chuyển động hỗn loạn ở khu vực xung quanh hạt nhân. C. Các e khác nhau trên cùng 1 obitan phải có chiều tự quay ngược nhau. D. Các obitan khác nhau trên cùng một phân lớp có cùng mức năng lượng nhưng khác nhau về sự định hướng trong không gian. Câu 23: Cho phản ứng sau: Mg + HNO3 Mg(NO3)2 + NH4NO3 + H2O (các hệ số trong phương trình là các số nguyên tối giản). Tổng hệ số của các chất trong phương trình trên bằng A. 20 B. 23 C. 21 D. 22 Câu 24: Cho 3,1 gam hỗn hợp hai kim loại thuộc hai chu kì liên tiếp, nhóm IIA tác dụng hết với dung dịch HCl dư thu được 4,48 lít khí H2 (đktc). Hai kim loại đó là: A. Mg (M =24) và Ca (M=40). B. Ca (M=40) và Sr (M= 88). C. Be (M = 9) và Mg (M = 24). D. Mg (M=24) và Ba (M=137). Câu 25: Cho phản ứng hóa học sau: H2O2 + 2KI I2 + 2KOH. Câu nào diễn tả đúng nhất tính chất của các chất? A. H2O2 là chất oxi hoá. B. KI là chất oxi hoá C. H2O2 là chất khử. D. H2O2 vừa là chất oxi hoá vừa là chất khử Phần B . Theo chương trình Chuẩn ( 5 câu , từ câu 26 đến câu 30) Câu 26: Số oxi hóa của nguyên tố N trong các chất và ion NH4+, Li3N, HNO2, NO2, NO3–, KNO3 lần lượt là: A. –3; +3; +3; +4; +5 và +5. B. –4; –3; +3; +4; +5 và +5. C. –3; –3; +3; +4; –5 và +5. D. –3; –3; +3; +4; +5 và +5. Câu 27: Hợp chất khí với Hidrô của nguyên tố R là RH4. Oxit cao nhất của nó chứa 53,33% Oxi về khối lượng . R là A. Cacbon (M=12) B. Lưu huỳnh (M=32) C. Photpho (M=31) D. Silic (M=28) Câu 28: Cặp chất chứa liên kết cộng hóa trị phân cực là : A. H2O và HCl. B. Cl2 và HCl. C. N2 và Cl2. D. H2O và NaCl. Câu 29: Trong lớp M có số phân lớp là : A. 4. B. 2. C. 5. D. 3. Câu 30: Trong hợp chất CaF2 , Ca và F có điện hóa trị lần lượt là: A. 2 và 1. B. 2+ và 1–. C. –2 và –1. D. +2 và –1. ----------------------------------------------- ----------- HẾT ---------- SỞ GD&ĐT TỈNH NINH THUẬN ĐỀ KIỂM TRA 1 TIẾT HỌC KỲ I LỚP 10 Trường PTTH Nguyễn Trãi NĂM HỌC: 2012 – 2013 Môn: HÓA Chương trình: NÂNG CAO + CHUẨN ĐÁP ÁN, HƯỚNG DẪN CHẤM VÀ BIỂU ĐIỂM 1 B 2 B 3 C 4 A 5 B 6 B 7 A 8 C 9 A 10 A 11 D 12 D 13 C 14 C 15 C 16 D 17 B 18 B 19 C 20 B 21 C 22 A 23 D 24 C 25 A 26 D 27 D 28 A 29 D 30 B
Tài liệu đính kèm:
 Kiem_tra_HK1_hoa_10_truong_Nguyen_Trai.doc
Kiem_tra_HK1_hoa_10_truong_Nguyen_Trai.doc





