Đề kiểm tra học kì II Hóa học lớp 8 - Người ra: Trần Xuân Thủy
Bạn đang xem tài liệu "Đề kiểm tra học kì II Hóa học lớp 8 - Người ra: Trần Xuân Thủy", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
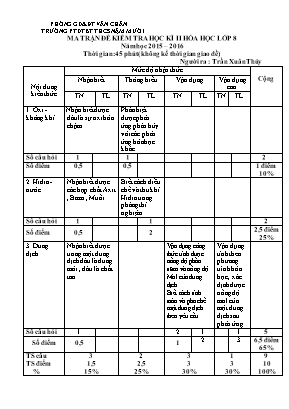
PHÒNG GD&ĐT VĂN CHẤN TRƯỜNG PTDTBT THCS NẬM MƯỜI MA TRẬN ĐỀ KIỂM TRA HỌC KÌ II HÓA HỌC LỚP 8 Năm học 2015 – 2016 Thời gian: 45 phút( không kể thời gian giao đề) Người ra : Trần Xuân Thủy Nội dung kiến thức Mức độ nhận thức Cộng Nhận biết Thông hiểu Vận dụng Vận dụng cao TN TL TN TL TN TL TN TL 1. Oxi - không khí Nhận biết được đâu là sự oxi hóa chậm Phân biệt được phản ứng phân hủy với các phản ứng hóa học khác Số câu hỏi 1 1 2 Số điểm 0,5 0,5 1 điểm 10% 2. Hidro - nước Nhận biết được các hợp chất Axit , Bazơ , Muối Biết cách điều chế và thu khí Hidro trong phòng thí nghiệm Số câu hỏi 1 1 2 Số điểm 0,5 2 2,5 điểm 25% 3. Dung dịch. Nhận biết được trong một dung dịch đâu là dung môi , đâu là chất tan Vận dụng công thức tính được nồng độ phần trăm và nồng độ Mol của dung dịch Biết cách tính toán và pha chế một dung dịch theo yêu cầu Vận dụng tính theo phương trình hóa học , xác định được nồng độ mol của một dung dịch sau phản ứng. Số câu hỏi 1 2 1 1 5 Số điểm 0,5 1 2 3 6,5 điểm 65% TS câu TS điểm % 3 1,5 15% 2 2,5 25% 3 3 30% 1 3 30% 9 10 100% PHÒNG GD&ĐT VĂN CHẤN TRƯỜNG PTDTBT THCS NẬM MƯỜI ĐỀ KIỂM TRA HỌC KÌ II HÓA HỌC LỚP 8 Năm học 2015 – 2016 Thời gian: 45 phút( không kể thời gian giao đề) Người ra : Trần Xuân Thủy I. TRẮC NGHIỆM: (3,0 điểm) Khoanh tròn vào một trong các chữ A, B, C hoặc D đứng trước phương án đúng nhất trong các câu sau: Câu 1. Sự oxi hoá chậm là: A. Sự oxi hoá mà không toả nhiệt. B. Sự oxi hoá mà không phát sáng. C. Sự oxi hoá toả nhiệt mà không phát sáng. D. Sự tự bốc cháy. Câu 2. Phản ứng nào dưới đây thuộc loại phản ứng phân hủy? A. CO2 + Ca(OH)2 t0 CaCO3 + H2O B. CaO + H2O t0 Ca(OH)2 C. 2KMnO4 t0 K2MnO4 + MnO2 + O2 D. CuO + H2 t0 Cu + H2O Câu 3. Nhóm các chất nào sau đây đều là muối ? A. NaOH, HCl, Ca(OH)2, NaCl B. Ca(OH)2, Al2O3, H2SO4, NaOH C. MgCl2, NaHCO3, K2SO4, Ca(NO3)2 D. NaOH, Ca(OH)2, MgO, K2O Câu 4. Khi hòa tan Na2SO4 vào nước thì: A. Na2SO4 là dung môi. B. Nước là dung dịch C. Nước là chất tan. D. Na2SO4 là chất tan. Câu 5. Hòa tan hoàn toàn 50gam muối ăn (NaCl) vào 200g nước ta thu được dung dịch có nồng độ là A. 15% B. 20% C. 25% D. 28% Câu 6. Trộn 2 lít dung dịch H2SO4 4M vào 4 lít dung dịch H2SO4 0,25M. Nồng độ mol của dung dịch mới là: A. 1,5M B. 2,5M C. 2,0M D. 3,5M II . PHẦN TỰ LUẬN: (7,0 điểm) Câu 1.( 2 điểm) Khi thu khí Hidro vào ống nghiệm bằng cách đẩy không khí ta phải để vị trí ống nghiệm như thế nào ? Đối với Oxi có thể làm như thế được không ? Vì sao? Câu 2.( 2 điểm) Hãy tính toán và trình bày cách pha chế : 50 gam dung dịch đường có nồng độ 15%? Câu 3.( 3 điểm) Cho 1,86 g Natri oxit tác dụng với nước thu được 250 ml dung dịch Natrihiđroxit. Viết phương trình hóa học cho phản ứng xảy ra? Tính nồng độ mol của dung dịch thu được? ( Na = 23 , O = 16 , H= 1 ) PHÒNG GD&ĐT VĂN CHẤN TRƯỜNG PTDTBT THCS NẬM MƯỜI ĐÁP ÁN ĐỀ KIỂM TRA HỌC KÌ II HÓA HỌC LỚP 8 Năm học 2015 – 2016 Thời gian: 45 phút( không kể thời gian giao đề) Người ra : Trần Xuân Thủy I. TRẮC NGHIỆM: (3,0 điểm) Câu 1 2 3 4 5 6 Đáp án C C C D C A Điểm 0,5 0,5 0,5 0,5 0,5 0,5 II . PHẦN TỰ LUẬN: (7,0 điểm) Câu Đáp án Điểm 1 - Khi thu Hidro bằng cách đẩy không khí ta phải đặt miệng ống nghiệm úp xuống . - Đối với Oxi ta không làm như vậy mà phải đặt ngửa ống nghiệm vì Ôxi nặng hơn không khí còn Hidro nhẹ hơn không khí 1 1 2 - Tính toán mct = 15 x50/100 = 7,5 gam mH2O cần dùng là: 50 – 7,5 = 42,5 gam. - Cách pha chế: Cân 7,5 gam đường khan cho vào cốc có dung tích 100ml, khuấy đều với 42,5 gam nước, ta được dung dịch đường 15%. 0,5 0,5 1 3 a. Viết PTHH: Na2O + H2O 2NaOH b. theo giả thiết nNa2O = 0,03 (Mol) Na2O + H2O 2NaOH 1 2 ( Mol) 0,03 ? ( Mol) - Theo phương trình hóa học ta có: nNaOH = ( 2.0,03 ) : 1= 0,06 (Mol) => CM NaOH = 0,06/ 0,25 = 0,24 (M ) 1 0,5 0,5 0,5 0,5
Tài liệu đính kèm:
 de_kiem_tra_hoa_8_ki_II_ti_le_37_chuan.doc
de_kiem_tra_hoa_8_ki_II_ti_le_37_chuan.doc





