Đề kiểm tra học kì I môn Hóa học Lớp 8 - Năm học 2022-2023 - Trường THCS Tân Tri (Có đáp án)
Bạn đang xem tài liệu "Đề kiểm tra học kì I môn Hóa học Lớp 8 - Năm học 2022-2023 - Trường THCS Tân Tri (Có đáp án)", để tải tài liệu gốc về máy bạn click vào nút DOWNLOAD ở trên
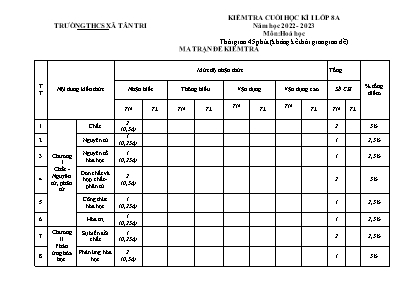
TRƯỜNG THCS XÃ TÂN TRI KIỂM TRA CUỐI HỌC KÌ I LỚP 8A Năm học 2022 - 2023 Môn: Hoá học Thời gian 45 phút (không kể thời gian giao đề) MA TRẬN ĐỀ KIỂM TRA TT Nội dung kiến thức Mức độ nhận thức Tổng % tổng điểm Nhận biết Thông hiểu Vận dụng Vận dụng cao Số CH TN TL TN TL TN TL TN TL TN TL 1 Chương I Chất - Nguyên tử, phân tử Chất 2 (0,5đ) 2 5% 2 Nguyên tử 1 (0,25đ) 1 2,5% 3 Nguyên tố hóa học 1 (0,25đ) 1 2,5% 4 Đơn chất và hợp chất - phân tử 2 (0,5đ) 2 5% 5 Công thức hóa học 1 (0,25đ) 1 2,5% 6 Hóa trị 1 (0,25đ) 1 2,5% 7 Chương II Phản ứng hóa học Sự biến đổi chất 1 (0,25đ) 2 2,5% 8 Phản ứng hóa học 2 (0,5đ) 1 5% 9 Định luật bảo toàn khối lượng 1 (0,25đ) 1** (2đ) 1** (1đ) Đề, ĐA, đặc tả không có 1 1 30,25% 10 Phương trình hóa học 1 (0,25đ) 1* (3đ) 1 1 30,25% 11 Chương 3. Mol và tính toán hóa học Mol. Sự chuyển đổi giữa khối lượng, thể tích và mol 1 (0,25đ) 1 2,5% 12 Tỉ khối của chất khí 1 (0,25đ) 1 2,5% 13 Tính theo công thức hóa học 1 (0,25đ) 1 câu ở đây 1 1 2,5% Tổng 16 2 2 1 16 3 100% Tỉ lệ % 40% 30% 20% 10% Tỉ lệ chung 70% 30% Lưu ý: - Các câu hỏi ở cấp độ nhận biết là các câu hỏi trắc nghiệm khách quan 4 lựa chọn, trong đó có duy nhất 1 lựa chọn đúng. - Mỗi câu trắc nghiệm khách quan được tính 0,25 điểm. - Có 2 câu thông hiểu là dạng tự luận (câu 1* - 1 điểm; câu 2* - 2 điểm) - Có 2 câu vận dụng là dạng tự luận (Mỗi câu 1 điểm) - Có 1 vận dụng cao là dạng tự luận (1 điểm) - Đã chọn câu mức độ “thông hiểu” ở đơn vị kiến thức này thì không chọn câu “vận dụng” ở đơn vị kiến thức đó. TRƯỜNG THCS XÃ TÂN TRI KIỂM TRA CUỐI HỌC KÌ I LỚP 8A Năm học 2022 - 2023 Môn: Hoá học Thời gian 45 phút (không kể thời gian giao đề) BẢNG ĐẶC TẢ KĨ THUẬT ĐỀ KIỂM TRA TT Nội dung kiến thức Đơn vị kiến thức Mức độ kiến thức, kĩ năng cần kiểm tra, đánh giá Số câu hỏi theo các mức độ nhận thức Tổng Nhận biết Thông hiểu Vận dụng VD cao 1 Chương I Chất - Nguyên tử, phân tử Chất *Nhận biết: - Biết được đâu là vật thể tự nhiên, vật thể nhân tạo - Biết một số tính chất của chất 2 0,5 2 Nguyên tử *Nhận biết: Biết được nguyên tử là hạt vô cùng nhỏ, trung hoà về điện gồm hạt nhân mang điện tích dương và vỏ là các electron mang điện tích âm. 1 0,25 3 Nguyên tố hóa học *Nhận biết: - Biết được “nguyên tố hoá học là tập hợp những nguyên tử cùng loại, những nguyên tử có cùng số proton trong hạt nhân” - Biết KHHH dùng để biểu diễn nguyên tố, mỗi KH còn dùng chỉ 1 nguyên tử. 1 0,25 4 Đơn chất và hợp chất - phân tử *Nhận biết: - Biết được khái niệm đơn chất là những chất do một nguyên tố hóa học tạo nên, hợp chất là những chất được cấu tạo từ 2 nguyên tố hóa học trở lên. - Biết được phân tử là những hạt đại diện cho chất gồm một số nguyên tử liên kết với nhau và thể hiện tính chất hóa học của chất đó. -Khái niệm phân tử khối là khối lượng của phân tử tính bằng đơn vị cacbon, bằng tổng các nguyên tử khối của các nguyên tử trong phân tử. *Thông hiểu:Tính được phân tử khối của các chất *Vận dụng: Dựa vào PTK để so sánh xem phân tử chất này nặng hơn hay nhẹ hơn phân tử của chất kia bao nhiêu lần. 2 0,5 5 Công thức hóa học *Thông hiểu: - Biết được ý nghĩa của hệ số trước CTHH. - Viết CTHH của chất khi biết tên và ngược lại - Ý nghĩa của CTHH *Vận dụng: Dựa vào PTK để so sánh xem phân tử chất này nặng hơn hay nhẹ hơn phân tử của chất kia bao nhiêu lần. 1 0,25 6 Hóa trị *Nhận biết: - HS hiểu được hoá trị biểu thị khả năng liên kết của nguyên tử nguyên tố này với nguyên tố khác hay nhóm nguyên tử khác. -Quy ước : Hoá trị của H là I, hoá trị của O là II, hoá trị của một nguyên tố trong hợp chát cụ thể được xác định theo hoá trị của H và O - Làm quen với hoá trị của một số nguyên tố và một số nhóm nguyên tử thường gặp. - Biết quy tắc về hoá trị và biểu thức: trong hợp chất 2 nguyên tố AxBy thì x.a=y.b (a, b là hoá trị tương ứng của 2 nguyên tố A, B). Quy tắc đúng với cả khi A hay B là nhóm nguyên tử. *Thông hiểu: Tính được hoá trị của nguyên tố hoặc nhóm nguyên tử theo CTHH cụ thể. - Áp dụng quy tắc để tính hóa hoá trị của một nguyên tố (hoặc một số nhóm nguyên tử) thường gặp. *Vận dụng: Lập CTHH của chất theo hóa trị *Vận dụng cao: Lập CTHH của chất dựa theo công thức của chất có sẵn (bằng cách tính hóa trị rồi lập CTHH) 1 0,25 7 Chương II Phản ứng hóa học Sự biến đổi chất *Nhận biết: - Biết được hiện tượng vật lí là hiện tượng trong đó không có sự biến đổi chất này thành chất khác. - Biết được hiện tượng hóa học là hiện tượng trong đó có sự biến đổi chất này thành chất khác. *Thông hiểu: HS phân biệt được hiện tượng vật lí và hiện tượng hoá học 1 0,25 8 Phản ứng hóa học *Nhận biết: - Biết được phản ứng hoá học là 1 quá trình biến đổi chất này thành chất khác. - Để phản ứng hoá học xảy ra, các chất phản ứng phải tiếp xúc với nhau hoặc cần thêm nhiệt độ cao hay chất xúc tác. - Biết được chất tham gia và chất tạo thành trong 1 PƯHH. *Thông hiểu: - Biết được bản chất của phản ứng hoá học là sự thay đổi về liên kết giữa các nguyên tử làm cho phân tử này biến đổi thành phân tử khác. - Để nhận biết có phản ứng hoá học xảy ra, dựa vào dấu hiệu có chất mới tạo thành mà ta quan sát được như thay đổi màu sắc, tạo kết tủa, chất khí thoát ra. *Vận dụng: - Viết được PT chữ của phản ứng hóa học 2 0,5 9 Định luật bảo toàn khối lượng *Nhận biết: - Biết được nội dung của định luật bảo toàn khối lượng. *Thông hiểu: - Giải thích được định luật dựa vào sự bảo toàn về khối lượng của nguyên tử trong PƯHH. - Viết được biểu thức liên hệ giữa khối lượng các chất trong một số phản ứng cụ thể.Tính được khối lượng của một chất trong phản ứng khi biết khối lượng của các chất còn lại. *Vận dụng: - Quan sát thí nghiệm, vận dụng định luật để tính toán, rút ra kết luận về sự nặng nhẹ các đĩa cân hoặc các cốc dung dịch sau phản ứng. 1 1 2,25 10 Phương trình hóa học *Nhận biết: - Biết được phương trình dùng để biểu diễn ngắn gọn PƯHH. - Biết được các bước lập PTHH *Thông hiểu: - Lập được PTHH khi biết sơ đồ của phản ứng - HS hiểu được ý nghĩa của PTHH *Vận dụng: - Từ thí nghiệm, viết được sơ đồ phản ứng, lập được PTHH. - Tìm được công thức hóa học thích hợp điền vào sơ đồ phản ứng, lập được PTHH. 1 1 3,25 11 Chương 3. Mol và tính toán hóa học Mol. Sự chuyển đổi giữa khối lượng, thể tích và mol *Nhận biết: - Biết được các khái niệm: Mol, Khối lượng Mol, thể tích Mol của chất khí. - Biết công thức tính khối lượng chất, thể tích chất khí ở đktc *Thông hiểu: - Tính được số nguyên tử, số phân tử, khối lượng mol, thể tích mol chất khí ở đktc khi biết lượng chất (số mol) - Viết được công thức chuyển đổi giữa l ượng chất (số mol chất), khối lư ợng chất và khối lượng mol chất. - Tính được lượng chất hoặc khối lượng chất hoặc khối lượng mol chất khi biết hai đại lượng còn lại. - Viết được công thức chuyển đổi giữa lượng chất khí (đktc) và thể tích khí. - Tính được lượng chất khí hoặc thể tích chất khí ở đktc khi biết đại lượng còn lại. *Vận dụng: - So sánh được thể tích các chất khí ở đktc khi biết khối lượng của các chất khí. 1 0,25 12 Tỉ khối của chất khí *Nhận biết: - Biết các công thức cách xác định tỉ khối A đối với khí B và biết cách xác định tỉ khối của một chất khí đối với không khí. *Thông hiểu: - Viết được các công thức chuyển đổi giữa các đại lượng dA/B; MA; MB; dA/KK; MKK *Vận dụng: - Vận dụng công thức tính tỉ khối của chất khí để xác định khí A nặng hay nhẹ hơn khí B, khí A nặng hay nhẹ hơn không khí. *Vận dụng cao: - Giải thích được một số hiện tượng thực tế. 1 0,25 13 Tính theo công thức hóa học *Nhận biết: - Biết các bước tiến hành tính công thức hóa học và thành phần các nguyên tố. *Thông hiểu: - Từ công thức hoá học, xác định được thành phần phần trăm theo khối lượng của các nguyên tố. *Vận dụng: - Lập được CTHH từ phần trăm các nguyên tố và khối lượng mol của chất *Vận dụng cao: - Biết CTHH của hợp chất, tính được thành phần % theo khối lượng các nguyên tử của các NTHH tạo ra chất. - Lập được công thức hóa học của hợp cất biết tỉ lệ khối lượng giữa các nguyên tố trong hợp chất. 1 1 1,25 Tổng số câu 16 1 1 1 10 Tỉ lệ % từng mức độ nhận thức 40% 30% 20% 10% 100% Tỉ lệ chung 70% 30% TRƯỜNG THCS XÃ TÂN TRI KIỂM TRA CUỐI HỌC KÌ I LỚP 8A Năm học 2022 - 2023 Môn: Hoá học Thời gian 45 phút (không kể thời gian giao đề) Đề gồm 02 trang, 19 câu PHẦN I. Trắc nghiệm (4,0 điểm) Chọn ý trả lời đúng nhất cho các câu hỏi dưới dây bằng cách khoanh tròn chữ cái trước ý được chọn. Câu 1. Trong các vật thể dưới đây, vật thể nào là vật thể tự nhiên? A) Cái nồi; B) Cái thìa nhựa; C) Cây ngô; D) Cái mũ Câu 2. Trong các tính chất dưới đây, đâu là tính chất vật lí của kim loại Sắt? A) Tác dụng được với axit; B) Tác dụng được với dung dịch muối; C) Dẫn điện tốt; D) Tác dụng được với khí Oxi. Câu 3. Trong các hạt cấu tạo nguyên tử, loại hạt nào không mang điện tích? A) Proton; B) Notron; C) Electron; D) Proton và Electron. Câu 4. Kí hiệu hóa học dùng để làm gì? A) Biểu diễn chất; B) Biểu diễn số lượng nguyên tử; C) Biểu diễn phản ứng hóa học; D) Biểu diễn nguyên tố hóa học. Câu 5. Trong các công thức hóa học dưới đây, công thức hóa học nào của đơn chất? A) CH4; B) NH3; C) H2; D) H2O. Câu 6. Phân tử khối của hợp chất được tính bằng đơn vị gì? A) Gam; B) Kalo; C) Đơn vị Cacbon; D) Niuton. Câu 7. Cách viết 3FeCl3, số “3” viết trước công thức hóa học FeCl3 có nghĩa là gì? A) 3 nguyên tử Fe; B) 3 phân tử FeCl3; C) 3 nguyên tử Cl; D) 3 chất. Câu 8. Biết Na có hóa trị I, biểu thức phù hợp với quy tắc hóa trị của công thức hóa học Na2O là? A) 2 x II = 2 x II; B) 2 x 2 = 1 x IV; C) 1 x III = 3 x I; D) 2 x I = 1 x 2. Câu 9. Trong các hiện tượng sau, đâu là hiện tượng hóa học? A) Sắt bị nam châm hút; B) Axit axetic để trong lọ chứa không có nắp bị bay hơi; C) Đốt lông gà thấy có mùi khét; D) Khí Amoniac có mùi khai. Câu 10. Cho phương trình chữ: Canxi hiđroxit + Axit nitric à Canxi nitrat + nước. Các chất nào là chất tham gia phản ứng? A) Canxi hiđroxit và Canxintrat; B) Canxi hiđroxit và nước C) Canxi hiđroxit và Axit nitric; D) Axit nitric và nước. Câu 11. Phản ứng hóa học: Kẽm tác dùng với Oxi, tạo thành Kẽm oxit. Trong phản ứng hóa học có bao nhiêu chất tham gia phản ứng? A) 1; B) 2; C) 3; D) 4. Câu 12. Trong các nội dung dưới đây, nội dung nào phù hợp vơi Định luật bảo toàn khối lượng? A) Trong phản ứng hóa học, số chất tham gia bằng số chất sản phẩm; B) Trong phản ứng hóa học, khối lượng các chất tham gia phản ứng bằng nhau; C) Trong phản ứng hóa học, khối lượng các chất sản phẩm bằng nhau; D) Trong phản ứng hóa học, tổng khối lượng các chất sản phẩm bằng tổng khối lượng các chất tham gia phản ứng. Câu 13. Lập phương trình hóa học thường thực hiện mấy bước? A) 1; B) 2; C) 3; D) 4. Câu 14. Thể tích 1 mol chất khí ở điều kiện tiêu chuẩn là bao nhiêu lít? A) 0,224 lít; B) 2,24 lít; C) 22,4 lít; D) 224 lít. Câu 15. Tỉ khối của khí A so với khí B được xác định bằng cách nào? A) Lấy khối lượng mol phân tử khí A “nhân” khối lượng mol phân tử khí B; B) Lấy khối lượng mol phân tử khí A “chia” khối lượng mol phân tử khí B; C) Lấy khối lượng mol phân tử khí A “cộng” khối lượng mol phân tử khí B; D) Lấy khối lượng mol phân tử khí A “trừ” khối lượng mol phân tử khí B. Câu 16. Bài tập xác định thành phần % theo khối lượng của nguyên tử các nguyên tố hóa học trong hợp chất H2O. Đầu tiên cần làm gì? A) Tính VH2O; B) Tính mH; C) Tính mO; D) Tính MH2O. PHẦN II. Trắc nghiệm (6,0 điểm) Câu 1 (3,0 điểm): Lập phương trình hóa học cho các sơ đồ phản ứng dưới đây: A) Zn + HCl ZnCl2 + H2 B) Fe + O2 Fe2O3 C) Ca(OH)2 + FeCl3 Fe(OH)3 + CaCl2 Câu 2 (2,0 điểm): Cho 1,2 gam Magie (Mg) tác dụng với 3,65 gam Axit clohiđric (HCl), thu được 4,75 gam Magie clorua và khí Hiđro. Tính khối lượng khí Hiđrô thu được. Câu 3 (1,0 điểm): Tính thành phần % theo khối lượng của nguyên tử các nguyên tố hóa học trong hợp chất AlCl3. (Biết khối lượng mol nguyên tử: Al = 27, Cl = 35,5) TRƯỜNG THCS XÃ TÂN TRI KIỂM TRA CUỐI HỌC KÌ I LỚP 8A Năm học 2022 - 2023 Hướng dẫn chấm điểm môn: Hoá học Hướng dẫn chấm gồm 01 trang Phần I. Trắc nghiệm (4,0 điểm) Mỗi ý học sinh chọn đúng, chấm 0,25 điểm Câu 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 Ý đúng C C B D C C B D C C B D C C B D Phần II. Tự luận (6,0 điểm) Câu Nội dung cần trả lời Điểm 1 (3,0 điểm) Mỗi PTHH lập đúng, chấm 1,0 điểm; đúng hệ số “2” trước công thức hóa học HCl, Fe2O3, FeCl3 hoặc Fe(OH)3, chấm 0,75 điểm; đúng 1 trong số các hệ số, chấm 0,25 đến 0,5 điểm. Không có hệ số nào phù hợp, không chấm điểm A) Zn + 2HCl ZnCl2 + H2 B) 4Fe + 3O2 2Fe2O3 C) 3Ca(OH)2 + 2FeCl3 2Fe(OH)3 + 3CaCl2 2 (2,0 điểm) - Biểu thức về khối lượng của phản ứng: mMg+mHCl=mMgCl2+mH2 => mH2= (mMg+mHCl)-mMgCl2 - Tính khối lượng H2 thu được: mH2 = (1,2 + 3,65) – 4,75 = 0,1 (g) Nếu học sinh trình bày các khác mà đúng, chấm điểm tối đa 0,5 0,5 0,75 0,25 3 (1,0 điểm) - Tính khối lượng mol phân tử hợp chất: MAlCl3=27+3.35,5 = 133,5 (g) - Số mol nguyên tử mỗi nguyên tố hóa học trong 1 mol phân tử hợp chất: nAl = 1 (mol); nCl = 3 (mol) - Khối lượng nguyên tử mỗi nguyên tố hóa học trong 1 mol phân tử hợp chất: mAl = 1.27 = 27(g); mCl = 3.35,5 = 106,5(g) - Thành phần phần trăm theo khối lượng nguyên tử mỗi nguyên tố hóa học của hợp chất. %mAl=27133,5x100%≈20,2% %mCl=106,5133,5x100%≈79,8% 0,25 0,25 0,25 0,25
Tài liệu đính kèm:
 de_kiem_tra_hoc_ki_i_mon_hoa_hoc_lop_8_nam_hoc_2022_2023_tru.docx
de_kiem_tra_hoc_ki_i_mon_hoa_hoc_lop_8_nam_hoc_2022_2023_tru.docx





